- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Механизмы гормонального канцерогенеза
Содержание
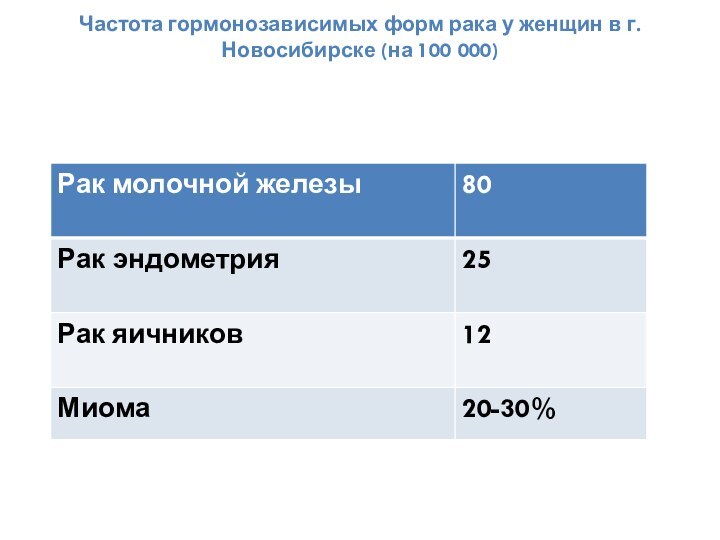
- 2. Частота гормонозависимых форм рака у женщин в г. Новосибирске (на 100 000)
- 3. Факторы рискаПоздняя менопаузаРепродуктивные факторыОжирениеБесплодиеУвеличение уровняэстрогенов
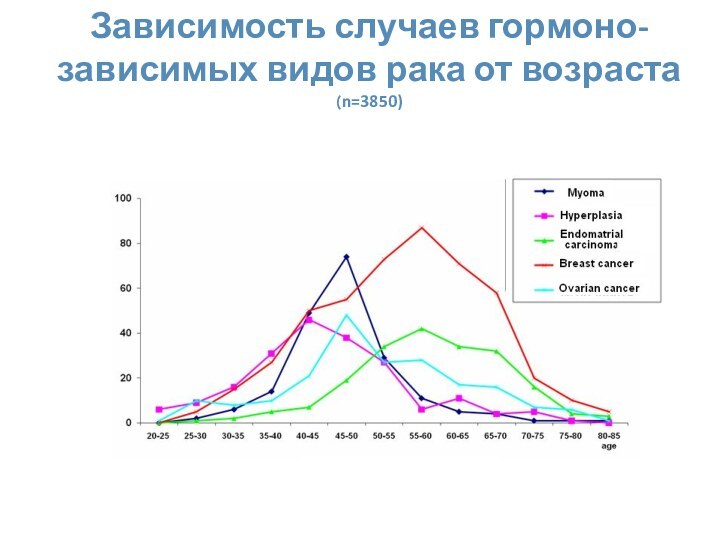
- 4. Зависимость случаев гормоно-зависимых видов рака от возраста (n=3850)
- 5. Патогенез гормонального ракаКарциномаИзменение внеклеточного матриксаИзменение клеточных сигналовИзменение рецепции эстрогеновЭстрогены, канцерогеныГеномные и негеномные эффекты
- 6. Концепция гормонального канцерогенезаУвеличение активности ароматазы УвеличениеУровня эстрогеновСнижение
- 7. ПОДХОДЫ К ИЗУЧЕНИЮ ГОРМОНОЗАВИСИМЫХ ФОРМ РАКАГенетический анализ
- 8. Сигнальная трансдукция в гормональном канцерогенезе
- 9. Передача клеточного сигнала (Сигнальная трансдукция – СТ) дифференцировка пролиферация апоптозмежклеточные взаимодействияцитоскелетмиграцияэнергетический метаболизм метаболизмлекарствКОНТРОЛЬ
- 10. Клетка постоянно получает сигналы
- 11. Характеристика RTKsУ человека идентифицировано 58 RTKs, которые
- 12. Семейство Epidermal growth factor receptor (EGFR)EGF был
- 13. Активируемые пути СТ
- 14. Нарушение метаболизма и рецепции эстрогенов
- 15. Нарушение метаболизма эстрогенов запускает гормональный канцерогенез, образование злокачественной опухоли в гормонозависимой ткани
- 16. Промоторный тип канцерогенеза Переэкспрессия ER-α в
- 17. ER-опосредованные сигналыДоменная структура эстрогеновых рецепторовЭстрогены действуют через
- 18. Структура эстрогенового рецептора
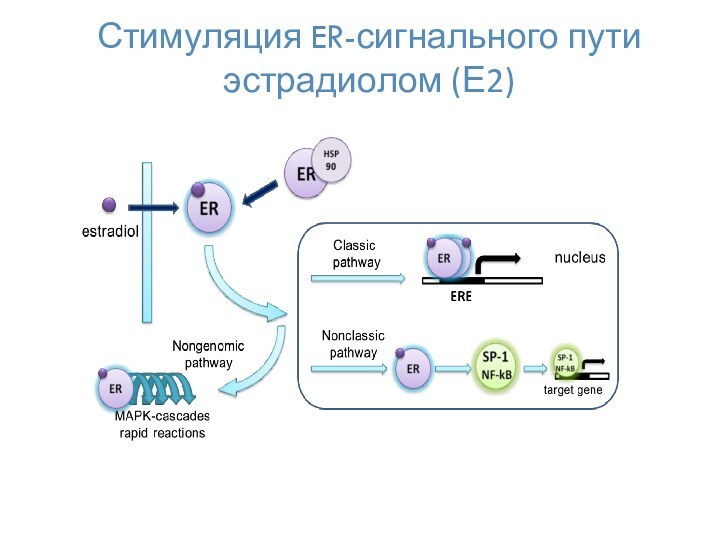
- 19. Стимуляция ER-сигнального пути эстрадиолом (Е2)
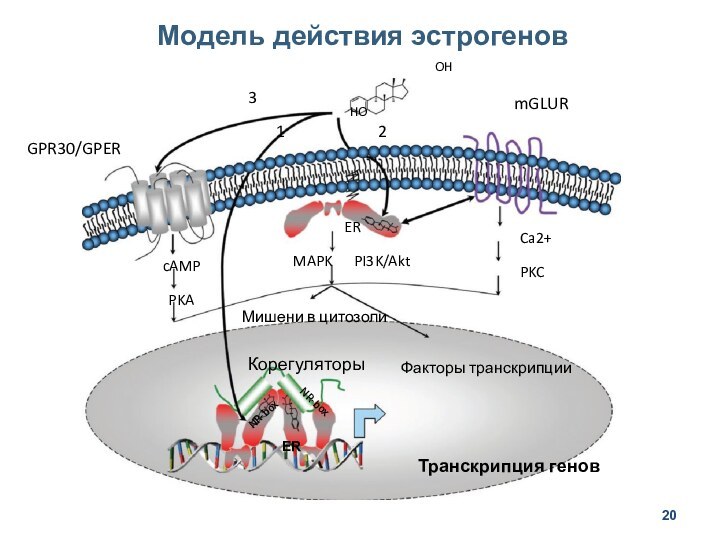
- 20. Модель действия эстрогеновERNR-boxNR-boxТранскрипция геновКорегуляторыФакторы транскрипцииМишени в цитозолиMAPK PI3K/AktERCa2+PKCcAMPPKAGPR30/GPERmGLUROHHO123
- 21. 2ERERERERPPTFPTFERERПротеин-киназный каскадeNOSPE2Протеин-киназный каскадGFGF-R1.2.3.4.
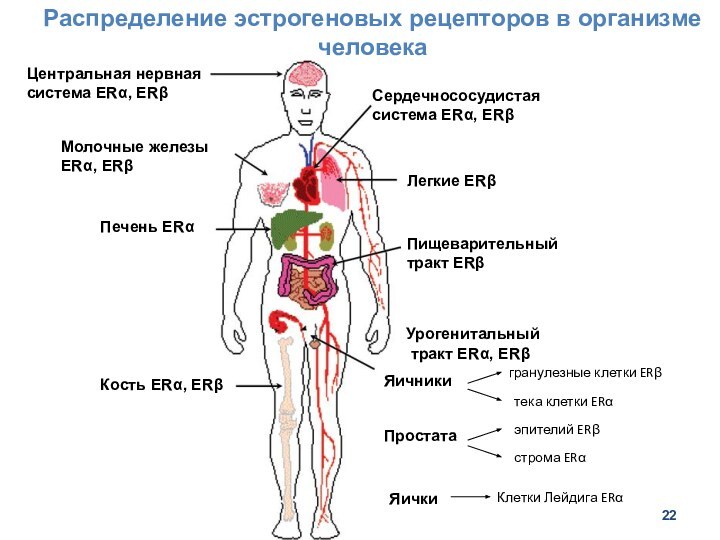
- 22. Распределение эстрогеновых рецепторов в организме человекаЦентральная нервная
- 23. Строение ДНК-связывающего домена
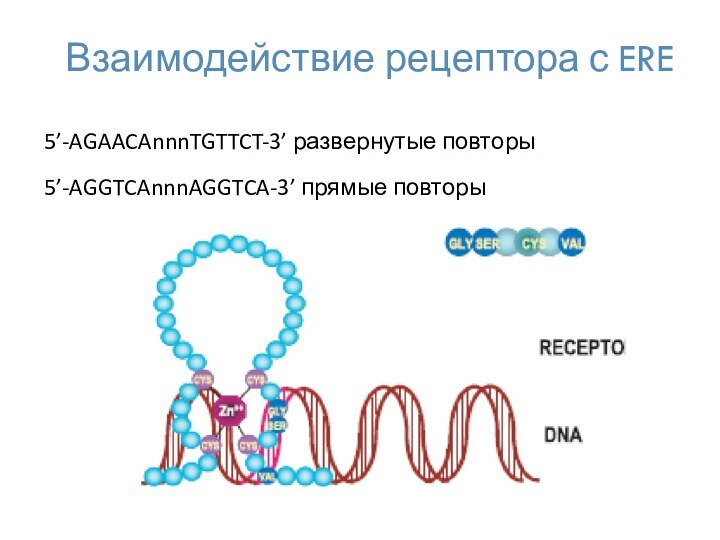
- 24. Взаимодействие рецептора с ERE
- 25. Гены мишени эстрогеновых рецепторовАктивацияСупрессия Ген холин-ацетилтрансферазы Липопротеин
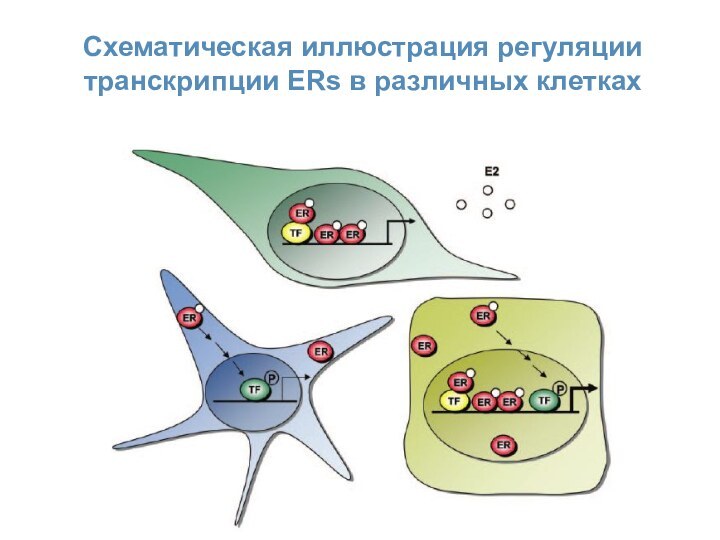
- 26. Схематическая иллюстрация регуляции транскрипции ERs в различных клетках
- 27. Научная проблема: Почему повышается количество ERальфа?Почему повышается
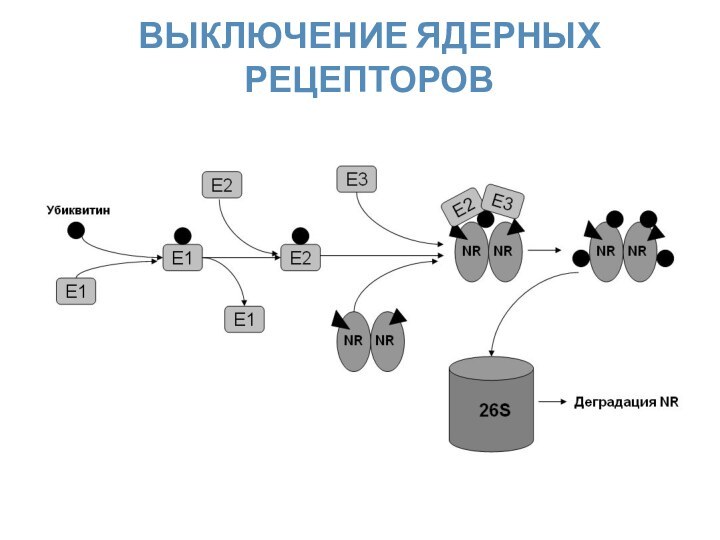
- 28. ВЫКЛЮЧЕНИЕ ЯДЕРНЫХ РЕЦЕПТОРОВ
- 29. Загадки ГК: Сплайсированные варианты эстрогеновых рецепторов
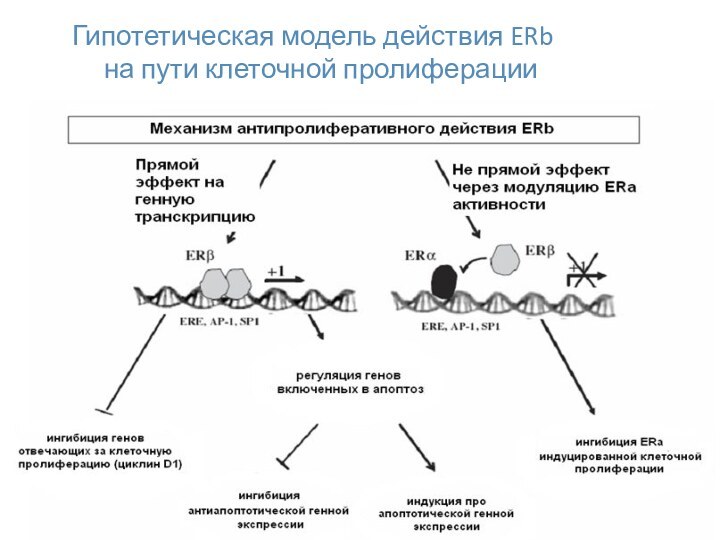
- 30. Гипотетическая модель действия ERb на пути клеточной пролиферации
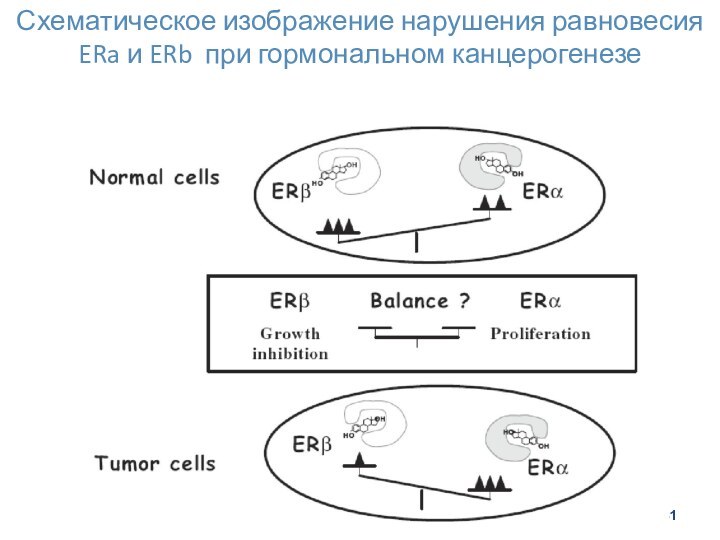
- 31. Схематическое изображение нарушения равновесия ERa и ERb при гормональном канцерогенезе
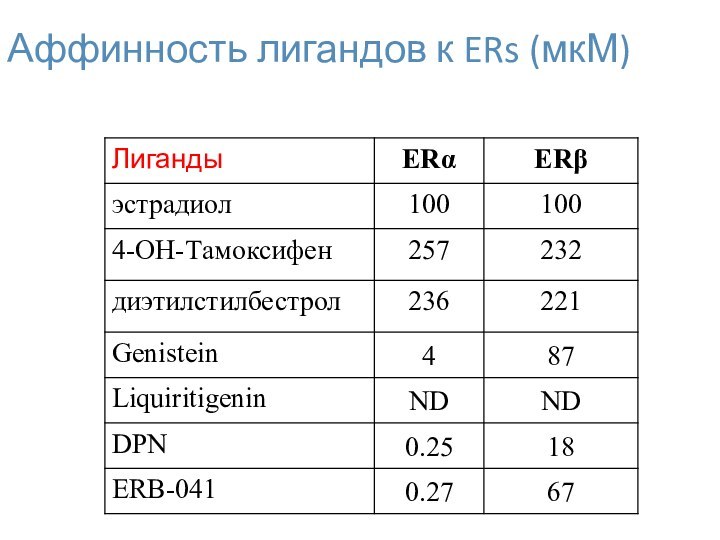
- 32. Аффинность лигандов к ERs (мкМ)
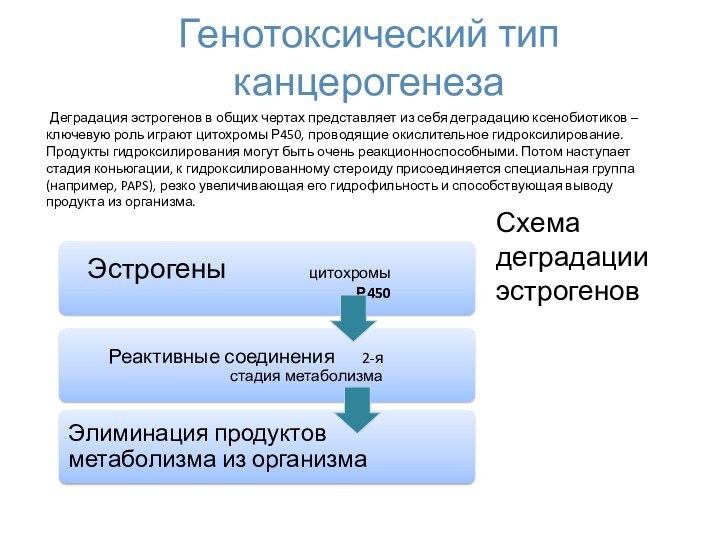
- 33. Генотоксический тип канцерогенеза Деградация эстрогенов в общих
- 34. Причины нарушения баланса Е2
- 35. Ксеноэстрогены и рецептор-опосредованный механизм
- 36. DDТ – потенциальный ксеноэстрогенp,p’–DDT и о,p’-DDT in vitro связываются сAR.о,p’-DDТ in vitro связываются с ER крыс.
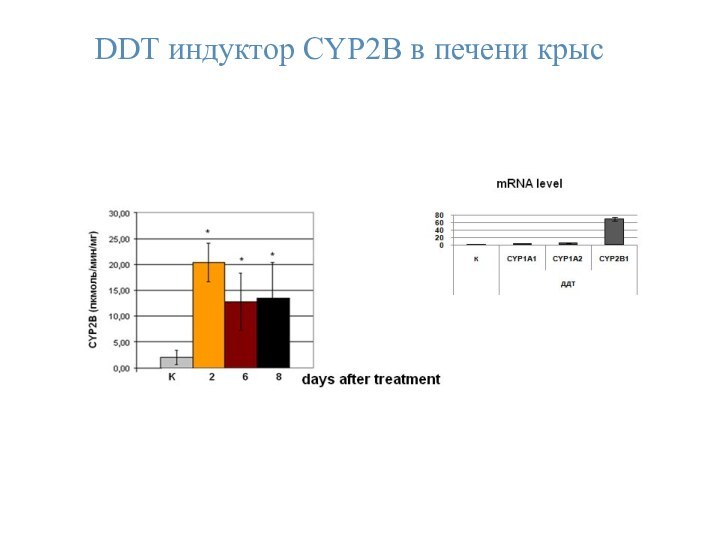
- 37. DDТ индуктор CYP2B в печени крыс
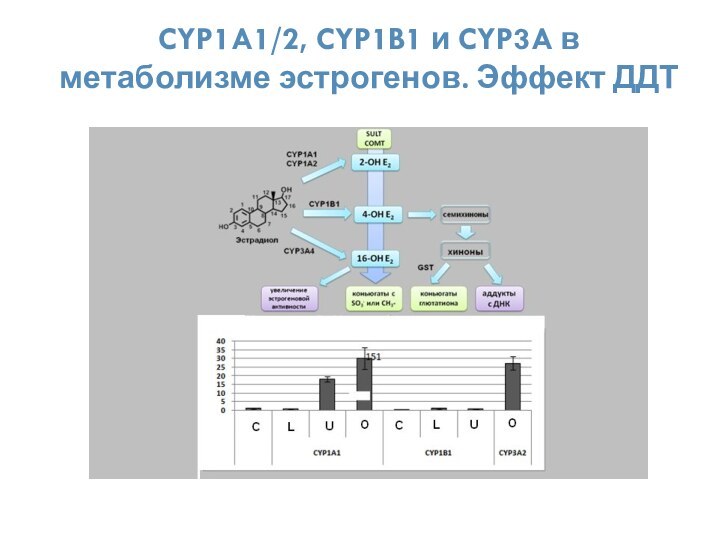
- 38. CYP1A1/2, CYP1B1 и CYP3A в метаболизме эстрогенов. Эффект ДДТ
- 39. Экспрессия CYP19 (Aromatase)A). Экспрессия CYP19 в матке
- 40. Экспрессия генов Erα и CyclinD1
- 41. Предполагаемый механизм действия DDT
- 42. МикроРНК в гормональном канцерогенезеМикроРНК- малые некодирующие РНК
- 43. Эффекты DDT, BP, and MC на экспрессию
- 44. Экспрессия miR в фиброаденоме МЖ и РМЖ
- 45. Профиль экспрессии МикроРНК в образцах РМЖ Без НАТПосле НАТ
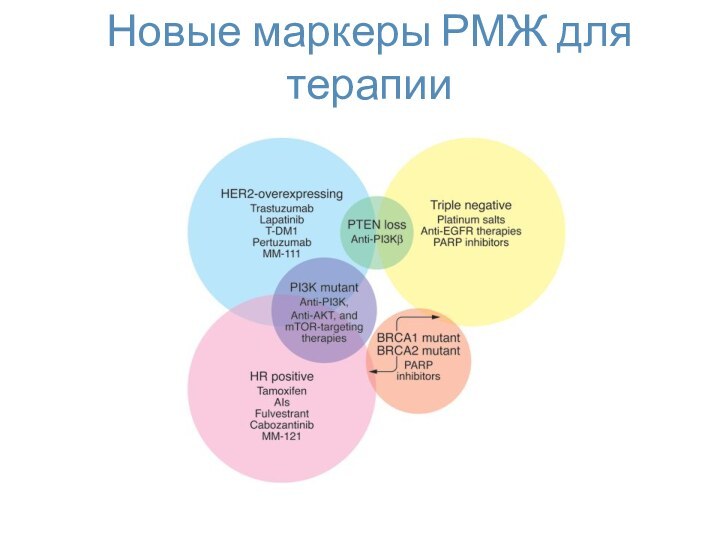
- 46. Таргетная гормональная терапия опухолей
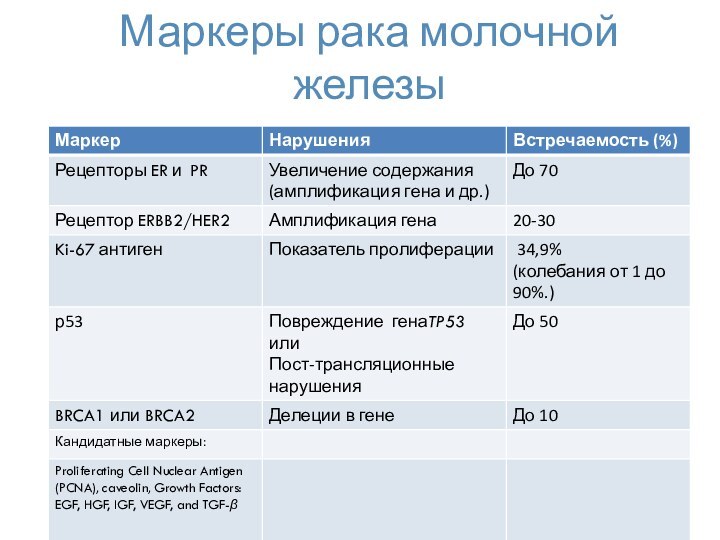
- 47. Маркеры рака молочной железы
- 48. Маркеры рака эндометрия
- 49. Стратегия в лечении РМЖ
- 50. Гормональная терапия РМЖПроблема: Поиск эффективных ингибиторов ERa (SERM)
- 52. Моделирование взаимодействия лигандов с ERs в экспериментах in vivo
- 53. Эксперименты in vivo с самками здоровых крыс
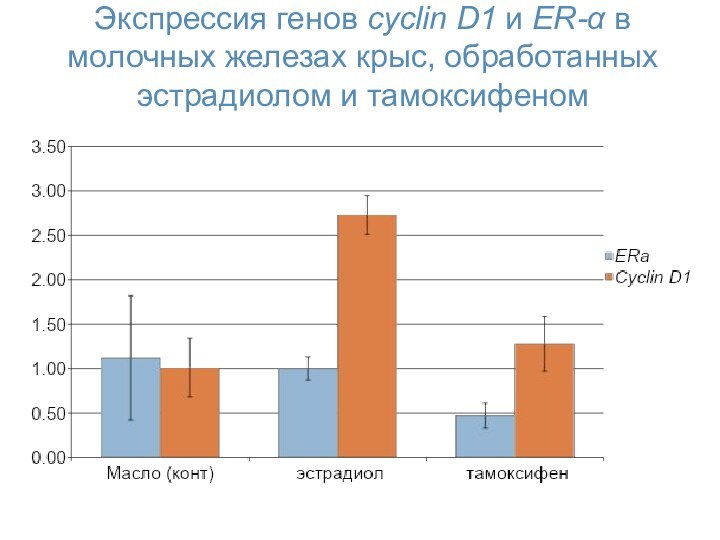
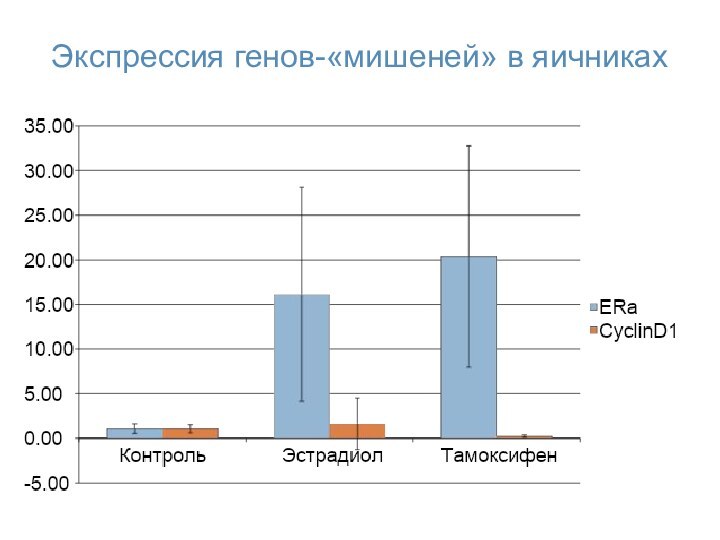
- 54. Экспрессия генов cyclin D1 и ER-α в молочных железах крыс, обработанных эстрадиолом и тамоксифеном
- 55. Экспрессия генов cyclin D1 и ER-α в эндометрии крыс, обработанных эстрогеном и тамоксифеном
- 56. Экспрессия генов-«мишеней» в яичниках
- 57. Новые маркеры РМЖ для терапии
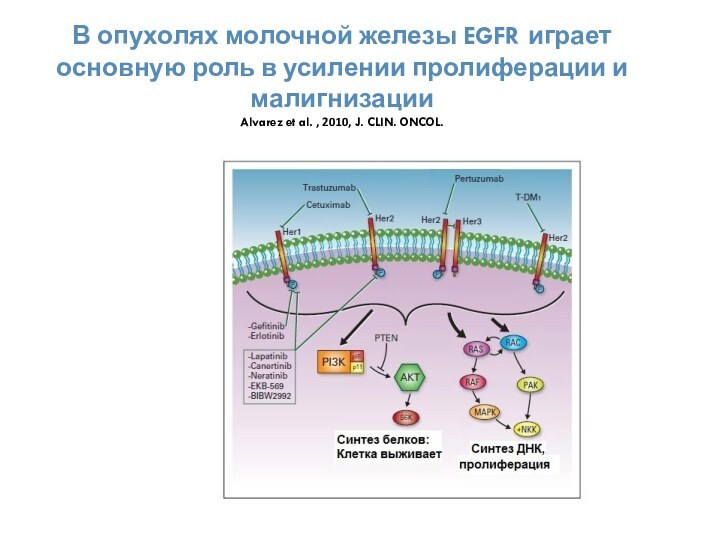
- 58. В опухолях молочной железы EGFR играет
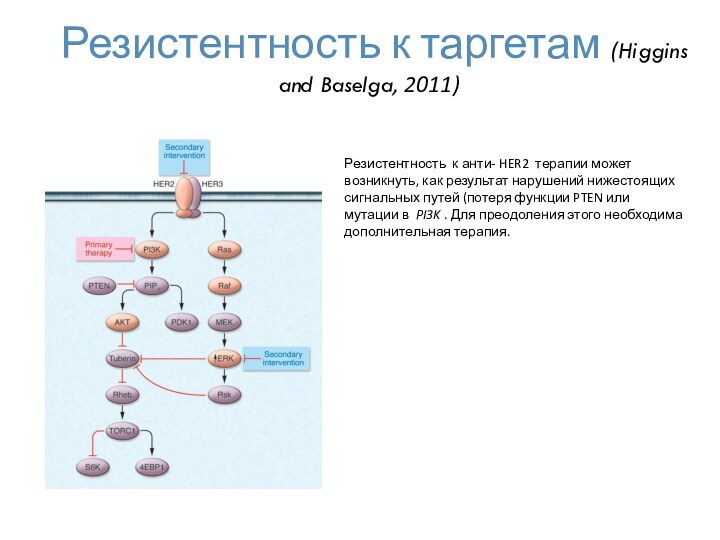
- 59. Резистентность к таргетам (Higgins and Baselga, 2011)Резистентность
- 60. Роль BRCA1/2 в патогенезе РМЖ и рака
- 61. Онкосупрессор phosphatase and tensin homolog (PTEN)- маркер
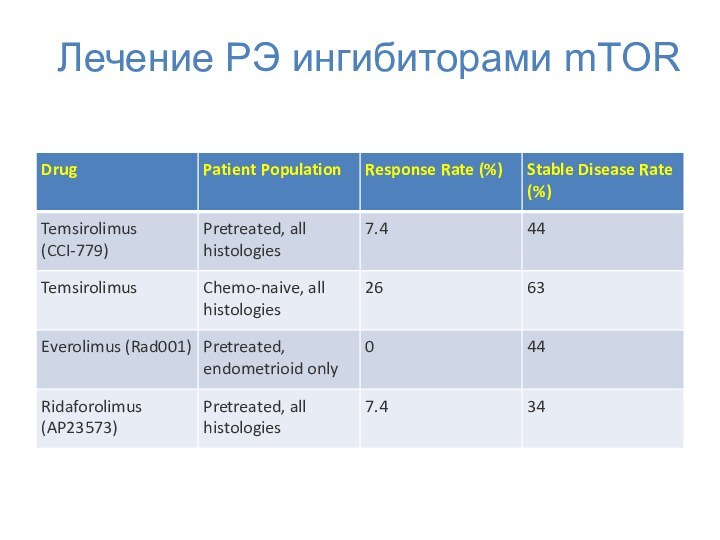
- 62. Лечение РЭ ингибиторами mTOR
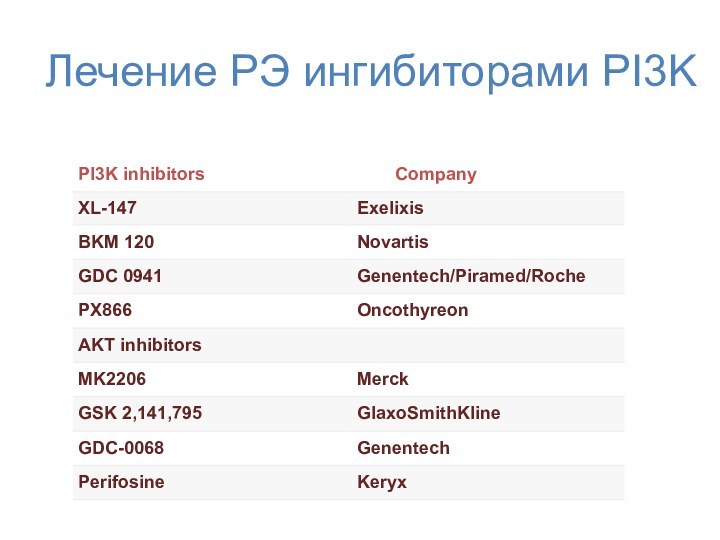
- 63. Лечение РЭ ингибиторами PI3K
- 64. Скачать презентацию
- 65. Похожие презентации
































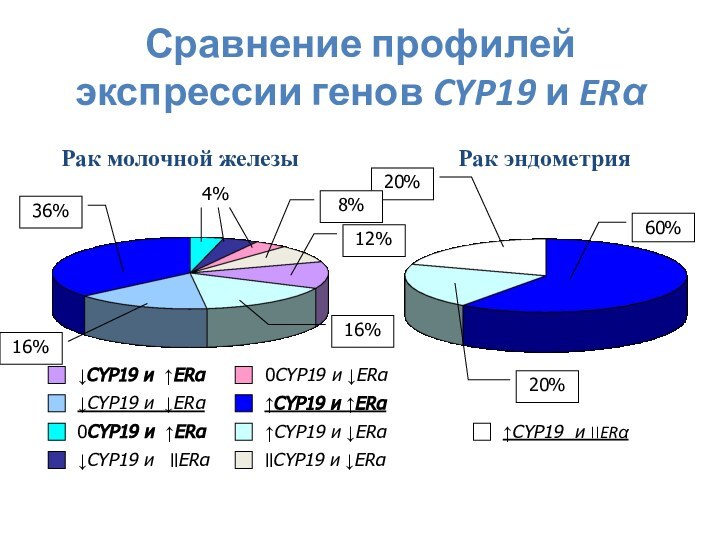
Слайд 3
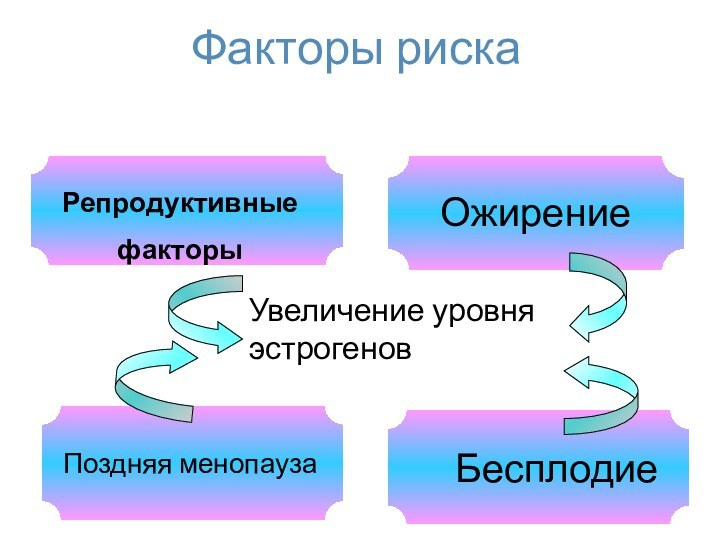
Факторы риска
Поздняя менопауза
Репродуктивные
факторы
Ожирение
Бесплодие
Увеличение уровня
эстрогенов
Слайд 5
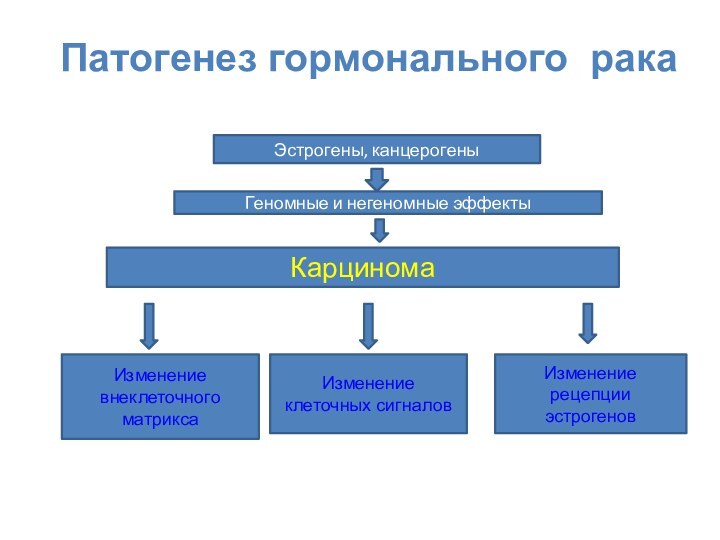
Патогенез гормонального рака
Карцинома
Изменение внеклеточного матрикса
Изменение клеточных сигналов
Изменение рецепции
эстрогенов
Эстрогены, канцерогены
Геномные и негеномные эффекты
Слайд 6
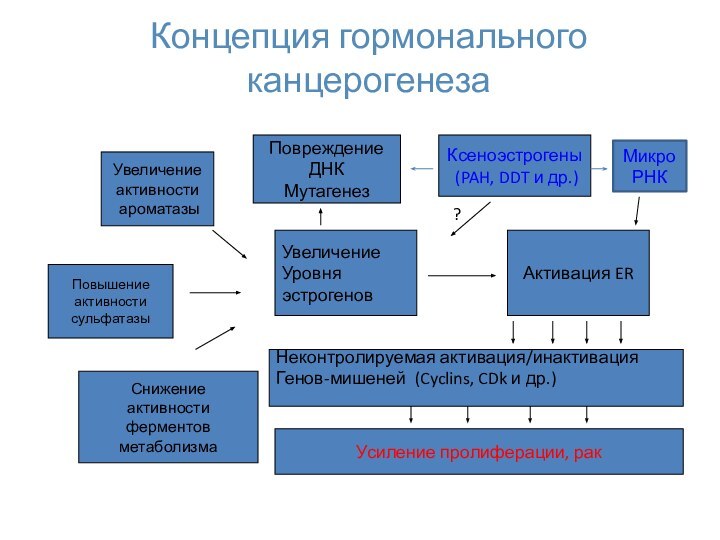
Концепция гормонального канцерогенеза
Увеличение
активности
ароматазы
Увеличение
Уровня
эстрогенов
Снижение
активности
ферментов
метаболизма
Повышение
активности
сульфатазы
Активация ER
Неконтролируемая активация/инактивация
Генов-мишеней (Cyclins, CDk и др.)
Усиление
пролиферации, ракКсеноэстрогены
(PAH, DDT и др.)
Повреждение
ДНК
Мутагенез
?
МикроРНК
Слайд 7
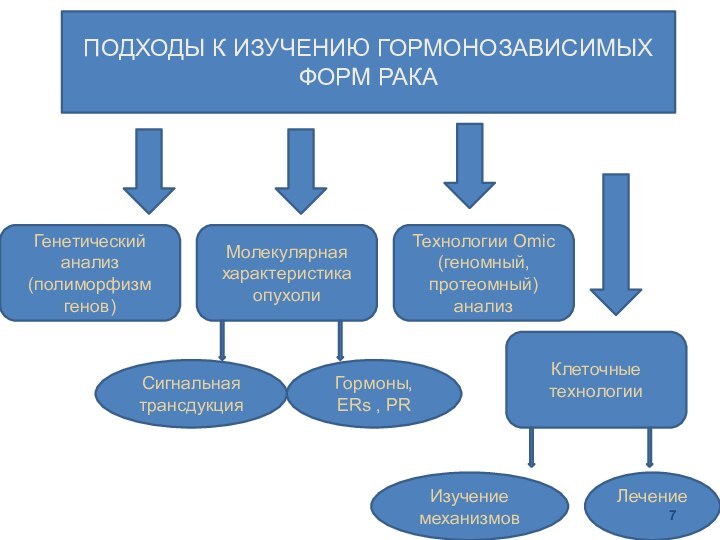
ПОДХОДЫ К ИЗУЧЕНИЮ ГОРМОНОЗАВИСИМЫХ ФОРМ РАКА
Генетический анализ (полиморфизм
генов)
Молекулярная характеристика опухоли
Технологии Omic
(геномный,
протеомный) анализ
Клеточные технологии
Сигнальная трансдукция
Гормоны, ERs
, PRЛечение
Изучение механизмов
Слайд 9
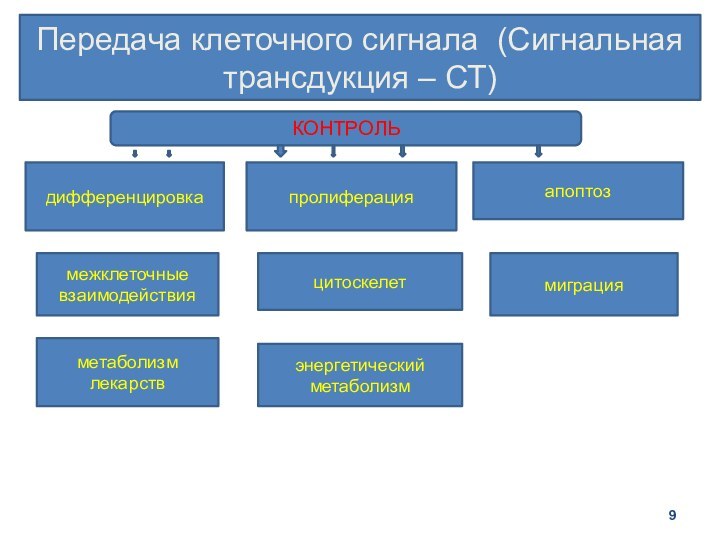
Передача клеточного сигнала (Сигнальная трансдукция – СТ)
дифференцировка
пролиферация
апоптоз
межклеточные взаимодействия
цитоскелет
миграция
энергетический метаболизм
метаболизм
лекарств
КОНТРОЛЬ
Слайд 10 Клетка постоянно получает сигналы из внеклеточного пространства, передает
их и формирует адекватный ответ. СТ-механизм основан на пост-трансляционных
модификациях белков, где ключевую роль играет фосфорилирование: MgATP + protein—OH= Protein—OPO3 + MgADP Эукариотическая клетка содержат большой набор киназ (у человека около 518) .ядро
Слайд 11
Характеристика RTKs
У человека идентифицировано 58 RTKs, которые подразделяются
на 20 подсемейств
Все рецепторы имеют сходную молекулярную архитектуру: внеклеточный
лиганд-связывающий домен, одиночную трансмембранную спираль, цитоплазматический участок, который содержит тирозин-киназный домен и дополнительный С-терминальный участок и околомембранный регуляторный участок
Слайд 12
Семейство Epidermal growth factor receptor (EGFR)
EGF был изолирован
в1962 Stanley Cohen.
Его взаимодействие с EGFR подтверждено в 1975.
В
80-х установлено сходство EGFR с v-erbB (avian erythroblastosis virus)EGFR (также известен как ERBB1⁄ HER1), ERBB2⁄HER2⁄NEU, ERBB3⁄HER3 и ERBB4⁄ HER4.
ERBB2, ERBB3 и ERBB4 показывают экстраклеточную гомологию
относительно EGFR 44, 36 и 48%, соответственно, тогда как для тирозин-киназного домена - 82, 59 and 79%, соответственно.
EGFR ген локализован на хромосоме 7p12-13 и кодирует
170kDa рецептор тирозин киназу.
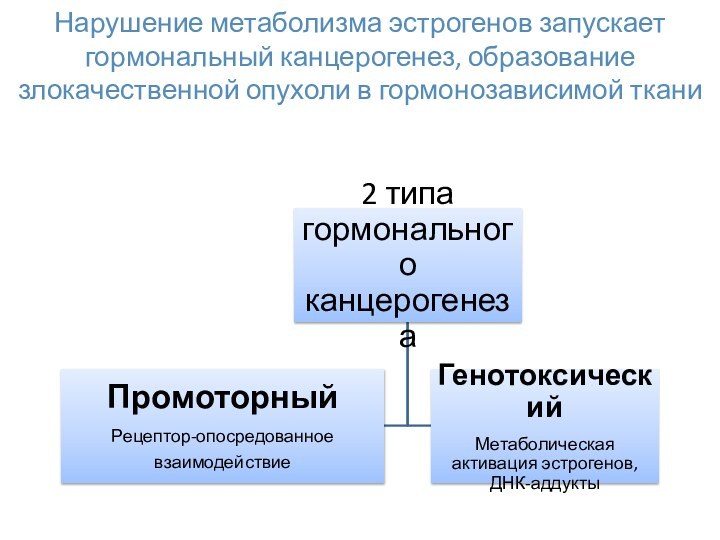
Слайд 15 Нарушение метаболизма эстрогенов запускает гормональный канцерогенез, образование злокачественной
опухоли в гормонозависимой ткани
Слайд 16
Промоторный тип канцерогенеза
Переэкспрессия ER-α в нормальной
ткани увеличивает чувствительность к эстрогенам, повышает риск возникновения гормонозависимой
опухоли. Многочисленными исследованиями показано, что пролиферация и доля ER-α-позитивных клеток выше в трансформированной ткани, чем в нормальной ткани молочной железы. Кроме того, эстрогены стимулируют синтез факторов роста в ER-α-позитивных клеток, а это, в свою очередь, приводит к пролиферации близлежащих ER-α-негативных клеток.
Слайд 17
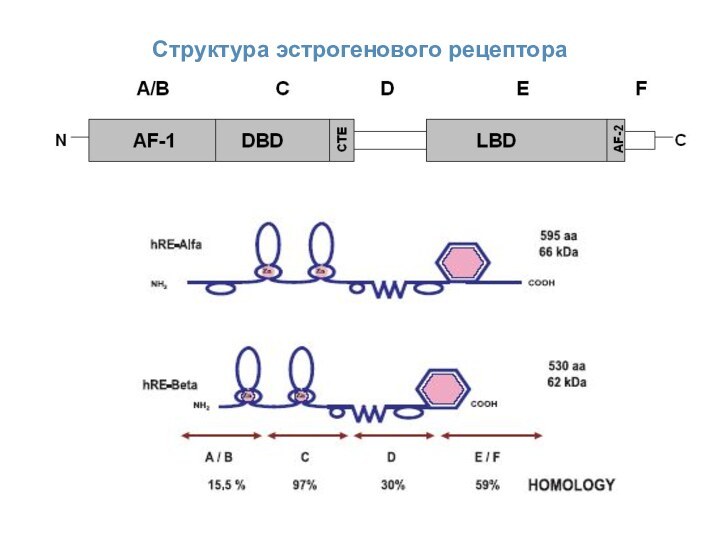
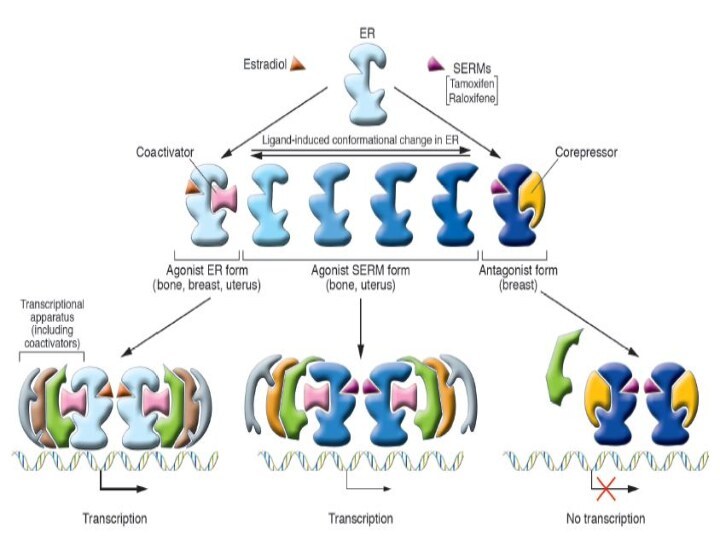
ER-опосредованные сигналы
Доменная структура эстрогеновых рецепторов
Эстрогены действуют через эстрогеновые
рецепторы (ER, estrogen receptor). На настоящий момент известно два
эстрогеновых рецептора, называемых ERα и ERβ. Оба эти рецептора принадлежат суперсемейству ядерных рецепторов.A/B – N-(амино)терминальный домен
C – ДНК-связывающий домен
D – соединяющий домен
E – лиганд-связывающий домен
F – C-терминальный домен
Слайд 20
Модель действия эстрогенов
ER
NR-box
NR-box
Транскрипция генов
Корегуляторы
Факторы транскрипции
Мишени в цитозоли
MAPK
PI3K/Akt
ER
Ca2+
PKC
cAMP
PKA
GPR30/GPER
mGLUR
OH
HO
1
2
3
Слайд 22
Распределение эстрогеновых рецепторов в организме человека
Центральная нервная система
ERα, ERβ
Печень ERα
Кость ERα, ERβ
Молочные железы ERα, ERβ
Легкие ERβ
Сердечнососудистая
система ERα, ERβПищеварительный тракт ERβ
Урогенитальный тракт ERα, ERβ
Яичники
тека клетки ERα
гранулезные клетки ERβ
Простата
Яички
эпителий ERβ
строма ERα
Клетки Лейдига ERα
Слайд 25
Гены мишени эстрогеновых рецепторов
Активация
Супрессия
Ген холин-ацетилтрансферазы
Липопротеин липазный
ген
Ген фолликулостимулирующего гормона
Ген
хинолон редуктазы (окисляя хинолоны, снижает генерацию свободных радикалов и, тем самым, принимает участие в защитных антиоксидантных реакциях) Коллагеназа
Человеческий инсулиновый фактор роста 1
Ген кальцитонина
Слайд 27
Научная проблема:
Почему повышается количество ERальфа?
Почему повышается его
транскрипционная активность?
Возможные причины:
1. Увеличение количества лиганда (эстрадиола и ксеноэстрогенов)
2.
Амплификация гена (показано для РМЖ)3. Нарушение регуляции, роль коактиваторов, роль miRs
Слайд 33
Генотоксический тип канцерогенеза
Деградация эстрогенов в общих чертах
представляет из себя деградацию ксенобиотиков – ключевую роль играют
цитохромы Р450, проводящие окислительное гидроксилирование. Продукты гидроксилирования могут быть очень реакционноспособными. Потом наступает стадия коньюгации, к гидроксилированному стероиду присоединяется специальная группа (например, PAPS), резко увеличивающая его гидрофильность и способствующая выводу продукта из организма.Схема деградации эстрогенов
Слайд 36
DDТ – потенциальный ксеноэстроген
p,p’–DDT и о,p’-DDT in vitro
связываются сAR.
о,p’-DDТ in vitro связываются с ER крыс.
Слайд 39
Экспрессия CYP19 (Aromatase)
A). Экспрессия CYP19 в матке и
яичниках крыс, обработанных ДДТ B) Экспрессия CYP19 в образцах
РМЖ (черный цвет) в сравнении с контролем (серый цвет).A). B).
Слайд 42
МикроРНК в гормональном канцерогенезе
МикроРНК- малые некодирующие РНК длиной
19-23 нуклеотида.
Регулируют экспрессию более, чем 1/3 генов человека.
Для каждого
типа опухоли своя специфичная картина экспрессии микроРНК.Слайд 43 Эффекты DDT, BP, and MC на экспрессию miR-21/221/222/429
в печени(A) и яичников (B) самок крыс Вистар
Chanyshev MD,
Kosorotikov NI, Titov SE, Kolesnikov NN, Gulyaeva LF.Life Sci. 2014 May 17;103(2):95-100. doi: 10.1016/j.lfs.2014.03.031. Epub 2014 Apr 12.
Expression of microRNAs, CYP1A1 and CYP2B1 in the livers and ovaries of female rats treated with DDT and PAHs.
Слайд 53
Эксперименты in vivo с самками здоровых крыс
Инъекции
в течение 10 суток:
3 крысы – подсолнечное масло
3 крысы
– эстрадиол 3 крысы - тамоксифен
Извлечение тканей
Реверти-рование
Обсчет результатов анализа
ОТ-ПЦР анализ:
324 образца
36 кДНК
36 мРНК
36 образцов тканей
(печень, яичники, матка, молочные железы)
Гомогенизация тканей
Выделение
мРНК
Слайд 54 Экспрессия генов cyclin D1 и ER-α в молочных
железах крыс, обработанных эстрадиолом и тамоксифеном
Слайд 55 Экспрессия генов cyclin D1 и ER-α в эндометрии
крыс, обработанных эстрогеном и тамоксифеном
Слайд 58 В опухолях молочной железы EGFR играет основную роль
в усилении пролиферации и малигнизации Alvarez et al. , 2010,
J. CLIN. ONCOL.
Слайд 59
Резистентность к таргетам (Higgins and Baselga, 2011)
Резистентность к
анти- HER2 терапии может возникнуть, как результат нарушений нижестоящих
сигнальных путей (потеря функции PTEN или мутации в PI3K . Для преодоления этого необходима дополнительная терапия.
Слайд 60
Роль BRCA1/2 в патогенезе РМЖ и рака яичников
Наследственные
формы рака молочной железы (около 5%) и рака яичников
(около 10%).У носителей мутаций вероятность развития рака – до 70%