- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Признаки рака
Содержание
- 2. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 3. Поддержание пролиферативного сигналинга
- 4. Фактор роста Активация РТК Синтез белков S-фазаМитозКаскад фосфорилированияФакторы транскрипцииПерепрограммирование геномаСинтез мРНК
- 5. Как поддержать пролиферативный сигнал?Производство собственных факторов роста,
- 6. Гиперэкспрессия рецепторовEGFR – 60% НМРЛ, 50% -
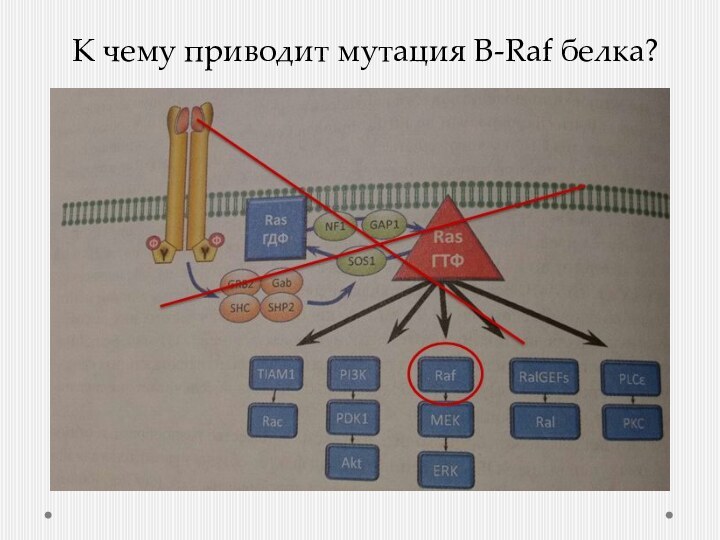
- 7. К чему приводит мутация B-Raf белка?
- 8. Активация PI3K (фосфоинозитол-3-киназы)
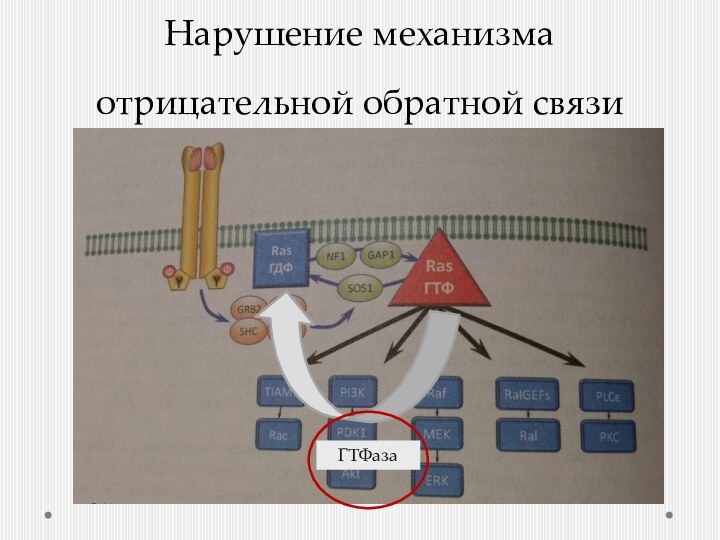
- 9. Нарушение механизма отрицательной обратной связиГТФаза
- 10. Существуют ли меры борьбы клетки с чрезмерным пролиферативным сигналингом?
- 11. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 12. Онкосупрессоры RB-белок(белок ретинобластомы) «решает, пройти ли клетке
- 13. Контактное торможениеНормальная популяция клеток in-vitro при действии
- 14. Механизмы контактного торможенияCвязывание молекул адгезии (Е-кадгерина) с
- 15. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 16. АпоптозВнешние сигналыВнутренние сигналы Активация «молчащих» протеаз (каспаз
- 17. Пути избегания апоптозаВнешние сигналыВнутренние сигналы Активация «молчащих»
- 18. Роль некроза клеток в стимуляции онкогенезаКлетки, вступившие
- 19. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 20. «Клеточное бессмертие» эффект Хейфлика (теломерная теория)
- 21. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 22. Проангиогенный эффектVEGF (vascular endothelial growth factor) FGF
- 23. Роль клеток иммунной системы в ангиогенезе Макрофаги,
- 24. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 25. Механизмы инвазииНарушение межклеточного взаимодействия путем мутации в
- 26. Эпителиально-мезенхимальный переходПодавление экспрессии гена Е-кадгерина (E-cadherin (CDH1))
- 27. - Транскрипционные факторы, участвующие в ЭМП способны
- 28. Этапы метастазирования Местная инвазияИнтравазация опухолевых клеток Передвижение
- 29. Мигрирующие клетки могут циркулировать в русле годами
- 30. Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма
- 31. Репрограммирование энергетического потенциала Активация онкогенов и мутация опухолевых супрессоровАэробный гликолизУвеличение активности переносчика глюкозы (GLUT-1)
- 32. В чем смысл 18-кратного снижения эффективности образования
- 34. Скачать презентацию
- 35. Похожие презентации
Нестабильность геномаПоддержание пролиферативного сигналингаСопротивление клеточной гибелиНеограниченное делениеИндуцирование ангиогенезаАктивация инвазии и метастазированияИзбегаение супрессии клеточного ростаПерепрограммирование клеточного метаболизма





























Слайд 2
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Слайд 4
Фактор роста
Активация РТК
Синтез белков
S-фаза
Митоз
Каскад фосфорилирования
Факторы
транскрипции
Перепрограммирование генома
Синтез мРНК
Слайд 5
Как поддержать пролиферативный сигнал?
Производство собственных факторов роста, на
которые сами же клетки-производители и будут реагировать – аутокринная
пролиферативная стимуляцияПосылать сигналы «нормальным» клеткам из опухолевого окружения, чтобы они производили факторы роста
Повышение экспрессии рецепторов к факторам роста
Соматическая мутация => Нерегулируемая активация компонентов сигнальных путей => нет необходимости активировать рецепторы
Устранить отрицательно-обратную связь
Слайд 6
Гиперэкспрессия рецепторов
EGFR – 60% НМРЛ, 50% - глиома
Erb2 – 20-30% РМЖ
Амплификация гена
Повышение интенсивности транскрипции
Подавление
деградации белка
Слайд 11
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Избегаение супрессии клеточного роста
Перепрограммирование клеточного метаболизма
Слайд 12
Онкосупрессоры
RB-белок
(белок ретинобластомы) «решает, пройти ли клетке через
следующий цикл деления»
мутацияНеконтролируемая клеточная пролиферация
Преимущественно сигналы вне клетки
Белок р53
При повышении степени повреждения генома запускает остановку клеточного цикла, апоптоз.
Внутриклеточные сигналы
Слайд 13
Контактное торможение
Нормальная популяция клеток in-vitro при действии агрессивного
фактора образуют слившийся монослой и приостанавливают пролиферацию.
Такое «контактное» торможение
в популяции раковых клеток не обнаружено.
Слайд 14
Механизмы контактного торможения
Cвязывание молекул адгезии (Е-кадгерина) с РТК
(EGFR)
* «занимает» РТК => ограничение ответа на сигналы роста
NF2
Молекулы
адгезии:А) Кадгерины
Б) Интегрины
В) Селектины
Г) Гоминговые молекулы
Д) Семейство иммуноглобулинов
Слайд 15
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Избегаение супрессии клеточного роста
Перепрограммирование клеточного метаболизма
Слайд 16
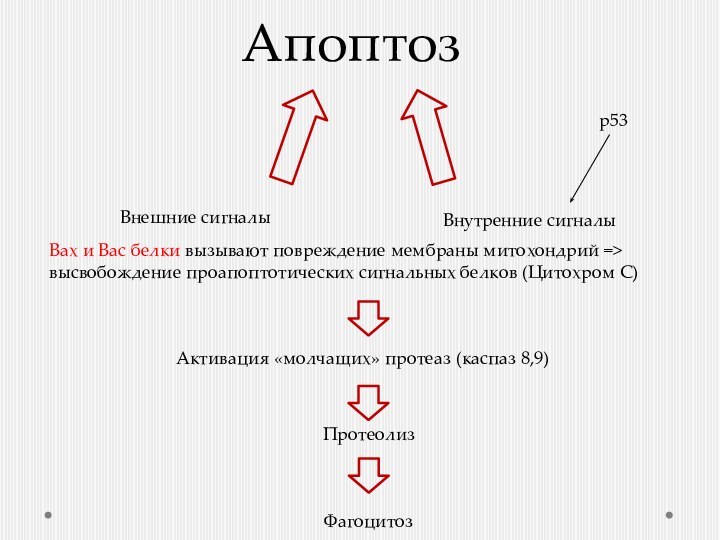
Апоптоз
Внешние сигналы
Внутренние сигналы
Активация «молчащих» протеаз (каспаз 8,9)
Протеолиз
Фагоцитоз
Вах и Вас белки вызывают повреждение мембраны митохондрий
=> высвобождение проапоптотических сигнальных белков (Цитохром С) р53
Слайд 17
Пути избегания апоптоза
Внешние сигналы
Внутренние сигналы
Активация «молчащих» протеаз
(каспаз 8,9)
Протеолиз
Фагоцитоз
Вах и Вас белки вызывают повреждение
мембраны митохондрий => высвобождение проапоптотических сигнальных белков (Цитохром С) р53
Апоптоз
Антиапоптотические факторы
ВСL-2, BCL-X
Слайд 18
Роль некроза клеток в стимуляции онкогенеза
Клетки, вступившие в
некроз привлекают в очаг элементы иммунной системы => стимуляция
опухолевого роста путем неоангиогенеза, пролиферации.Некротические клетки высвобождают биоактивные регуляторы, в т.ч. ИЛ-а, способный стимулировать соседние клетки и, следовательно, ускорять неопластическую прогрессию.
Слайд 19
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Избегаение супрессии клеточного роста
Перепрограммирование клеточного метаболизма
Слайд 20
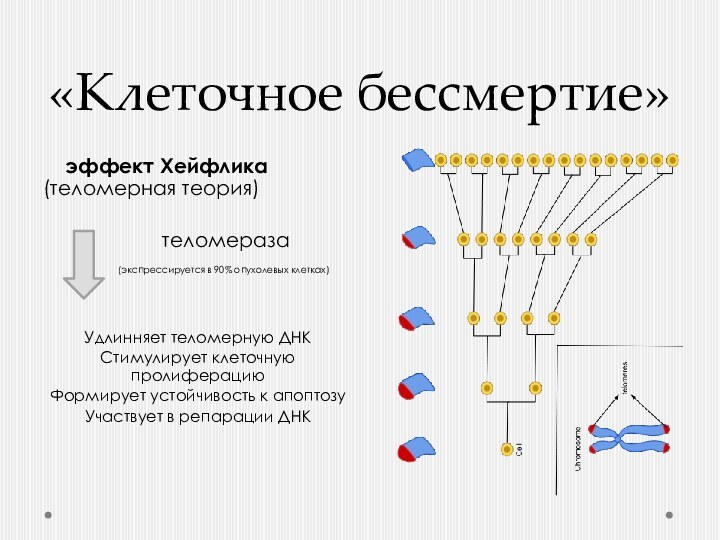
«Клеточное бессмертие»
эффект Хейфлика (теломерная теория)
теломераза
(экспрессируется
в 90% опухолевых клетках)Удлинняет теломерную ДНК
Стимулирует клеточную пролиферацию
Формирует устойчивость к апоптозу
Участвует в репарации ДНК
Слайд 21
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Избегаение супрессии клеточного роста
Перепрограммирование клеточного метаболизма
Слайд 22
Проангиогенный эффект
VEGF (vascular endothelial growth factor)
FGF (фактор
роста фибробластов)
Антиангиогенный эффект
TSP-1 (тромбоспондин)
Коллаген 18 (эндостатин)
ангиостатин
Кровеносная
сеть опухоли: преждевременное прорастание капилляров, запутанное и чрезмерное ветвление
беспорядочный ток крови,
мелкоточечные геморрагии,
негерметичность, аномальный
уровень апоптоза эндотелицитов.
Слайд 23
Роль клеток иммунной системы в ангиогенезе
Макрофаги, нейтрофилы,
тучные клетки и миелоидные предшественники, инфильтрирующие предраковые очаги, активируют
ангиогенез, поддерживают его.Кроме того отчасти защищают от воздействия антиангиогенных препаратов.
Слайд 24
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Избегаение супрессии клеточного роста
Перепрограммирование клеточного метаболизма
Слайд 25
Механизмы инвазии
Нарушение межклеточного взаимодействия путем мутации в молекулах
адгезии (в основном в Е-кадгерине)
Виды инвазии:
Мезенхимальная (ЭМП)
Коллективная (редко
метастазирует) Амебоидная
Слайд 26
Эпителиально-мезенхимальный переход
Подавление экспрессии гена Е-кадгерина (E-cadherin (CDH1))
Увеличение
экспрессии генов ответственных за мезенхимальный фенотип эпителиоцитов, таких как
виментин (Vimentin), гладко-мышечный актин, фибронектин (Fibronectin).Усиление клеточной подвижности вследствие активации сигнальных путей приводящих к реорганизации цитоскелета.
Повышение экспрессии генов, кодирующих матриксные металлопротеиназы (MMP), которые участвуют в деградации внеклеточного матрикса и базальной мембраны.
* опухолевые клетки НЕ заканчивают ЭМП, они находятся между, сохраняя свойства эпителиальной ткани и приобретая свойства мезенхимальной.
Слайд 27 - Транскрипционные факторы, участвующие в ЭМП способны контролировать
все этапы, исключая заключительный.
- Опухолевые клетки выделяют ИЛ-4, который
стимулирует макрофаги -> Макрофаги на периферии опухоли выделяют деградирующие элементы в т.ч. металлопротеиназы, протеазы, обеспечивающие местную инвазию. Опухолевые клетки способны совершать реверсию, т.е. МЭП (это лежит в основе колонизации)
Слайд 28
Этапы метастазирования
Местная инвазия
Интравазация опухолевых клеток
Передвижение по
сосудистому руслу, лимфатической системе
Экстравазация
Микрометастазирование
Колонизация (прежних очагов в т.ч.)
Слайд 29 Мигрирующие клетки могут циркулировать в русле годами и,
попав на место первичной опухоли, сформировать фенотипически совершенно другую
колонию.
Слайд 30
Нестабильность генома
Поддержание пролиферативного сигналинга
Сопротивление клеточной гибели
Неограниченное деление
Индуцирование ангиогенеза
Активация
инвазии и метастазирования
Избегаение супрессии клеточного роста
Перепрограммирование клеточного метаболизма
Слайд 31
Репрограммирование энергетического потенциала
Активация онкогенов и мутация опухолевых
супрессоров
Аэробный гликолиз
Увеличение активности переносчика глюкозы (GLUT-1)
Слайд 32
В чем смысл 18-кратного снижения эффективности образования АТФ?
Использование
промежуточных метаболитов гликолиза в различные биосинтетические пути, включая образование
аминокислот, нуклеозидов, необходимых для синтеза макромолекул и органелл.Существует 2 субпопуляции опухолевых клеток:
Первая состоит из глюкозо-зависимых клеток, секретирующих лактат.
Вторая субпопуляция утилизирует лактат, образованный «соседями».