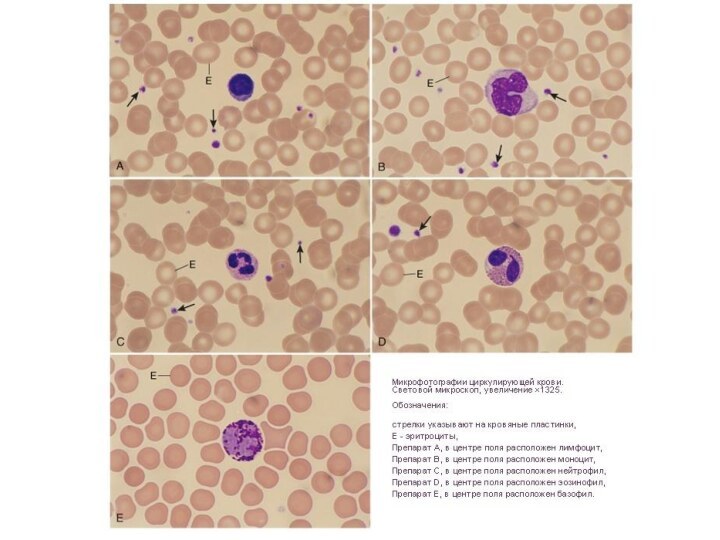
Слайд 2
Иммунодиагностика - это совокупность иммунологических методов, позволяющих выявить
то или иное заболевание или определить возбудителя в исследуемом
материале. Все методы иммунодиагностики делятся на 2 группы:
Общие неспецифические методы, характеризующие состояние различных звеньев системы иммунитета: лимфоцитов, гранулоцитов, макрофагов, комплемента. Обычно применяют для выявления дефекта в СИ, т. е. при иммунодефицитах.
Специфические методы, позволяющие выявить антитела, иммунные Т-лимфоциты, антигены в организме человека или антигены возбудителя во внешней среде. Эти методы используют для диагностики инфекций, аллергии, аутоиммунных заболеваний.
Все методы используют для оценки иммунного статуса человека, т. е. для характеристики состояния иммунной системы.
Слайд 3
Определяют общее количество лимфоцитов при подсчете формулы крови.

В норме их 20-26% среди других лейкоцитов (около 2000
клеток в 1 мм3 крови).
Подсчитывают процент и количество Т-лимфоцитов. Среди лимфоцитов крови в норме их 50-70% (1000-1400 клеток в 1 мм3 крови). Для этого подсчитывают количество лимфоцитов, образующих розетки с эритроцитами барана. К взвеси лейкоцитов добавляют равный объем 1% взвеси отмытых эритроцитов барана и инкубируют при 37°С 15 мин и ночь при 40°С;
осадок ресуспензируют, добавляют раствор глютарового альдегида до конечной концентрации 0,06% для фиксации розеток и сразу делают мазки,
мазки высушивают, фиксируют спиртом и окрашивают ядро красящими красителями (например, по Романовскому-Гимзе);
подсчитывают процент лимфоцитов, связавших более трех эритроцитов - Т-лимфоцитов.
В настоящее время Т-лимфоциты определяют с помощью моноклональных антител к CD-антигенам (CD2, CD3) в реакции иммунной флюоресценции с учетом результатов на проточном цитофотометре (норма 70-85%).
3. Определяют содержание Т-хелперов и Т-супрессоров с помощью моноклональных антител к CD4 (Тх) и CD8 (Тс) антигенам.
В норме Тх-35-48%, Тс-18-25%, соотношение Тх/Тс=1,4-2,0 - это иммунорегуляторный индекс. При заболеваниях этот индекс изменяется. Например, при СПИДе он уменьшается (0,04), т. к. угнетаются Тх (рецептором для вируса СПИДа является антиген Тх CD4). При аутоиммунных и аллергических заболеваниях индекс больше 2,0.
Неспецифические показатели иммунного статуса
Слайд 4
Тест розеткообразования — классический метод определения количества Т-лимфоцитов
в периферической крови — основан на наличии на мембране
Т-лимфоцитов всех субпопуляций рецепторов к эритроцитам барана и способности Т-лимфоцитов образовывать с ними прочные комплексы (так называемые розетки).
Рис. Тест розеткообразования для определения числа Т-лимфоцитов.
4. Для выявления активированных Т-клеток определяют рецептор к ИЛ-2 (CD25), HLA-DR антигены и CD71 (рецептор для трансферрина).
5. Определяют уровень интерлейкинов в крови.
Исследуют также функциональные показатели Т-лимфоцитов: пролиферативную активность, цитотоксическую активность. Показатели Т-лимфоцитов снижаются при Т-клеточных иммунодефицитах.
Слайд 5
Характеристика В-лимфоцитов
1. Общее количество В-лимфоцитов можно определить с

помощью моноклональных антител к антигенам CD19-CD22, CD72. Применяют также
антитела к иммуноглобулинам, которые находятся на поверхности В-лимфоцитов. В-лимфоциты составляют 20-25% всех лимфоцитов (600-800 клеток в 1 мм3 крови).
2. Функциональные продукты В-лимфоцитов - иммуноглобулины G, М, А классов в сыворотке крови и различных биологических жидкостях определяют с помощью реакции преципитации по Манчини. Для этого на одну стеклянную пластинку наливают 2% агар, смешанный с антителами против IgG; на вторую пластинку - с антителами против IgM, на 3-ю - против IgA. После застывания в агаре делают лунки диаметром 2 мм. В один ряд лунок каждой пластины вносят стандартную сыворотку с известной концентрацией IgG, IgM, IgA. В другие лунки добавляют исследуемые сыворотки крови больных. Иммуноглобулины диффундируют в агар и на месте встречи с антителами, которые находятся в агаре, образуется кольцо преципитации. Диаметр кольца зависит от концентрации Ig (чем больше Ig, тем больше диаметр). Измеряют диаметр зоны преципитации для стандартной сыворотки и по ней строят график зависимости диаметра кольца преципитации от количества Ig в сыворотке крови. Затем измеряют диаметр кольца преципитации исследуемой сыворотки, наносят на построенный график и определяют концентрацию иммуноглобулина. При иммунодефицитах уровень иммуноглобулинов снижается, а при стимуляции СИ и воспалении - повышается.
Слайд 6
Характеристика системы макрофагов и гранулоцитов
1. Определяют количество лейкоцитов

в крови и соотношение их видов (нейтрофилы, базофилы, эозинофилы,
моноциты).
2. Оценивают поглотительную и переваривающую активность фагоцитов: к взвеси лейкоцитов или капле крови добавлять взвесь отмытой суточной культуры стафилококков или кишечной палочки. Готовят 3 пробы, инкубируют при 37°С 1-ю пробу 45 мин, 2-ю - 60 мин, 3-ю - 90 мин. Делают мазки, высушивают их, фиксируют этанолом и окрашивают по Романовскому.
Определяют фагоцитарный индекс и фагоцитарное число. Фагоцитарный индекс - это среднее количество частиц или микроорганизмов в одном фагоците (норма 3-8).
Фагоцитарное число - это количество фагоцитов, участвующих в фагоцитозе (норма - 60-80%). Оценка показателей через разные промежутки времени позволяет оценить динамику фагоцитоза. В норме через 90 мин фагоцитарный индекс должен быть ниже, чем через 45 мин и 60 мин, в связи с перевариванием микробов. При нарушении переваривания он не меняется. Переваривание микробов можно оценивать путем посева лизатов лейкоцитов на питательные среды и подсчета выросших колоний. Метод предполагает использование в качестве объекта фагоцитоза живых микроорганизмов. После инкубирования с микробами фагоциты осаждают центрифугированием, отмывают и лизируют. Их лизаты высевают на твердую питательную среду . Переваривающую активность фагоцитов оценивают по числу выросших колоний. Метаболическую активность фагоцитов определяют после окраски их 0.25% раствором нитросинего тетразолия. В норме метохроматично окрашивается 15-18% нейтрофилов, при инфекциях их число увеличивается до 40% и более. Показатели фагоцитов снижаются при соответствующих иммунодефицитах, повышаются - при благоприятном течении инфекции.
Слайд 7
3. С помощью моноклональных антител определяют антигены дифференцировки,
активации и адгезии (CD14, CD11, CD18, HLA-DR и др.)
4.
Выявляют рецепторы к С3 компоненту комплемента, к иммуноглобулинам и др.
5. Оценивают спонтанную и направленную миграцию (хемотаксис).
6. Определяют способность секретировать цитокины (ИЛ-1, ФНО и др.) и их уровень в крови.
Слайд 9
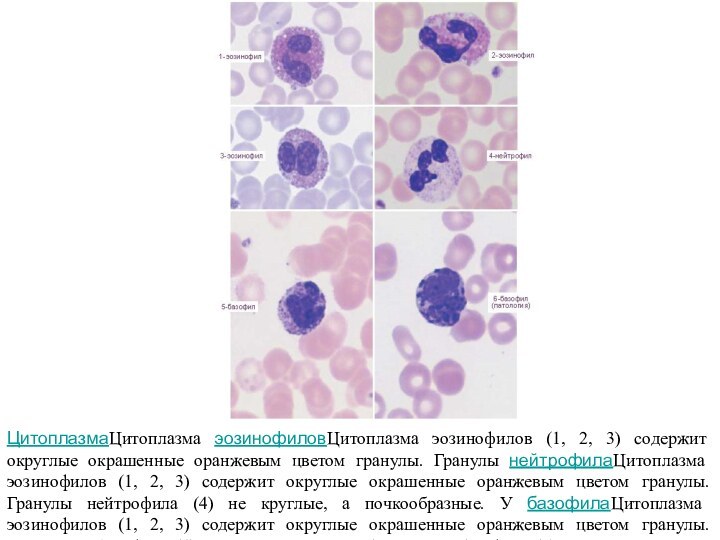
ЦитоплазмаЦитоплазма эозинофиловЦитоплазма эозинофилов (1, 2, 3) содержит округлые
окрашенные оранжевым цветом гранулы. Гранулы нейтрофилаЦитоплазма эозинофилов (1, 2,
3) содержит округлые окрашенные оранжевым цветом гранулы. Гранулы нейтрофила (4) не круглые, а почкообразные. У базофилаЦитоплазма эозинофилов (1, 2, 3) содержит округлые окрашенные оранжевым цветом гранулы. Гранулы нейтрофила (4) не круглые, а почкообразные. У базофила (5) гранулы округлые, как у эозинофила, но окрашены синим или фиолетовым цветом. При патологии гранулы базофилов (6) могут быть очень крупными. Безъядерные клетки на каждом препарате - эритроциты.
Слайд 10
Характеристика системы комплемента
1. Определяют гемолитическую активность комплемента в

реакции гемолиза с использованием гемолитической системы. Эта система состоит
из эритроцитов барана, обработанных гемолитической сывороткой. Определение комплемента основано на способности продуктов его активации вызывать лизис эритроцитов, покрытых антителами. По степени гемолиза судят о гемолитической активности комплемента. В качестве единицы измерения комплемента используется 50% единица (СН50) - количество комплемента, вызывающее 50%-ный лизис 0.5.мл стандартной суспензии сенсибилизированных эритроцитов при температуре 37°С в течение 60 мин. Титрование комплемента сводится к определению одной 50%-ной гемолитической единицы - объема сыворотки, который содержит СН50. Для этого к различным дозам сыворотки прибавляют стандартное количество сенсибилизированных эритроцитов, а затем устанавливают объем сыворотки, при котором происходит 50%-ный гемолиз.
Степень гемолиза при титровании комплемента можно определять фотометрическими методами (с помощью спектрофотометра, фотоколориметра, нефелометра) или же визуально путем сравнения интенсивности гемолиза в опытных пробирках со стандартной шкалой лизированных эритроцитов.
2. Выявляют продукты активации С4а, С3а, С5а и др.
3. Оценивают методом ИФА количество компонентов комплемента; норма в сыворотке крови в мг/л: C1q-190, Cls-120, С2-30, С4-430, C3-1300, С5-75, С6-60, С7-55, С8-60, С9-160, пропердин-25, фактор В-240, С1-ингибитор-180.
4. С помощью антител против C1q, меченных флюоресцеином выявляют отложения комплемента с иммунными комплексами.
5. Определяют комплементсвязывающие рецепторы на лейкоцитах (CR1, CR2, CR3).
Слайд 11
Для оценки специфических показателей используют 3 группы методов:
1.
Методы определения антител различных иммуноглобулиновых классов (G, М, А,
Е, D) к определенным антигенам.
2. Методы выявления иммунных Т-лимфоцитов, несущих рецепторы к определенному антигену.
3. Методы обнаружения антигенов.
Эти методы основаны на иммунных реакциях, которые ставят в лабораторных условиях. Есть 2 группы реакций: серологические (основаны на взаимодействии антигенов и антител) и клеточные, базирующиеся на взаимодействии антигенов с Т-клетками.
Слайд 12
Серологические реакции для выявления антигенов и антител
Слайд 13
Клеточные методы оценки иммунитета
Реакция бласттрансформации лимфоцитов (РБТЛ). Переход

малых лимфоцитов в бластные формы, способные к пролиферации и
дальнейшей дифференцировке называется бласттрансформацией и сопровождается морфологическими изменениями лимфоцитов. Бласты - крупные, округлой формы клетки имеют большое ядро, занимающее большую часть цитоплазмы. В ядре содержится несколько крупных базофильных ядрышек, цитоплазма бластов зернистая.
РБТЛ изучают в культуре лимфоцитов in vitro. При постановке РБТЛ у человека берут кровь или предварительно выделенные из нее лейкоциты и вносят их в среду 199 или Игла, затем добавляют специфический антиген или митоген. Учет реакции после внесения митогенов проводят через 2-4 суток, а после стимуляции антигенами через 3-5 суток. Неспецифический митоген фитогемагглютинин трансформирует в бласты 70-80%, а ЛПС - 30% лимфоцитов крови человека. Под влиянием специфических антигенов в бласты трансформируются не более 7-12% малых лимфоцитов.
Результаты РБТЛ можно учитывать морфологически - прямым подсчетом бластов в окрашенных препаратах под микроскопом. При наличии аппаратуры РБТЛ учитывают радиометрическим методом, измеряя уровень включения в ДНК лимфоцитов меченного тритием тимидина. Способность к бласттрансформации отражают функциональную активность иммунокомпетентных клеток, поэтому РБТЛ с антигенами и неспецифическими стимуляторами применяют для оценки иммунного статуса организма.
Слайд 14
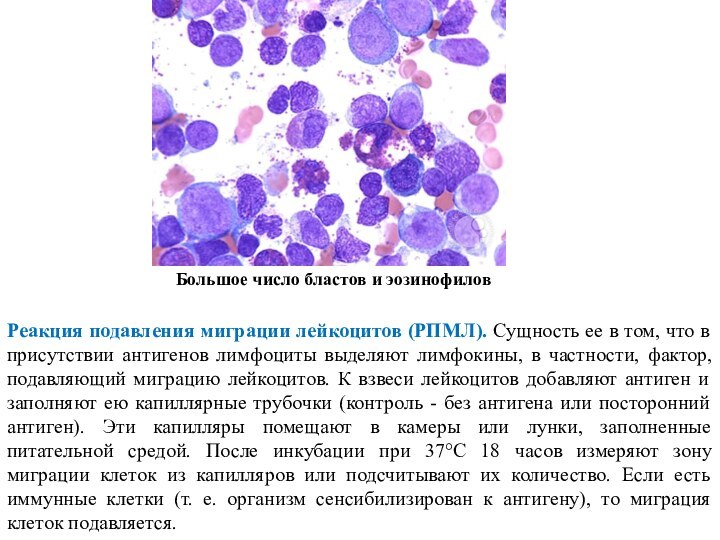
Реакция подавления миграции лейкоцитов (РПМЛ). Сущность ее в
том, что в присутствии антигенов лимфоциты выделяют лимфокины, в
частности, фактор, подавляющий миграцию лейкоцитов. К взвеси лейкоцитов добавляют антиген и заполняют ею капиллярные трубочки (контроль - без антигена или посторонний антиген). Эти капилляры помещают в камеры или лунки, заполненные питательной средой. После инкубации при 37°С 18 часов измеряют зону миграции клеток из капилляров или подсчитывают их количество. Если есть иммунные клетки (т. е. организм сенсибилизирован к антигену), то миграция клеток подавляется.
Большое число бластов и эозинофилов
Слайд 15
Кожные пробы и другие провокационные тесты
Для определения гиперчувствительности
(аллергии) к антигенам-аллергенам у людей проводят провокационные тесты. Суть
их в том, что соответствующий аллерген вводят в организм перорально, ингаляционно, наносят на кожу при ее скарификации или вводят внутрикожно. Обычно, спустя 30 минут оценивают немедленные аллергические реакции (ГЧНТ), а через 24-48 час - замедленные (ГЧЗТ).
На пыльцевые, пищевые, лекарственные аллергены чаще наблюдаются немедленные реакции в виде покраснения и припухлости. Замедленные реакции развиваются на бактериальные антигены. Пробу Манту ставят для выявления сенсибилизации к микобактериям туберкулеза (оценка вакцинации и инфицированности). Туберкулин вводят внутрикожно и при положительной реакции через 24-48 час в месте инъекции возникает воспалительная реакция. Она указывает на наличие сенсибилизации к этому антигену. Сильная реакция, или, наоборот, ее отсутствие (анергия) может быть при туберкулезе.
Слайд 16
Иммунодиагностика вирусных инфекций
Наличие антител к антигенам определенных вирусов
в крови пациента можно выявить следующими способами:
1) реакции
нейтрализации;
2) реакции связывания комплемента (РСК);
3) реакции торможения гемагглютинации;
4) твердофазный иммуноферментный анализ (ИФА).
Экспресс-диагностику вирусных инфекций проводят серологическим методом (с использованием стандартных сывороток с антителами):
1) радиоиммунный анализ (РИА);
2) реакция иммунофлюоресценции (РИФ);
3) твердофазный иммуноферментный анализ (ИФА).
Слайд 17
Иммунодиагностика инфекционного мононуклеоза
Инфекционный мононуклеоз вызывается вирусом Эпштейна

- Барр и выявляется серологическими исследованиями. Определение гетерофильных антител.
Гетерофильными антителами являются иммуноглобулины М. Эти антитела связываются с антигенами животных (эритроцитами быков, баранов и почечной тканью морских свинок) и присутствуют в крови почти у всех пациентов с инфекционным мононуклеозом. Иногда они обнаруживаются у здоровых людей, но в малом количестве и имеют отличия. Выявляют их двумя способами: 1) проба Пауля - Буннелля. Наличие гетерофильных антител в крови пациента определяют с помощью реакции гемагглютинации. Искомые антитела выявляются через 3-4 недели от начала заболевания в титре 1 : 128-1 : 256. Меньший титр антител при соблюдении сроков проведения анализа не является доказательством заболевания. Положительная проба Пауля - Буннелля может быть после проведения профилактических прививок иммунными сыворотками, при вирусных гепатитах, цитомегалии, лейкозе, лимфоме, ревматоидном артрите; 2) моно-тест (экспресс-тест). Проводят реакцию гемагглютинации. Реагентом для выявления гетерофильных антител являются эритроциты лошади, подвергшиеся обработке формалином. Реакции иммунофлюоресценции. С помощью РИФ определяют антитела к антигену оболочки вируса Эпштейна - Барр. Наличие иммуноглобулинов М в крови пациента говорит о недавно перенесенном или развивающемся заболевании. Титр антител нарастает в течение 2 недель от начала заболевания, а затем снижается на протяжении 2-3 месяцев. Выявление иммуноглобулинов G показывает, что заболевание было давно.
С помощью непрямой реакции иммунофлюоресценции определяют антитела к поверхностным антигенам вируса Эпштейна - Барр, а с добавлением комплемента и антител к нему с метками определяют ядерные антигены этого вируса.
Последние обнаруживаются в крови через 1 месяц от начала заболевания и сохраняются в течение всей жизни человека.
Слайд 18
Иммунодиагностика вирусных гепатитов
Поражение печени с развитием гепатита

вызывают цитомегаловирус, вирусы гепатитов А, В, С, D, Е,
G, F, вирус Эпштейна - Барр. Вирус гепатита F открыт недавно, по своим свойствам он сходен с аденовирусами, иммунодиагностика гепатита F пока не разработана. Исследуемым материалом обычно является сыворотка крови.
Иммунодиагностика гепатита А. Выявление иммуноглобулинов М проводят с помощью:
1) радиоиммунного анализа (РИА);
2) твердофазного иммуноферментного анализа (ИФА). Диагностическое значение имеет увеличение титра антител в 4 раза. При электронной микроскопии кала определяют вирус гепатита А.
Иммунодиагностика гепатита В. С помощью твердофазного иммуноферментного анализа (ИФА) определяют маркеры вирусного гепатита В в сыворотке крови, вирус определяется во всех биологических жидкостях. Выявляют следующие маркеры гепатита В:
1) поверхностный антиген вируса гепатита В (HbsAg) выявляется через 3-6 месяцев после заражения, при хроническом заболевании и у вирусоносителей;
2) антиген вируса гепатита В (HbeAg) определяется в конце инкубационного периода или начальном периоде заболевания;
3) антитела к антигену ядерной оболочки вируса (HbcAg) выявляются в острую стадию заболевания;
4) выявление антител к HbsAg и HbeAg подтверждает выздоровление.
Слайд 19
Иммунодиагностика гепатита С. Через 3 месяца от начала

заболевания в крови больного выявляются антитела к вирусу гепатита
С с помощью твердофазного иммуноферментного анализа (ИФА).
Иммунодиагностика гепатита D. Проводят определение антител к антигену > вируса гепатита D (HdAg) с помощью иммуноферментного анализа (ИФА).
Следует учитывать, что вирус гепатита D поражает организм человека только при наличии вируса гепатита В, поэтому маркеры гепатита В также будут выявляться.
Иммунодиагностика гепатита Е. Проводят определение антител к вирусу гепатита Е с помощью иммуноферментного анализа (ИФА).
Иммунодиагностика гепатита G. Для диагностики гепатита G выявляют маркеры-антитела к антигенам вируса:
1) через 10-12 дней после заражения в крови выявляются антитела (иммуноглобулины М) к вирусу гепатита G с помощью твердофазного иммуноферментного анализа (ИФА);
2) через 1 месяц после выздоровления выявляются антитела (иммуноглобулины G) к вирусу гепатита G.
Часто гепатит G сочетается с гепатитом С, в этом случае маркеры гепатита С также будут выявляться.
Слайд 20
Иммунодиагностика ВИЧ-инфекции
Выявляют антитела к вирусу иммунодефицита человека
(ВИЧ) в сыворотке крови через 3-6 месяцев после заражения
следующими способами:
1) твердофазный иммуноферментный анализ (ИФА);
2) иммуноблоттинг. Исследование, включающее электрофорез, иммуноферментный анализ и радиоиммунный анализ;
3) полимеразная цепная реакция. Это молекуляно-биологический метод исследования. Фрагменты ДНК вируса соединяются с реагентами и многократно копируются естественным путем. В результате образуется много молекул с фрагментами ДНК вируса и их можно определить, даже если в исходном материале они были в единичном количестве.
Слайд 21
Иммунодиагностика опухолей
Опухоль-ассоциированные антигены (ТАА) могут
помочь в диагностике различных опухолей и иногда определяют ответ
на терапию или возврат болезни. Идеальным опухолевым маркером являлся бы маркер, выделяемый только из опухолевой ткани, специфичный для данного типа опухоли, определяемый при малом количестве опухолевых клеток, имеющий непосредственное отношение к массе опухолевых клеток и презентирующий у всех больных с данной опухолью. Однако, хотя большинство опухолей высвобождают антигенные макромолекулы в циркуляцию, ни один из опухолевых маркеров не имеет всех необходимых характеристик, обеспечивающих достаточную специфичность или чувствительность для использования в ранней диагностике или в программах массового скрининга рака.
Слайд 22
Раковый эмбриональный антиген (РЭА) является протеин-полисахаридным комплексом, выявляемым

при раке толстой кишки и в нормальном фетальном кишечнике,
поджелудочной железе и печени. Уровень этого антигена в крови повышен у больных раком толстой кишки, но специфичность его относительная, так как позитивные результаты встречаются у много курящих людей, у больных циррозом, при язвенном колите и других онкологических заболеваниях (например, рак молочной железы, поджелудочной железы, мочевого пузыря, яичников, шейки матки). Мониторинг уровня РЭА может быть полезным для определения возврата болезни после хирургического удаления опухоли у больных, имевших изначально повышенный уровень РЭА.
а-Фетопротеин является нормальным продуктом фетальных клеток печени, также выявляется в сыворотке крови у больных первичной гепатомой, неоплазмами желточного мешка и часто эмбриональными раком яичников и яичек.
b-cубъединица человеческого хорионного гонадотропина определяется иммунологическими методами исследования и является основным клиническим маркером у женщин при трофобластических опухолях (ТО) — группе заболеваний, включающих пузырный занос, неметастатические ТО и метасти-ческие ТО и у мужчин с тестикулярным эмбриональным раком или хориокарциномой.
Слайд 23
Простат-специфический антиген (PSA) — гликопротеин, локализующийся в эпителиальных

клетках протоков предстательной железы, может быть определен в низкой
концентрации у здоровых мужчин. В исследованиях с использованием моноклональных антител примерно у 90 % больных с прогрессирующим раком предстательной железы определяется повышение уровня PSA, даже в отсутствие данных о метастазировании опухоли. Тест является более чувствительным, чем определение простатической кислой фосфатазы. Но так как уровень PSA повышен и при доброкачественной гипертрофии предстательной железы, специфичность данного исследования небольшая. Определение PSA можно использовать для мониторинга рецидива заболевания после лечения рака предстательной железы.
СА 125 используется при диагностике и мониторинге терапии рака яичников, хотя любой перитонеальный воспалительный процесс может повысить его уровень. b-2-Микроглобулин часто повышен при множественной миеломе и некоторых лимфомах. Используется для прогноза заболевания.
СА 19-9 изначально использовали для выявления колоректального рака, но затем было показано, что он имеет большую чувствительность для рака поджелудочной железы. В первую очередь используется для оценки ответа на лечение у больных с распространенным раком поджелудочной железы. Уровень СА 19—9 может быть повышен также при других видах онкологических заболеваний ЖКТ, особенно раке желчных протоков.
Слайд 24
СА 15-3 повышен у 54—80 % больных метастическим

раком молочной железы. Кроме того, его уровень может быть
повышен при различных доброкачественных (хронические гепатиты, циррозы, туберкулез, саркоидоз, СКВ) и злокачественных (рак легкого, яичников, эндометрия, ЖКТ, мочевого пузыря) заболеваниях. Этот маркер в первую очередь используется для мониторинга ответа на терапию.
Хромогранин А используется в качестве маркера карциноидных и других ней-роэндокринных опухолей. Аномальный уровень обнаруживается у 1/3 больных локализованными формами заболевания и у 2/3 метастатическим раком. Уровень может быть повышен при других злокачественных заболеваниях, таких как рак легкого и предстательной железы.
Тироглобулин продуцируется щитовидной железой и может быть повышен при различных тиреоидных заболеваниях. В первую очередь применяется при раке щитовидной железы после полной тиреоидэктомии с целью определения рецидива заболевания и для мониторинга ответа на лечение при метастатической форме раке.
ТА-90 является высокоиммуногенной субъединицей мочевого опухоль-ассоциированного антигена, который присутствует у 70 % больных меланомой, мягкотканными саркомами и раком молочной железы, толстой кишки и легкого. В некоторых исследованиях показано, что уровень ТА-90 можно использовать для достаточно точного прогноза выживаемости и наличия субклинической болезни после хирургического удаления меланомы.
Слайд 25
Иммунопрофилактика
В результате контакта с микробами во время инфекции

развивается временный или постоянный иммунитет к ним. Иммунопрофилактика позволяет
выработать иммунитет до естественного контакта с возбудителем. Благодаря созданию вакцин стала возможной профилактика многих инфекционных болезней и ликвидация такого тяжелого заболевания, как натуральная оспа.
Активная и пассивная иммунизация
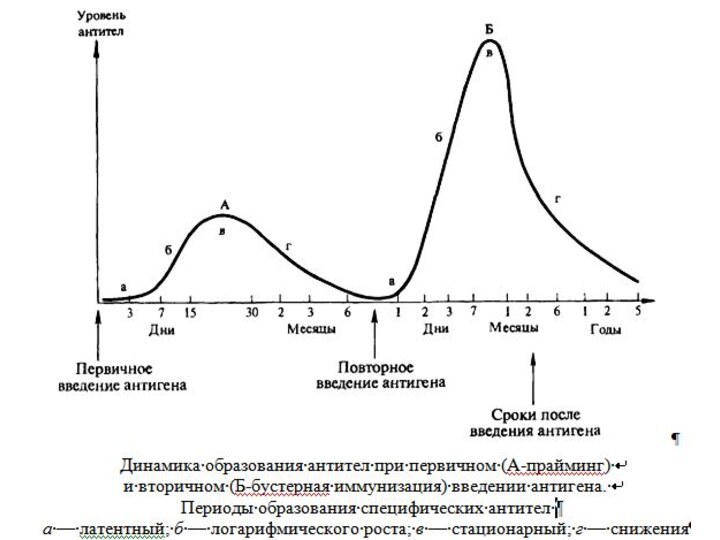
А. Активная иммунизация — введение антигена для стимуляции иммунного ответа и развития иммунитета. Повторная иммунизация способствует более выраженному иммунному ответу и повышению устойчивости к возбудителю. При инфекциях с длительным инкубационным периодом, например при бешенстве, активная иммунизация позволяет предупредить заболевание даже после заражения. В зависимости от типа антигена активная иммунизация приводит к формированию временного или постоянного иммунитета.
Б. Пассивная иммунизация — введение антител к каким-либо антигенам. С помощью пассивной иммунизации можно создать только временный иммунитет продолжительностью 1—6 нед. Хотя пассивная иммунизация вызывает кратковременное повышение устойчивости к возбудителю, ее действие проявляется немедленно. Повторная пассивная иммунизация не усиливает иммунитет и часто сопровождается осложнениями. Ее обычно проводят после контакта с возбудителем и при невозможности активной иммунизации.
Слайд 26
Существует следующая классификация противоинфекционного иммунитета.
I. По

своему развитию:
1) естественный иммунитет:
а) естественный
пассивный, т. е. иммунитет, который передается пассивно, от матери плоду во время беременности через плаценту. Ребенок получает иммунитет только от тех болезней, которыми переболела сама мать за свою жизнь или против которых осуществлялась иммунизация. Необходимо помнить о том, что ребенок получает защитные антитела не только во время внутриутробного развития, но и в процессе вскармливания грудным молоком (он получает иммуноглобулины А);
б) естественный активный иммунитет возникает после перенесенного самим ребенком заболевания. Развивается он не сразу, а через 1–3 недели после начала заболевания, сохраняется от нескольких месяцев до нескольких лет и даже пожизненно;
2) искусственный иммунитет:
а) искусственный пассивный иммунитет образуется после введения готовых защитных антител. Формируется сразу, продолжается от двух до пяти недель;
б) искусственный активный иммунитет возникает в результате введения вакцин (антигены инфекционных возбудителей).
II. По взаимодействию с возбудителем:
1) стерильный или постинфекционный иммунитет, возникающий после перенесенной инфекции. Сохраняется после удаления инфекционного агента из организма (корь, дифтерия);
2) нестерильный или инфекционный иммунитет действует только тогда, когда в организме имеется возбудитель заболевания (туберкулез, сифилис).
Слайд 27
III. По охвату организма:
1) общий иммунитет

– проявляется в защите всего организма;
2) местный
иммунитет – характеризуется защитой определенного органа.
IV. По механизму возникновения:
1) гуморальный иммунитет;
2) клеточный иммунитет;
3) смешанный (основной) иммунитет.
V. По направленности действия:
1) антитоксический иммунитет направлен против токсинов возбудителя. В основе лежит гуморальный иммунный ответ. Выведение токсина осуществляется благодаря взаимодействию защитных антител с токсином, их обезвреживанию, изменению свойств (токсин не может прикрепиться к клетке – мишени), осаждению;
2) антибактериальный иммунитет проявляется формированием защитных антител против всех антигенов бактерий;
3) противовирусный иммунитет возникает против различных вирусов;
4) антигрибковый (против антигенов грибков) – близок к антибактериальному.
В результате взаимодействия организма с микробными агентами развивается временный или постоянный иммунитет к ним. Иммунопрофилактика позволяет выработать иммунитет до того, как произойдет естественный контакт с возбудителем.
Слайд 28
Иммунопрофилактика представляет собой способ индивидуальной или массовой защиты
людей от инфекционных заболеваний, который осуществляется благодаря созданию или
повышению искусственного иммунитета.
Существует несколько видов иммунопрофилактики.
1. Специфическая – проводится против определенного инфекционного агента.
2. Активная – определяет развитие иммунитета благодаря введению вакцин.
3. Пассивная – развитие иммунитета обусловлено введения сывороток и иммуноглобулина.
4. Неспецифическая – осуществляется в результате усиления собственной иммунной системы организма.
Повсеместное внедрение иммунопрофилактики инфекций способствует снижению или даже ликвидации инфекционных заболеваний.
Слайд 29
По механизму образования выделяют следующие типы вакцин:

1) живые – создаются из ослабленных микробов, потерявших свои
вредные свойства, реально существующих в природе. К ним относятся вакцины против оспы, полиомиелита, туляремии, а также специально выведенные вакцины – БЦЖ, гриппозная. Ослабленные вакцинные микроорганизмы размножаются в организме, в результате чего формируется невосприимчивость;
2) убитые – делаются из возбудителей, обладающих выраженным патогенными свойствами, путем их уничтожения физическими (температура, радиация, ультрафиолетовый свет) или химическими (спиртовые растворы, формальдегид) методами. К таким вакцинам относятся коклюшная и против гепатита А, однако они применяются мало, так как часто вызывают патологические реакции;
3) химические – создаются из клеток бактерий, выделенных химическим методом – это брюшнотифозная и менингококковая вакцины;
4) анатоксины – являются наружными токсинами микробов, обработанных раствором формалина в термостате в течение месяца, благодаря чему токсические свойства теряются, но сохраняются иммуногенные;
5) синтетические – искусственно образованные вакцины, несущие антигенные особенности микроорганизмов;
6) рекомбинантные – образованные с помощью генной инженерии. В основе этого метода лежит встраивание генов патологического микроорганизма в геном (генетическую структуру) обезвреженного возбудителя, который при размножении образует и накапливает необходимый, определенный антиген.
Слайд 30
Виды вакцин
А. Бактериальные вакцины могут быть живыми
и инактивированными. Для приготовления живых вакцин используются штаммы со
сниженной вирулентностью и сохраненными антигенными и иммуногенными свойствами. Патогенность некоторых бактерий определяется их способностью вырабатывать токсины. Для стимуляции выработки токсиннейтрализующих антител применяют анатоксины — инактивированные токсины с сохраненными антигенными и иммуногенными свойствами.
Б. Вирусные вакцины также могут быть живыми и инактивированными. Живые вирусные вакцины вызывают более длительный иммунитет, чем инактивированные. Для поддержания иммунитета с помощью инактивированных вакцин требуется более частая ревакцинация. Живые вирусные, как и живые бактериальные, вакцины изготавливаются из штаммов со сниженной вирулентностью, но сохраненными антигенными и иммуногенными свойствами.
Слайд 31
По своему составу вакцины могут быть:
1)
моновакцинами, т. е. содержать патологические факторы одного микроорганизма;
2) ассоциированные, т. е. вакцины, в составе которых имеется несколько компонентов.
В практике используются только вакцины, соответствующие предъявляемым требованиям:
1) иммуногенность является способностью создавать иммунный ответ;
2) безопасность;
3) ареактогенность, т. е. отсутствие возникновения побочных проявлений;
4) стабильность, проявляющаяся отсутствием изменения свойств вакцинального микроба;
5) стандартность, характеризующаяся определенным структурным составом;
6) возможность ассоциирования, т. е. соединение нескольких микроорганизмов в одну вакцину.
Слайд 32
Требования к вакцинам (критерии эффективности вакцин):
Иммуногенность (иммунологическая эффективность,

протективность); в 80–95 % случаев вакцины должны создавать напряженный и
длительный специфический иммунитет, который эффективно защитит от заболевания, вызываемого «диким» штаммом патогена.
Напряженность иммунитета — состояние, при котором организм способен оставаться невосприимчивым к заболеванию. Практически любой иммунитет можно преодолеть массивными дозами возбудителя. И сделать это тем легче, чем больше времени прошло с момента последней иммунизации.
Длительность иммунитета — время, в течение которого сохраняется невосприимчивость.
Безопасность — вакцины не должны быть причиной заболевания или смерти, а вероятность поствакцинальных осложнений должна быть меньше, чем риск заболевания и постинфекционных осложнений; это особенно актуально для живых вакцин.
Ареактогенность — вакцины не должны вызывать сильные поствакцинальные реакции. В инструкциях по применению вакцин определяется допустимая степень их реактогенности. Если частота сильных реакций превышает допустимый уровень, оговоренный в инструкции к вакцине (обычно от 0,5 до 4 %), то эта серия изымается из употребления. Наиболее реактогенны убитые вакцины (одна из самых реактогенных — АКДС за счет коклюшного компонента); наименее реактогенны живые накожные вакцины.
Слайд 33
Стабильность — сохранение иммуногенных свойств при производстве, транспортировке,
хранении и применении вакцины.
Ассоциируемость — возможность одновременного применения
антигенов нескольких микроорганизмов в составе комбинированных вакцин (КПК, АКДС, Тетраксим, Пентаксим). Ассоциированные вакцины позволяют одновременно иммунизировать против нескольких инфекций, уменьшить сенсибилизацию прививаемых, совершенствовать календарь прививок и удешевить процедуру иммунизации.
Стандартизуемость — должны легко дозироваться и отвечать международным стандартам.
Практические соображения — относительно низкая цена вакцины, удобство применения.
Слайд 34
«Идеальная вакцина» должна соответствовать следующим требованиям:
высокая иммуногенность: должна

индуцировать иммунитет напряженный, длительный (лучше пожизненный), без бустерных вакцинаций;
содержание
только протективных антигенов. Термин «протективный антиген» применяют по отношению к молекулярным структурам возбудителя, которые при введении в организм способны индуцировать протективный эффект — невосприимчивость организма к заражению. Протективные антигены не всегда бывают иммуногенны, чаще — наоборот;
полная безопасность: не способна вызвать заболевание и поствакцинальные осложнения;
ареактогенность: отсутствие сильных поствакцинальных реакций;
хорошая стандартизуемость и удобство применения: введение раннее, пероральное, без разведения;
стабильность при хранении;
хорошая ассоциируемость: одна инъекция препарата должна индуцировать иммунитет против всех инфекций.
С точки зрения молекулярной и клеточной иммунологии вакцина должна удовлетворять следующим требованиям:
а) активировать вспомогательные клетки (макрофаги, дендритные клетки, клетки Лангерганса), участвующие в процессинге и представлении антигена, формировать микроокружение и поляризацию, необходимые для протективного ответа, т. е. содержать структуры, распознаваемые АПК;
б) содержать протективные эпитопы для Т- и В-лимфоцитов;
в) эффективно презентироваться: легко подвергаться процессированию, эпитопы должны взаимодействовать с антигенами ГКГС;
г) индуцировать образование регуляторных, эффекторных клеток и клеток иммунологической памяти.
Слайд 35
Живые (аттенуированные) вакцины — вакцины, у которых биологическая

активность не инактивирована, но способность вызвать заболевание резко снижена.
Живые вакцины готовят на основе ослабленных (аттенуированных) живых штаммов микроорганизмов со сниженной вирулентностью, но сохраненными антигенными и иммуногенными свойствами.
Пути получения вакцинных штаммов для приготовления живых вакцин:
Отбор мутантов с ослабленной вирулентностью;
Экспериментальное снижение вирулентных свойств возбудителей при культивировании в неблагоприятных условиях (например, авирулентный штамм M. bovis (БЦЖ-вакцина) получен при культивировании вирулентного штамма на среде с желчью);
Длительное пассирование возбудителей через организмы маловоспримчивых животных (получение Пастером первой антирабической
вакцины);
Генетическое скрещивание авирулентного и вирулентного штаммов вируса гриппа и полученние авирулентного рекомбинанта;
Использование штаммов, вирулентных для других видов, но авирулентных для человека: вирус осповакцины защищал человека от заболевания натуральной оспой.
Слайд 36
Примеры живых вакцин: вакцины для профилактики гриппа, краснухи,
кори, эпидемического паротита, полиомиелита (ОПВ), ООИ (желтой лихорадки, чумы,
туляремии, бруцеллеза, сибирской язвы, натуральной оспы), туберкулеза.
Слайд 37
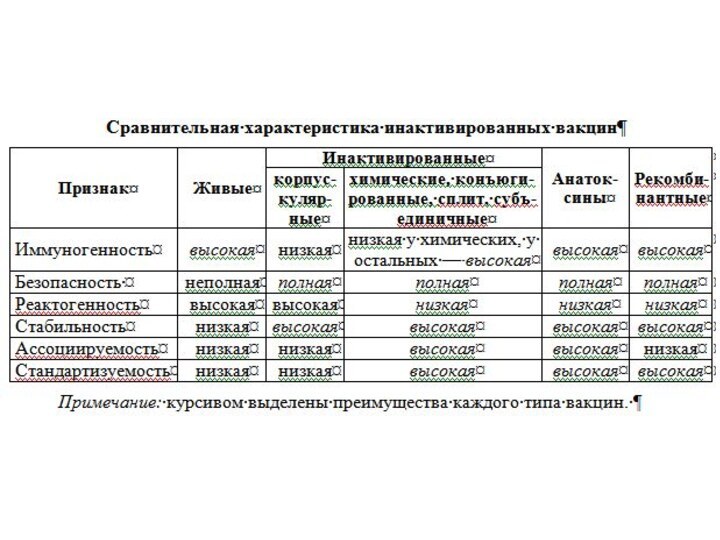
Инактивированные (убитые) вакцины: корпускулярные, химические, конъюгированные, расщепленные субвирионные
и субъединичные вакцины. Вводятся п/к или в/м.
Корпускулярные вакцины получены
из цельных вирусов (цельновирионные) или бактерий (цельноклеточные), у которых прекращена биологическая способность к росту или репродукции. Они представляют собой целые бактерии или вирусы, инактивированные химическим или физическим воздействием, при этом протективные антигены сохраняются. Затем вакцины очищают от балластных веществ, консервируют тиомерсалом.
Примеры корпускулярных вакцин: цельноклеточные — коклюшная (как компонент АКДС), холерная, лептоспирозная, брюшнотифозная; цельновирионные — антирабическая, противогриппозная, противогерпетическая, против клещевого энцефалита.
Слайд 38
Химические вакцины — выделенные из бактериальной биомассы вещества

определённой химической структуры. Преимущество таких вакцин заключается в снижении
количества балластных веществ и снижении реактогенности. Такие вакцины легче поддаются ассоциации. Недостаток химических вакцин, содержащих полисахаридные Т-независимые антигены, — независимость от рестрикции по антигенам ГКГС.
Примеры химических вакцин: против пневмококковой (Пневмо-23), менингококковой инфекций, брюшного тифа, дизентерии.
Конъюгированные вакцины — комбинации бактериальных полисахаридов с иммуногенным белком-носителем (обычно анатоксином другого типа микроорганизмов). Некоторые бактерии (гемофильная палочка, пневмококки) имеют антигены, которые плохо распознаются иммунной системой детей. В современных вакцинах полисахариды конъюгируют с иммуногенным белком-носителем, хорошо распознаваемым иммунной системой ребёнка.
В результате иммуногенность конъюгированных вакцин повышается, а при их введении индукцируется Т-клеточная иммунологическая память.
Примеры конъюгированных вакцин: Акт-Хиб — вакцина для профилактики гемофильной инфекции (конъюгирована со столбнячным анатоксином), Превенар — вакцина для профилактики пневмококковой инфекции (конъюгирована с дифтерийным анатоксином).
Слайд 39
Расщепленные субвирионные (сплит-вакцины) содержат поверхностные антигены и набор

внутренних антигенов вирусов гриппа. Благодаря этому сохраняется их высокая
иммуногенность, а высокая степень очистки обеспечивает низкую реактогенность, и следовательно, хорошую переносимость и небольшое количество нежелательных реакций. Большинство сплит-вакцин разрешено использовать у детей с 6-месячного возраста.
Примеры сплит-вакцин: вакцины против гриппа (Ваксигрипп, Бегривак, Флюарикс).
Субъединичные вакцины (молекулярные) — протективные эпитопы (определенные молекулы) бактерий или вирусов. Преимущество субъединичных вакцин в том, что из микробных клеток выделяются иммунологически активные субстанции — изолированные антигены. При введении в организм растворимые антигены быстро рассасываются, поэтому для повышения напряженности иммунитета их сорбируют на адъювантах. Иммуногенность субъединичных вакцин выше, чем корпускулярных, но меньше, чем живых. Они малореактогенны, стабильны, легче подвергаются стандартизации, их можно вводить в виде ассоциированных препаратов.
Примеры субъединичных вакцин: вакцины против гриппа (Гриппол, Инфлювак, Агриппол), ацеллюлярная (бесклеточная) коклюшная вакцина.
Слайд 40
Анатоксины — препараты, полученные из бактериальных экзотоксинов, полностью

лишенные токсических свойств, но сохранившие антигенные и иммуногенные свойства.
Для получения экзотоксинов возбудителей токсинемических инфекций выращивают в жидких питательных средах для накопления экзотоксина, фильтруют через бактериальные фильтры для удаления микробных тел, инактивируют воздействием 0,04%-ного формалина при 37 ºС в течение 1 мес. Полученный анатоксин проверяют на стерильность, безвредность и иммуногенность. Затем нативные анатоксины очищают от балластных веществ, концентрируют и сорбируют на адъювантах. Адсорбция значительно повышает иммуногенность анатоксинов.
Анатоксины вводят в/м или п/к. Они индуцируют образование антитоксических антител и обеспечивают развитие иммунологической памяти, формируя напряженный, длительный (4–5 лет и более) иммунитет. Они безопасны, малореактогенны, хорошо ассоциируются, стабильны, выпускаются в жидком виде.
Примеры анатоксинов. Адсорбированные высокоочищенные концентрированные анатоксины применяются только для профилактики бактериальных инфекций, при которых основным фактором патогенности возбудителя является экзотоксин (дифтерии, столбняка, реже — ботулизма, газовой гангрены, стафилококковой инфекции).
Слайд 41
Рекомбинантные генно-инженерные субъединичные вакцины получают методами генной инженерии
с использованием рекомбинантной ДНК-технологии: гены вирулентного микроорганизма, отвечающие за
синтез протективных антигенов, встраивают в геном носителя-вектора. Векторный микроорганизм продуцирует белки, кодируемые встроенным геном. Такая технология позволяет использовать для иммунизации очищенные протективные антигены. При этом исключается введение других микробных антигенов, которые не являются протективными, но могут индуцировать реакцию гиперчувствительности или обладать иммунодепрессивным действием.
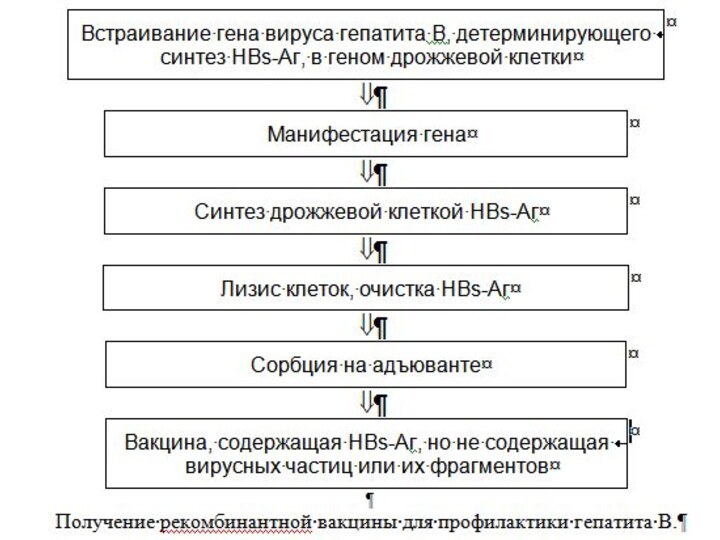
Сегодня широко используются высокоиммуногенные рекомбинантные вакцины для профилактики ВГВ, полученные на основе клеток дрожжей-сахаромицетов, в геном которых встроен ген, кодирующий синтез HBs-Аг. В результате экспрессии вирусного гена дрожжи продуцируют HBs-Аг, который затем очищается и связывается с адъювантом.
Слайд 44
Перспективные вакцины:
Рекомбинантные векторные вакцины. Вектор — микроорганизм, который

не является причиной болезни у человека и используется в
качестве носителя для транспорта в организм человека генов, кодирующих антигены патогенов. В качестве вектора могут использоваться дрожжевые клетки, безопасные для человека вирусы (вирус осповакцины, вирус птичьей оспы, аденовирусы животных), бактерии, плазмиды.
Ген, отвечающий за антигенные свойства микроорганизма, встраивают в геном вектора. Векторные микроорганизмы размножаются в организме привитого, индуцируя иммунитет против носителя и тех возбудителей, чьи гены встроены в геном. При применении векторных вакцин существует опасность: возможная патогенность носителя для лиц с иммунодефицитами. В перспективе предполагается использовать векторы, в которые встроены не только гены, контролирующие синтез антигенов возбудителя, но и гены, кодирующие различные медиаторы иммунного ответа (интерфероны, интерлейкины).
Кассетные (экспозиционные) вакцины — один из вариантов генно-инженерных. Носитель антигенности в такой вакцине — белковая структура, на поверхности которой экспонируются специально отобранные, обладающие высокой антигенностью и необходимые для формирования специфического иммунитета детерминанты, введенные генно-инженерным или химическим путем.
Слайд 45
Синтетические пептидные вакцины — искусственно синтезированные из аминокислот
пептидные фрагменты, соответствующие антигенным детерминантам микроорганизмов. Они индуцируют иммунный
ответ узкой специфичности.
Получение синтетических пептидных вакцин:
выявление главной детерминанты (эпитопа протективного антигена), ответственной за иммуногенность и расшифровка ее структуры;
проведение химического синтеза пептидных последовательностей эпитопа;
химическая сшивка эпитопа с полимерным носителем.
Экспериментальные синтетические вакцины получены против дифтерии, холеры, стрептококковой инфекции, пневмококковой инфекции, сальмонеллезной инфекции, ВГВ, гриппа, клещевого энцефалита.
Слайд 46
ДНК-вакцины — вакцины на основе плазмидных ДНК, кодирующих
протективные антигены возбудителей инфекционных заболеваний.
Доставка вакцины в ядра
клеток может осуществляться либо «выстреливанием» безыгольным инъектором микробной ДНК в кожу, либо
с помощью жировых шариков-липосом, содержащих вакцину, которые будут активно поглощаться клетками. При этом клетки вакцинированного начинают продукцию чужеродного для них белка, процессируют и презентируют его на своей поверхности. В опытах на животных было показано, что таким путем возможно выработать не только антитела, но и специфический цитотоксичный ответ, который ранее считался достижимым только с помощью живых вакцин.
Преимущества ДНК-вакцин:
стабильны и не инфекционны;
могут быть получены в большом количестве;
дают возможность в перспективе получать многокомпонентные вакцины, содержащие две или несколько плазмид, кодирующих разные антигены, цитокины или другие биологически активные молекулы.
Слайд 47
Вакцины, содержащие продукты генов ГКГС. Протективные пептиды вакцинных
антигенов презентируются Т-лимфоцитам в комплексе с антигенами ГКГС. При
этом каждый протективный эпитоп может презентироваться с высоким уровнем иммунного ответа только определенным продуктом ГКГС.
Для эффективной презентации антигена в состав вакцин предполагается вводить готовые антигены ГКГС или их комплексы с протективными эпитопами. В настоящее время проходят испытания следующие вакцины такого типа:
а) комплекс антигенов ГКГС I класса с антигенами ВГВ;
б) комплекс олигопептида и моноклональных антител к антигенам ГКГС II класса.
Антиидиотипические вакцины — моноклональные антиидиотипические антитела, имеющие сходную конфигурацию с антигенной детерминантой (эпитопом) возбудителя. Антиидиотипические антитела — «зеркальное отражение» антигена, способны вызывать образование антител, реагирующих с детерминантной группой антигена. В настоящее время этот подход утратил популярность.
Слайд 49
Классификации сывороток:
По специфичности:
а) нормальная — получают из пула донорской,

плацентарной или абортной крови, она содержит высокие титры антител,
в основном IgG;
б) иммунные — получают из крови:
практически здоровых специально иммунизированных доноров;
людей, проживающих на эндемических территориях (например, по клещевому энцефалиту, вирусным геморрагическим лихорадкам);
переболевших людей (редко);
гипериммунизированных животных, которым вводят нарастающие дозы антигена для достижения максимального уровня специфических антител.
По способу получения:
а) гомологичные (аллогенные) — получают из крови людей, поэтому они менее реактогенны, дают меньше осложнений;
б) гетерологичные (ксеногенные) — получают из крови гипериммунизированных животных. Для получения гетерологичных сывороток используют лошадей, так как они дают более высокий иммунный ответ, чем другие животные, а лошадиный белок менее анафилактогенный. Одна лошадь в год дает около 200 л сыворотки, животное обычно используется для получения сыворотки 2 года.
Слайд 50
Механизмы действия препаратов иммуноглобулинов:
а) восполняют недостающий спектр антител
в организме и участвуют в нейтрализации бактерий, вирусов и
токсических субстанций;
б) активируют систему комплемента, способствуют элиминации циркулирующих иммунных комплексов и диссоциации отложений патологических иммунных комплексов;
в) активируют моноциты, макрофаги, нейтрофилы, повышая эффективность иммунного фагоцитоза;
г) активно воздействуют на некоторые звенья клеточного иммунитета: восстанавливают активность субпопуляции CD4+лимфоцитов, увеличивают продукцию противовоспалительных цитокинов. При этом прекращается реакция системного воспаления.
Слайд 51
Дифтерия. Для лечения больных дифтерией используется гетерологичная противодифтерийная

сыворотка. В ряде стран Европы и в США используется
гомологичный противодифтерийный γ-глобулин.
Ботулизм. Основным препаратом для иммунотерапии больных ботулизмом является гетерологичная противоботулиническая сыворотка. Она выпускается в виде комплектов моновалентных (в упаковке находится по одной ампуле сыворотки типов А, В, С, Е, F) или поливалентных (в одной ампуле — антитоксины трех, четырех или пяти типов) сывороток.
Для пациентов, имеющих аллергию к чужеродному белку (или положительную пробу на в/к введение разведенной сыворотки), используют гомологичный поливалентный противоботулинический γ-глобулин.
Лечение больных ботулизмом, когда неизвестен тип токсина, вызвавшего заболевание, начинается с в/в введения поливалентного препарата или смеси моновалентных сывороток. При затруднениях в/в применения сыворотки, ее назначают в/м. При тяжелом течении заболевания сыворотки применяют в/м повторно. Если в ранние сроки заболевания установлен тип токсина, лечение больных осуществляют моновалентной сывороткой.
Столбняк. Для лечения больных столбняком используется гетерологичная противостолбнячная сыворотка (ПСС), а также гомологичный противостолбнячный иммуноглобулин (ПСЧИ). ПСС используют только, если нет ПСЧИ.
Клещевой энцефалит. Для профилактики заболевания после укуса клеща используют противоэнцефалитный гомологичный γ-глобулин. Если вакцинация не проведена, а предстоит экстренный выезд в эндемичный регион, специфический гомологичный γ-глобулин используется профилактически. Он начинает оказывать защитное действие через 24 часа после введения. Длительность эффекта — около 4 недель, при необходимости более длительной защиты γ-глобулин вводят повторно.