Слайд 2
Информация, полученная в исследовании
Слайд 4
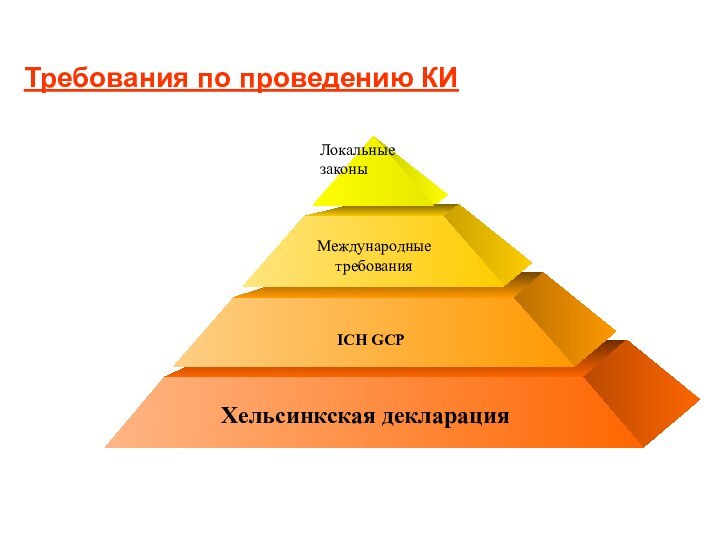
Требования по проведению КИ
Слайд 5
Протокол и поправки к нему
Исследования с участием человека
в качестве субъекта не могут проводиться без одобренного протокола
Оглавление
протокола
6.1 Общая информация General Information
6.2 Обоснование исследования Background Information
6.3 Цели и задачи исследования Trial Objectives & Purpose
6.4 Дизай исследования Trial Design
6.5 Отбор и исключение пациентов Selection & Withdrawal of Subjects
6.6 Лечение субъектов Treatments of Subjects
6.7 Оценка эффективности Assessment of Efficacy
6.8 Оценка безопасности Assessment of Safety
6.9 Статистика Statistics
6.10 Прямой доступ к первичным данным Access to Source Documents
6.11 Контроль качества и обеспечение качества Quality Control & Quality Assurance
6.12 Этика Ethics
6.13 Работа с данными и ведение записей Data Handling & Record Keeping
Слайд 6
Требования протокола
Все вовлеченные стороны обязаны строго соблюдать протокол
исследования
Любые изменения или отклонения от протокола должны быть заранее
в письменном виде одобрены спонсором
Поправки к протоколу вступают в силу только после разрешений компетентных органов и комитетов по этике
Отклонение от протокола по любой причине должно быть документировано и объяснено
Если есть сомнения в понимании протокола или вопросы по нему, надо адресовать их спонсору через монитора
Слайд 7
Что такое информированное согласие?
“Процедура добровольного подтверждения субъектом своего
согласия на участие в конкретном исследовании после получения информации
обо всех значимых для принятия им решения аспектах исследования. Информированное согласие документируется посредством подписания и датирования формы информированного согласия.”
Слайд 8
Информированное согласие
Согласие принимается добровольно после предоставления письменной и
устной информации о ходе исследования, его целях и рисках
Согласие должно быть документировано и собственноручно подписано и датировано сторонами
Перед включением субъекта в исследование должно состояться предварительное интервью с врачом-исследователем
Пациент имеет право в любой момент выйти из исследования
Слайд 9
Информированное согласие (2)
Разделы 4.8.1 – 4.8.15
Чрезвычайно важная часть
исследования
Что это?
Письменный документ, который описывает все применимые:
процедуры
риски
регуляторные требования
Слайд 10
Информированное согласие (3)
4.8.1 Одобряется комитетом по этике.
4.8.2 По
мере появления новой важной информации информированное согласие следует дополнять
и заново подписывать.
4.8.3 Нельзя принуждать субъекта к участию в исследовании.
4.8.4 Информированное согласие не может содержать формулировок, освобождающих исследователя или организацию или спонсора от ответственности за халатность.
4.8.5 Субъект исследования или его представитель информируется обо всех значимых аспектах исследования.
4.8.6 Язык информированного согласия должен быть понятен пициенту.
4.8.7 Пациенту предоставляется достаточное время для вопросов и принятия решения.
Слайд 11
Частые нарушения при документировании ИС
Отсутствует дата или подпись
в форме ИС
Дата получения информированного согласия и дата
ИС отличаются
Пациенты не понимают язык ИС (например, трудовые мигранты)
Свидетель или законный представитель отсутствуют, когда они предусмотрены
Слайд 12
Основные нарушения, выявленные во время инспекций
1. Первичные данные
отсутствуют или не совпадают с данными в ИРК
2. Отклонения
от протокола
3. Нарушения, связанные с документированием согласия пациентов
4. Неадекватный учет исследуемого препарата
5. Не документируются исходы нежелательных явлений
6. Не направляются в комитеты по этике на одобрение поправки к протоколу или новые формы ИС
Top 6 Issues in the Last 10 Years (United States FDA)
Слайд 13
"The consent form is not meant to reassure
the subject, quite the contrary, it is meant to
raise every possible concern that might be relevant to the subject's participation."
Time Magazine, April 22, 2002
Слайд 14
Уязвимые группы
Лица без определенного места жительства
Неизлечимые
больные
Сотрудники медицинских учреждений
Студенты медицинских университетов
Сотрудники фармацевтических компаний
Дети и
пожилые
Военнослужащие
Заключенные
Пациенты в коме
Этнические меньшинства
Неспособные по решению суда самостоятельно принимать решения
Сотрудники правоохранительных органов (российское законодательство)
Слайд 15
Брошюра исследователя (БИ)
Сводное изложение результатов клинического и доклинического
изучения исследуемого продукта, значимых для его исследования с участием
человека
Основная цель предоставить информацию:
Возможные риски
Нежелательные реакции
Методы исследования
Полученные уже данные
Ограничения по лечению исследуемым продуктом
Слайд 16
Брошюра исследователя (2)
Для кого предназначена:
Компетентные органы
Комитеты по этике
Исследователь
“Живой”
постоянно обновляемый документ
Обновляется так часто как необходимо, минимум один
раз в год
Объем зависит от фазы исследования
“Все что вы хотели узнать, но боялись спросить.”
Критичные данные по безопасности
Аналог листка-вкладыша для пациента
Руководство для исследователя
IB
Слайд 17
1. Оглавление
2. Аннотация
3. Введение
4. Физико-химические свойства продукта
5. Доклинические
исследования
5.1 Фармакология
5.2 Фармакокинетика и метаболизм
5.3 Токсикология
6. Действие у человека
6.1
Фармакокинетика и метаболизм
6.2 Безопасность и эффективность
6.3 Маркетинговые исследования (если есть)
7. Заключение. Выводы.
Приложения
Содержание БИ
Слайд 18
Брошюра исследователя. Пример для дискуссии
Вы монитор
и проводите в центре визит инициации. Вы не можете
найти в файле исследователя брошюру исследователя
A. Исследователь взял документ домой почитать
B. Возможно спонсор его не предоставил
C. Исследователь уже ознакомился с информацией о продукте в других документах исследования, и брошюра исследователя для него не критична
D. Центр не готов к визиту инициации
D. Исследование не может быть начато в центре без наличия в файле исследователя брошюры исследователя (8.2.1)
Слайд 19
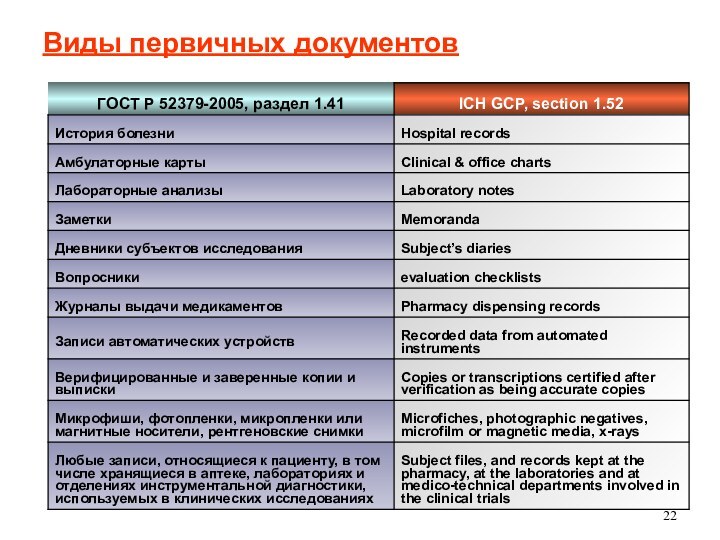
Первичные данные
Любые оригинальные документы, данные, записи, таблицы, лабораторные
распечатки, и др.
Данные ЭКГ, рентгеновские пленки, данные на
магнитных и оптических носителях
Заверенные и сертифицированные копии медицинских документов
Должны подтверждать своим наличием все записи в ИРК
Все первичные документы должны быть доступны для мониторинга, аудитов и инспекций
Слайд 20
Первичные данные (2)
Национальный стандарт Российской Федерации ГОСТ Р
52379-2005, раздел 1.42
Слайд 21
Первичные данные (3)
ICH Topic E6 Guideline for
GCP, section 1.52
Слайд 23
Прямой доступ к первичным документам
ICH Topic E6 Guideline
for GCP, section 1.21, 4.9.7,5.15.1,
Слайд 24
Прямой доступ к первичным документам (2)
Разрешение на изучение,
анализ, проверку и копирование любых записей и отчетов, необходимых
для оценки клинического исследования. Лица, имеющие право прямого доступа (например, представители национальных или иностранных уполномоченных органов, мониторы и аудиторы спонсора), должны принимать все разумные меры для соблюдения нормативных требований по защите конфиденциальности информации, позволяющей идентифицировать субъектов, и информации, принадлежащей спонсору.
Национальный стандарт Российской Федерации ГОСТ Р 52379-2005, раздел 1.48
Слайд 25
Конфиденциальность персональных данных
Слайд 26
Конфиденциальность персональных данных (2)
Федеральный закон Российской Федерации от
27 июля 2006 г. N 152-ФЗ О персональных данных,
статья 3
Слайд 27
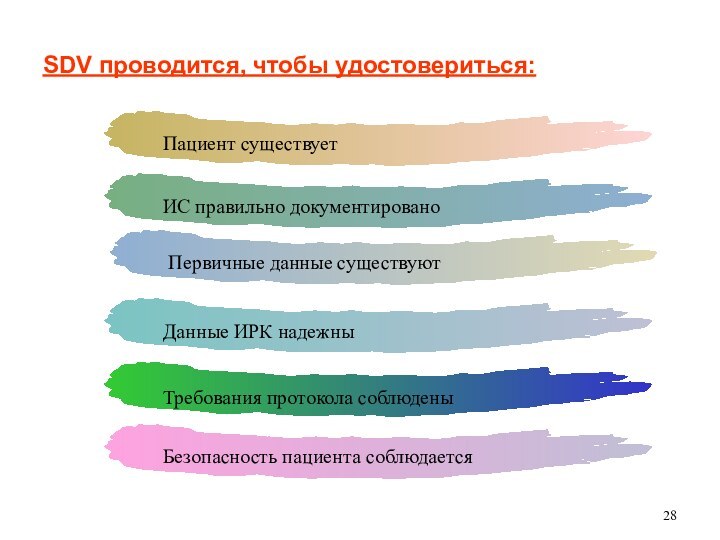
Верификация первичных данных (SDV)
Слайд 28
SDV проводится, чтобы удостовериться:
Слайд 30
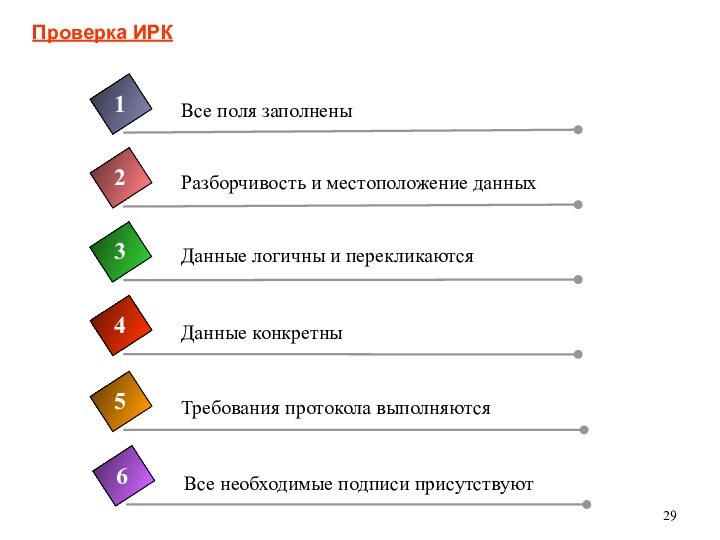
ИРК – 3 «кита»
ИРК - документ на бумажном,
электронном или оптическом носителе, предназначенный для внесения всей предусмотренной
протоколом и подлежащей передаче спонсору информации по каждому субъекту исследования
Все внесенные в ИРК данные должны дублироваться в первичных документах (за исключением особо оговоренных в протоколе случаев, например, запись об этнической принадлежности)
Данные должны вноситься своевременно, в полном объеме, и быть правильными и разборчивыми