- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок изучения нового материала Карбоновые кислоты. Строение, номенклатура, изомерия
Содержание
- 2. Условные обозначенияИсторические сведенияЭто интересноНеобходимо записать в тетрадьОграниченно время выполнения задания
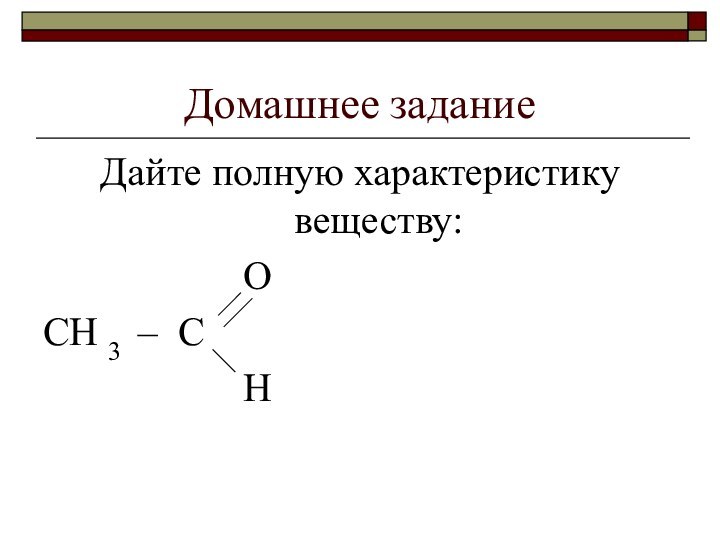
- 3. Домашнее заданиеДайте полную характеристику веществу:
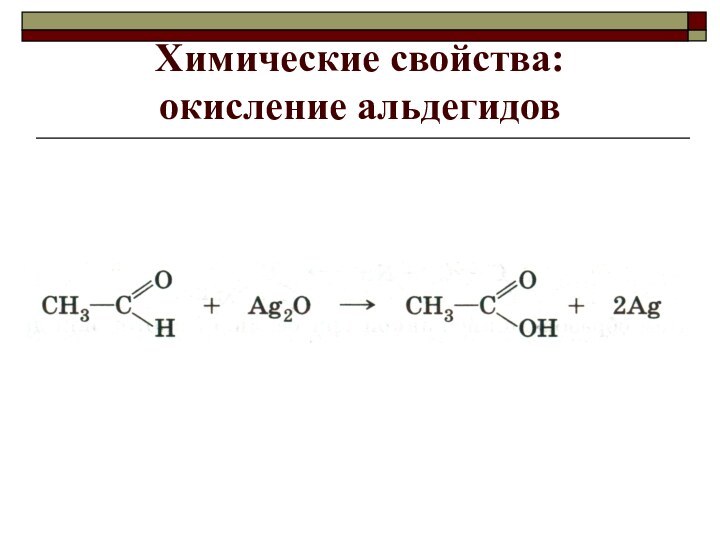
- 4. Химические свойства: окисление альдегидов
- 5. Представьте…Вы разрезали ножом спелый лимон, по ножу
- 6. И в соке лимона, и в соке
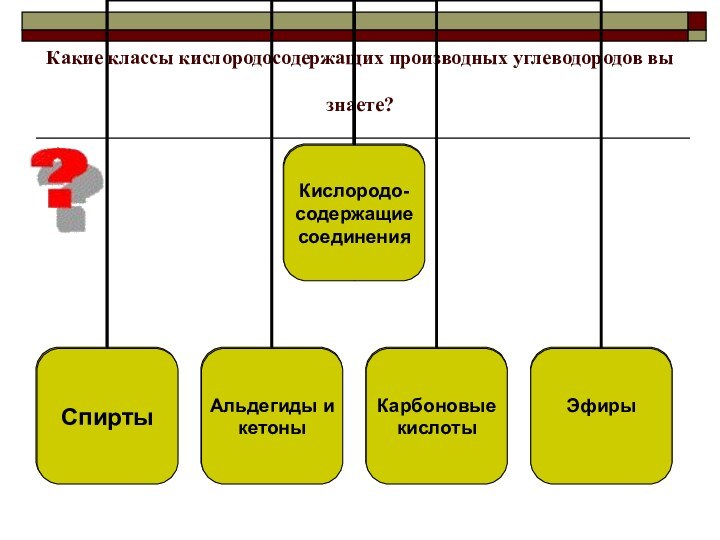
- 7. Какие классы кислородосодержащих производных углеводородов вы знаете?
- 8. Содержание урока:1. Определение 2. Классификация карбоновых кислот3.
- 9. Определение средыКарбоновые кислоты можно обнаружить с помощью
- 10. Поместите индикатор в пробирку и отметьте цвет
- 11. 1. Определение карбоновых кислотКарбоновые кис-лоты – органические
- 12. 2. Классификация карбоновых кислотВ зависимости от природы радикала:1.Предельные – пропионовая;2.Непредельные – акриловая;3.Ароматические – бензойная.
- 13. 2. Классификация карбоновых кислот
- 14. 3. Природные источники карбоновых кислотЩавелевая кислотаВалериановая кислота
- 15. 3. Природные источники карбоновых кислотКапроновая кислота (в козьем жире)Пальмитиновая кислота ( в пальмовом дереве)
- 16. 4. Тривиальные названия кислот
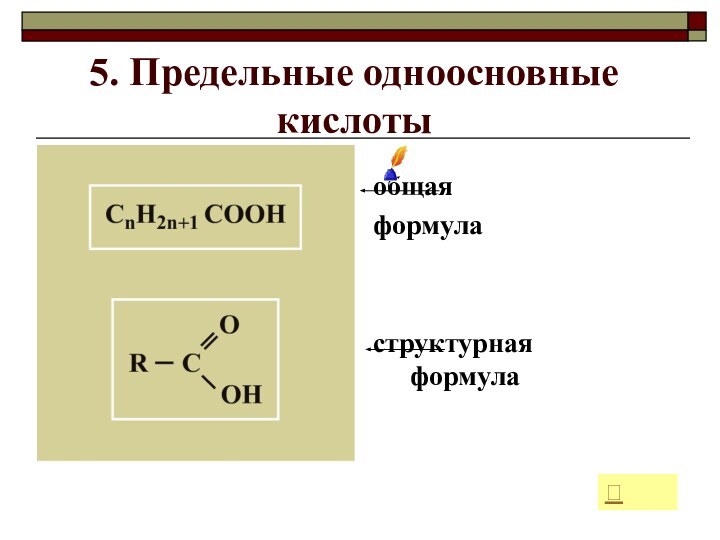
- 17. 5. Предельные одноосновные кислотыобщая формуластруктурная
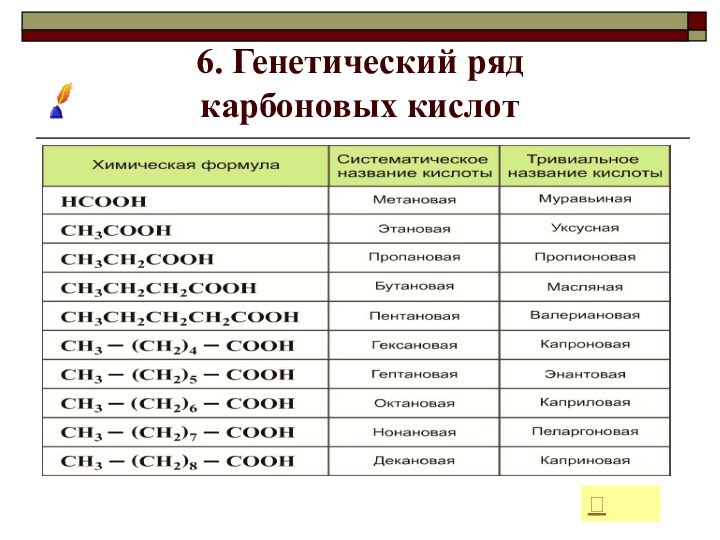
- 18. 6. Генетический ряд карбоновых кислот
- 19. 7. ИзомерияCтруктурная изомерия: - изомерия скелета в
- 20. 7. Изомериямежклассовая изомерия, начиная с C2 (сложные
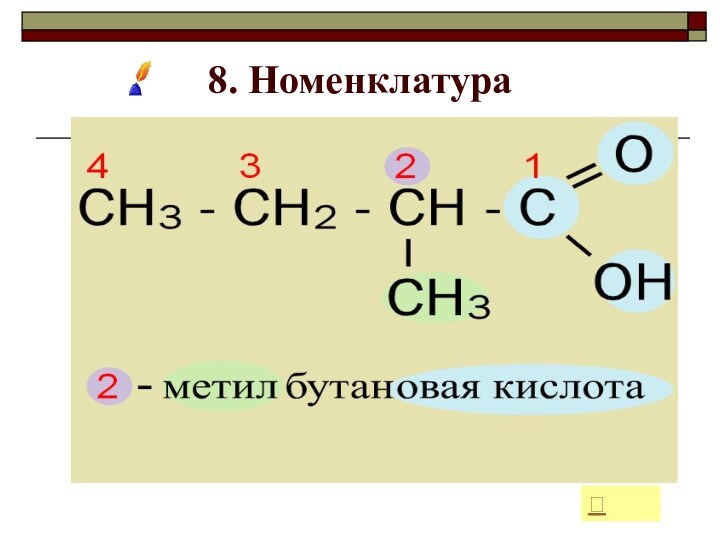
- 21. 8. НоменклатураДля определения названия в соответствии с
- 22. 8. Номенклатура
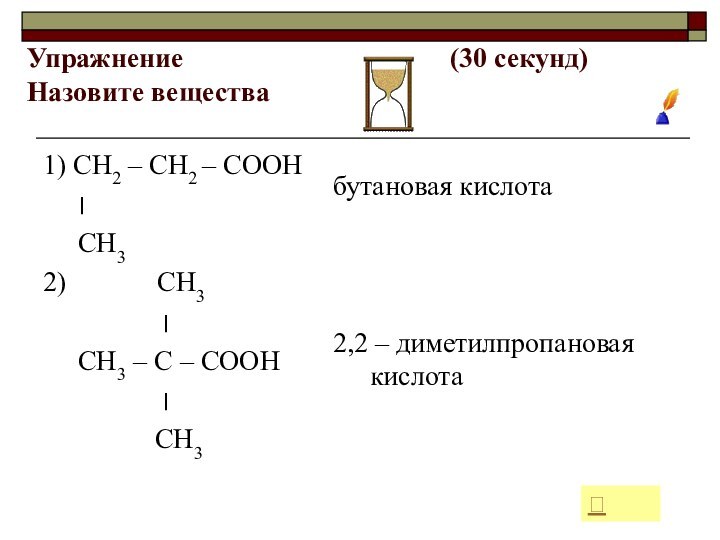
- 23. Упражнение
- 24. Упражнение
- 25. Упражнение
- 26. Домашнее задание1. Для вещества №2 составить все
- 27. Муравьиная кислота НССОН Ее название указывает на
- 28. Муравьиная кислота в природеМуравьиная кислота служит насекомым
- 29. Почему нельзя смачивать водой место муравьиного укуса
- 30. Уксусная кислота СН3СООНКак вам известно, водный разбавленный
- 31. Это интересно…Во времена Ловица химики кроме состава
- 32. Щавелевая кислота НООС-СООНполучена впервые в 1773 г.
- 33. Скачать презентацию
- 34. Похожие презентации



















Слайд 2
Условные обозначения
Исторические сведения
Это интересно
Необходимо записать в тетрадь
Ограниченно время
выполнения задания
Слайд 5
Представьте…
Вы разрезали ножом спелый лимон, по ножу потекла
капелька мутноватого сока. Вы берете в рот дольку лимона
и … Почему сок лимона кислый?Слайд 6 И в соке лимона, и в соке щавеля,
и в соке незрелого яблока имеются органические карбоновые кислоты.
Что придает кислый вкус щавелю и незрелому яблоку?
Почему больно жалит крапива?
И в соке лимона, и в соке щавеля, и в соке незрелого яблока имеются органические карбоновые кислоты.
Слайд 8
Содержание урока:
1. Определение
2. Классификация карбоновых кислот
3. Природные
источники карбоновых кислот
4. Тривиальные названия кислот
5. Предельные одноосновные карбоновые
кислоты6. Генетический ряд карбоновых кислот
7. Изомерия
8. Номенклатура
- Упражнение
9. Домашнее задание
Слайд 9
Определение среды
Карбоновые кислоты можно обнаружить с помощью индикатора,
также как и неорганические кислоты – серную, соляную и
т.д.Практическая работа
Цель: определить среду карбоновой кислоты с помощью индикатора.
Оборудование: штатив с пробирками, лимонная кислота, щелочь.
Ход работы:
-Поместите в пробирку индикатор.
-Отметьте цвет индикатора.
-Определите среду.
Слайд 10
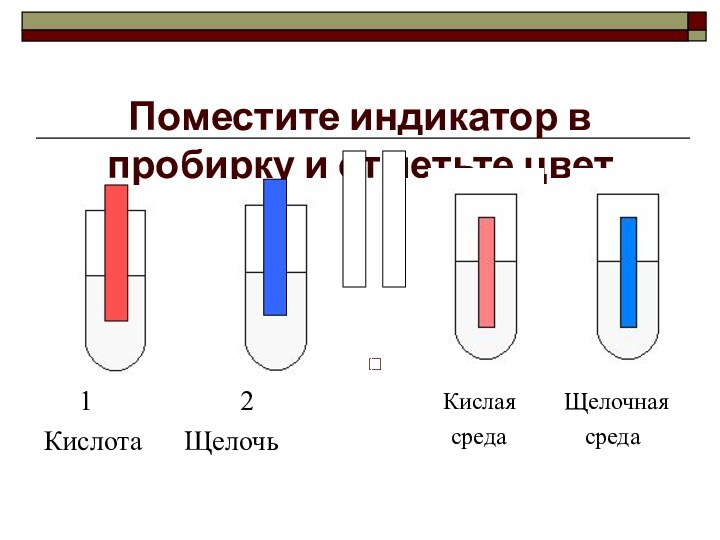
Поместите индикатор в пробирку и отметьте цвет
1
2Кислота Щелочь
Кислая Щелочная
среда среда
Слайд 11
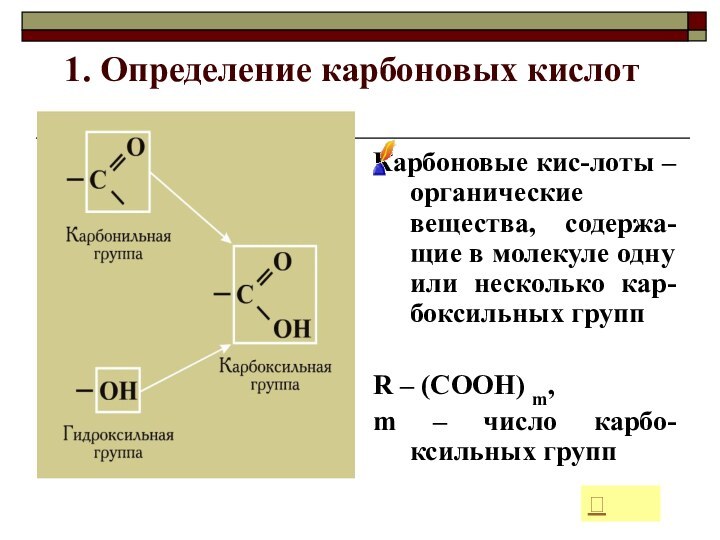
1. Определение карбоновых кислот
Карбоновые кис-лоты – органические вещества,
содержа-щие в молекуле одну или несколько кар-боксильных групп
R –
(СООН) m,m – число карбо-ксильных групп
Слайд 12
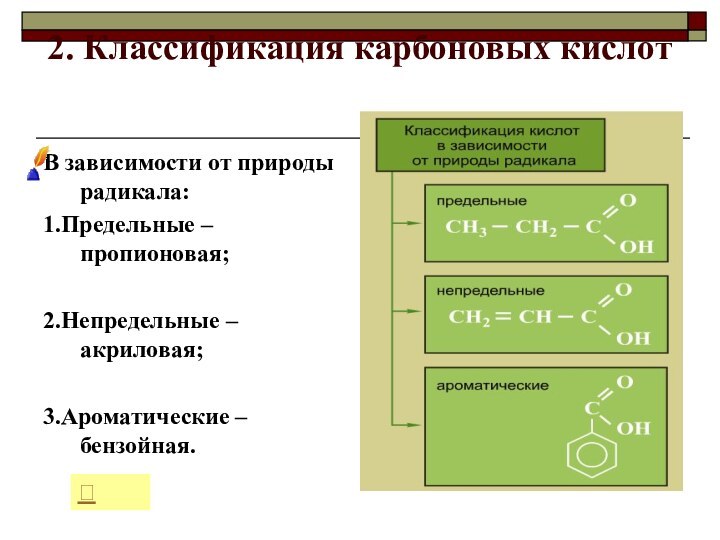
2. Классификация карбоновых кислот
В зависимости от природы радикала:
1.Предельные
– пропионовая;
2.Непредельные – акриловая;
3.Ароматические – бензойная.
Слайд 15
3. Природные источники
карбоновых кислот
Капроновая кислота
(в козьем
жире)
Пальмитиновая кислота
( в пальмовом дереве)
Слайд 19
7. Изомерия
Cтруктурная изомерия:
- изомерия скелета в углеводородном радикале
(начиная с C4)
О ОСН3 – СН2 – СН2 – С СН3 – СН – С
ОН СН3 ОН
бутановая кислота 2 – метилпропановая кислота
Слайд 20
7. Изомерия
межклассовая изомерия, начиная с C2 (сложные эфиры)
СН3 – С Н – С
ОН О - СН3
Уксусная кислота Метиловый эфир
уксусной кислоты
Слайд 21
8. Номенклатура
Для определения названия в соответствии с международной
номенклатурой придерживаются порядка:
1) Выделяют главную цепь.
2) Нумеруют цепь, начиная
с карбоксильной группы;3) Называют номер атома углерода, при котором находится радикал;
4) Называют радикал;
5) Называют углеродную цепь;
6) Добавляют суффикс - овая кислота
Слайд 23 Упражнение
(30 секунд) Назовите вещества
1) СН2 – СН2 – СООН
׀
СН3
2) СН3
׀
СН3 – С – СООН
׀
СН3
бутановая кислота
2,2 – диметилпропановая кислота
Слайд 24 Упражнение
(30 секунд) Назовите вещества
3) СН3 – СН – СООН
׀
СН3
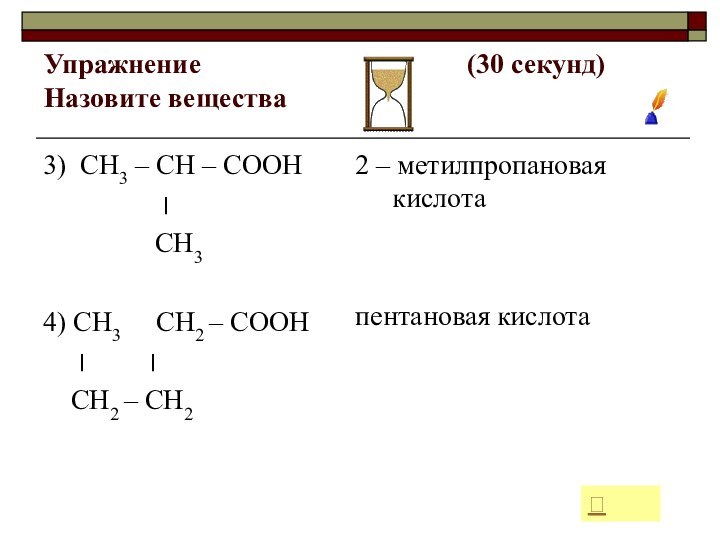
4) СН3 СН2 – СООН
׀ ׀
СН2 – СН2
2 – метилпропановая кислота
пентановая кислота
Слайд 25 Упражнение
(30 секунд) Назовите вещества
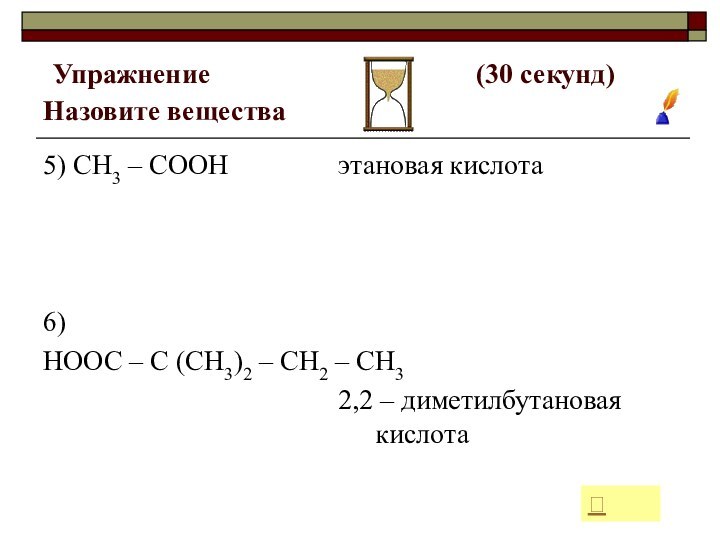
5) СН3 – СООН
6)
НООС – С (СН3)2 – СН2 – СН3
этановая кислота
2,2 – диметилбутановая кислота
Слайд 26
Домашнее задание
1. Для вещества №2 составить все возможные
изомеры и 1 гомолог.
2. Для вещества №6 составить все
возможные изомеры.3. Для вещества №3 составить 3 гомолога.
4. Выучить тривиальные названия кислот.
5. §20 стр. 175 – 178;
Слайд 27
Муравьиная кислота НССОН
Ее название указывает на источник,
из которого эта кислота впервые была выделена. Муравьиная кислота
открыта в кислых выделениях рыжих муравьев. Она является одним из компонентов яда, который выделяют жалящие муравьи, а также компонентом жгучей жидкости жалящих гусениц шелкопряда.В 1670 г. английский ботаник и зоолог Джон Рей провел необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел ее до кипения и пропустил через сосуд струю горячего пара. После конденсации пара получился водный раствор, обладавший сильнокислой реакцией. Это и был раствор муравьиной кислоты. В чистом виде муравьиную кислоту впервые получил в 1749 г. Андреас Сигизмунд Маргграф.
При попадании на кожу кислота не только жжет, но и буквально растворяет ее, оставляя долго не заживающие раны. Вот как вспоминал Карл Фогт – химик, работавший вместе с Либихом, – один случай. Входит Либих, у него в руках склянка с притертой пробкой. «Ну-ка, обнажите руку», – говорит он Фогту и влажной пробкой прикасается к руке. «Не правда ли, жжет? – невозмутимо спрашивает Либих. – Я только что добыл безводную муравьиную кислоту». После этого «эксперимента» у Фогта остался на всю жизнь белый шрам на руке. И неудивительно – впоследствии ученые открыли способность безводной муравьиной кислоты растворять даже капрон, найлон и другие полимеры, устойчивые к разбавленным растворам неорганических кислот и щелочей.
Слайд 28
Муравьиная кислота в природе
Муравьиная кислота служит насекомым своеобразным
«химическим оружием» для защиты и нападения. Ожог от
укусов муравьев очень напоминает ожог крапивой – ведь муравьиная кислота содержится и в тончайших волосках этого весьма распространенного растения. Вонзаясь при соприкосновении в кожу, они сразу же обламываются, а их содержимое болезненно обжигает. Муравьиная кислота также присутствует в пчелином яде, сосновой хвое, в небольших количествах найдена в различных фруктах, тканях, органах, выделениях животных и человека.
Слайд 29 Почему нельзя смачивать водой место муравьиного укуса или
ожога крапивой?
Это приводит только к усилению болевых ощущений. Почему
боль утихает, если пораненное место смочить нашатырным спиртом? Что еще можно использовать в данном случае?Поскольку муравьиная кислота – электролит, то при ее растворении в воде происходит процесс электролитической диссоциации:
НСООН = НСОО– + Н+.
В результате кислотность среды повышается, и процесс разъедания кожи усиливается. Чтобы боль утихла, нужно нейтрализовать кислоту, для чего необходимо использовать растворы, обладающие щелочной реакцией. А к ним как раз и относится нашатырный спирт – водный раствор аммиака, содержащий гидроксид аммония NH4ОН. При его взаимодействии с муравьиной кислотой происходит реакция нейтрализации:
НСООН + NН4ОН = НCOONH4 + H2O.
Для тех же целей вполне подойдет и водный раствор имеющейся в каждом доме питьевой соды – гидрокарбоната натрия NаНСО3:
Слайд 30
Уксусная кислота СН3СООН
Как вам известно, водный разбавленный раствор
этого вещества называется уксусом. Слово «уксус» происходит от греческого
слова «oxys», означающего «кислый». В древности уксус был единственной пищевой кислотой, получаемой при скисании виноградного вина, и это объясняет, что его название древними греками отождествлялось с самим представлением о кислом, кислоте.России уксус называли «кислой влажностью» или «древесной кислотой». Последнее название связано с получением уксусной кислоты при сухой перегонке древесины лиственных пород, прежде всего березы. В 1793 г. президент Российской академии наук Андрей Андреевич Нартов (сын механика – учителя Петра I) сообщил, что «кислая влажность из дровяных куч в уголь пережигаемых» может быть использована для травления меди и железа. Получение уксуса при сухой перегонке древесины описано в сочинениях Иоганна Глаубера и Роберта Бойля. Однако природа этого вещества вплоть до ХIХ в. оставалась неизвестной. Алхимики считали, что при брожении вина винный (по современной номенклатуре – этиловый) спирт превращается в уксус, принимая на себя частицы соли – винного камня. Еще в XVIII в. брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 г. Йенс Якоб Берцелиус определил состав уксусной кислоты, а в 1845 г. немецкий химик Адольф Вильгельм Герман Кольбе осуществил полный ее синтез из угля. Впервые в мире кристаллы уксусной кислоты получил в 1793 г. академик Петербургской академии наук Товий Егорович Ловиц. Он назвал их «ледяным уксусом», или «ледяной кислотой», и описал запах и вкус этих кристаллов так: «Запах расплавленного ледяного уксуса резкий, невыносимый для носа. Вкус очень кислый. Одна капля этого уксуса на языке вызывает боль, ощутимую в течение двадцати часов…»
Слайд 31
Это интересно…
Во времена Ловица химики кроме состава и
описания внешнего вида вещества устанавливали его запах и вкус.
Неудивительно, что ожоги слизистой оболочки носа и ротовой полости, отравления и другие травмы постоянно сопровождали работу химиков и делали ее очень опасной. В 1800 г. Ловиц нечаянно пролил концентрированную уксусную кислоту на стол. Собирая кислоту фильтровальной бумагой, ученый выжимал ее пальцами над стаканом. Вскоре он заметил, что пальцы потеряли чувствительность, побелели и распухли. Через несколько дней кожа на пальцах стала лопаться и отваливаться большими и толстыми кусками. Полученная травма навела Ловица на мысль использовать концентрированную уксусную кислоту для выведения мозолей. Еще одна опасность уксусной кислоты заключается в том, что вдыхание человеком ее паров может привести к отеку горла.
Слайд 32
Щавелевая кислота НООС-СООН
получена впервые в 1773 г. Совари
из кисличной соли (кислая щавелево-калиевая соль); Бергман получил ее
окислением сахара азотной кислотой и описал под именем сахарной кислоты; Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана.В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция.





























