в таблице Менделеева;
Изучить физические свойства железа;
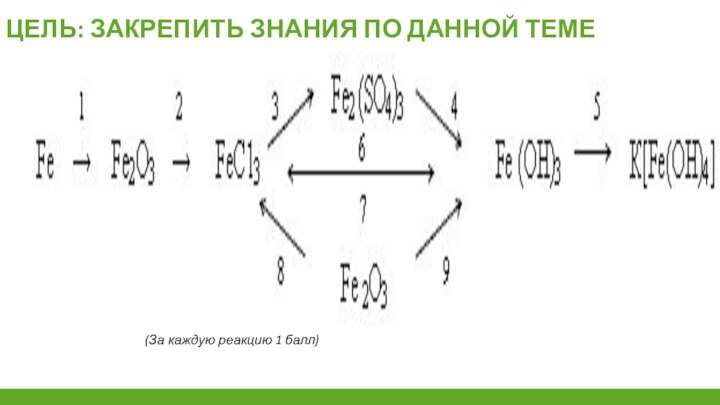
Изучить химические свойства и
применение железа;Изучить строение, свойства и применение соединений железа.













![Методическая разработка урока по химии по теме Железо и его соединения 14.Алгоритм ответовFeSO4 + 2NaOH=Fe(OH)2+Na2SO43FeSO4 + 2K3[Fe(CN)6] =Fe3[Fe(CN)6]2 +3K2SO4 FeCL3+ 3NaOH =Fe(OH)3+3NaCLFeCL3 + 2K4[Fe(CN)6] = Fe4[Fe(CN)6]3 +12KCLFeCL3+3KSCN=Fe(NCS)3 +3KCL](/img/tmb/11/1083154/7b7f25538436b4cad31386d69f981ff0-720x.jpg)