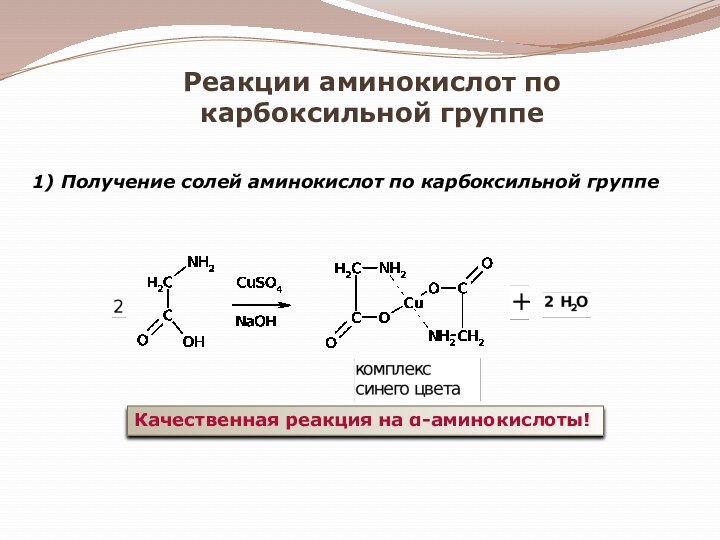
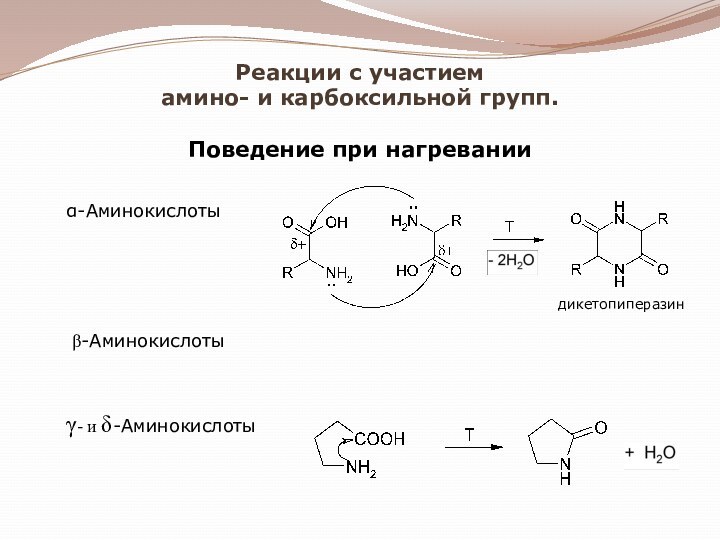
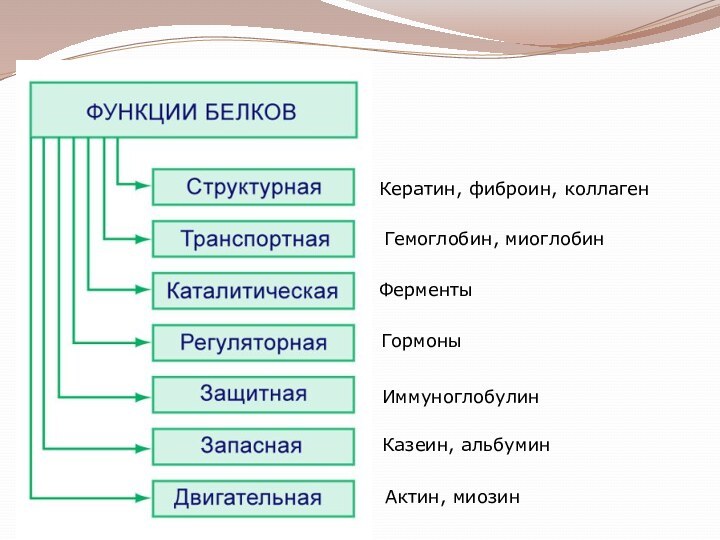
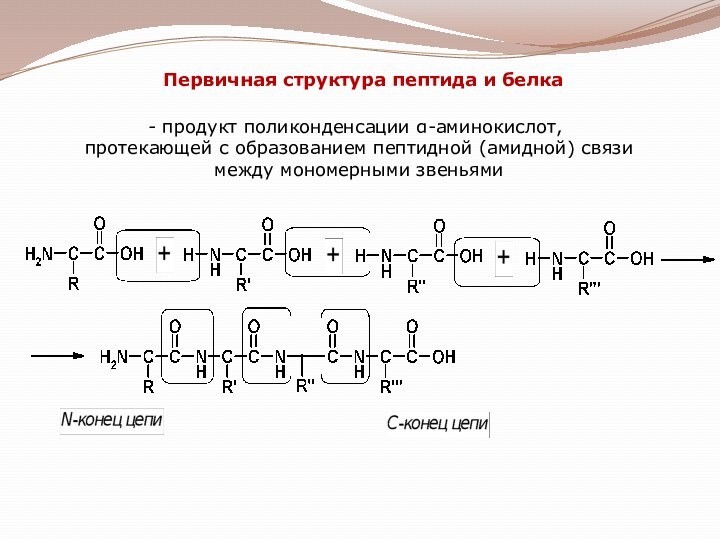
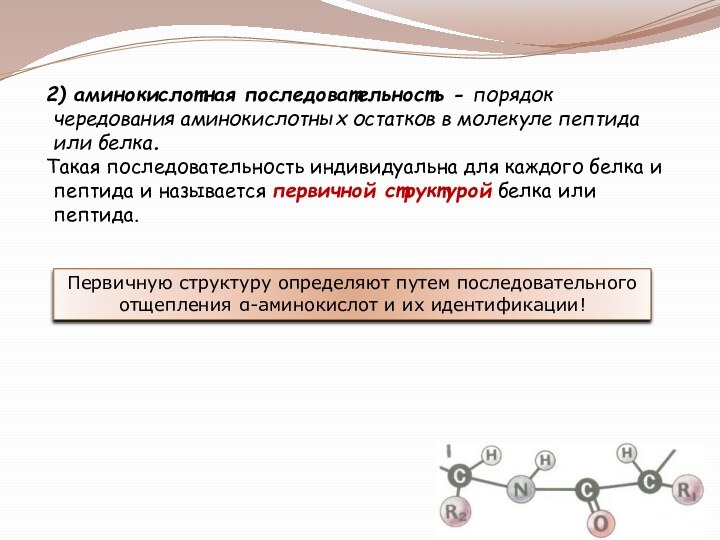
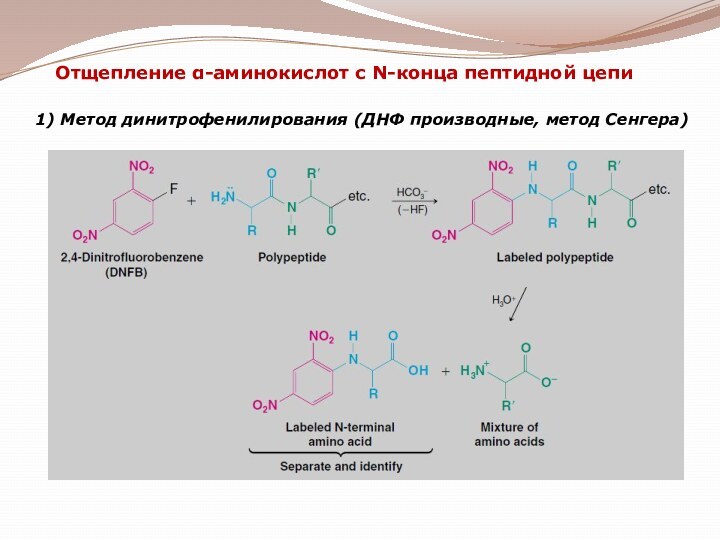
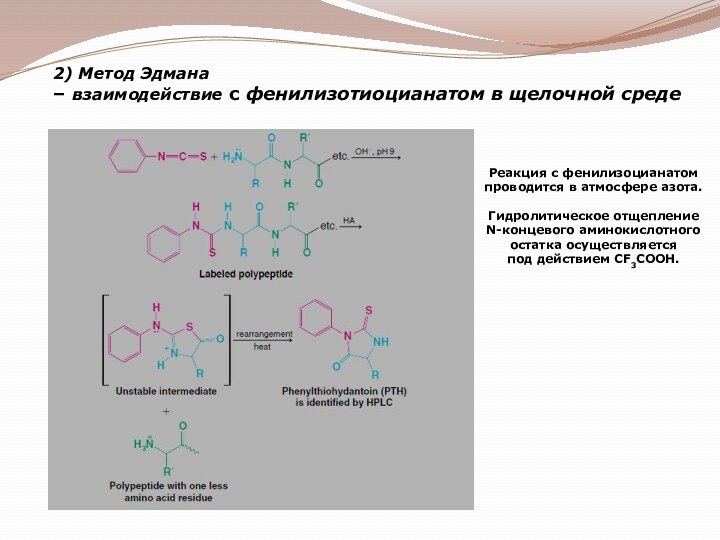
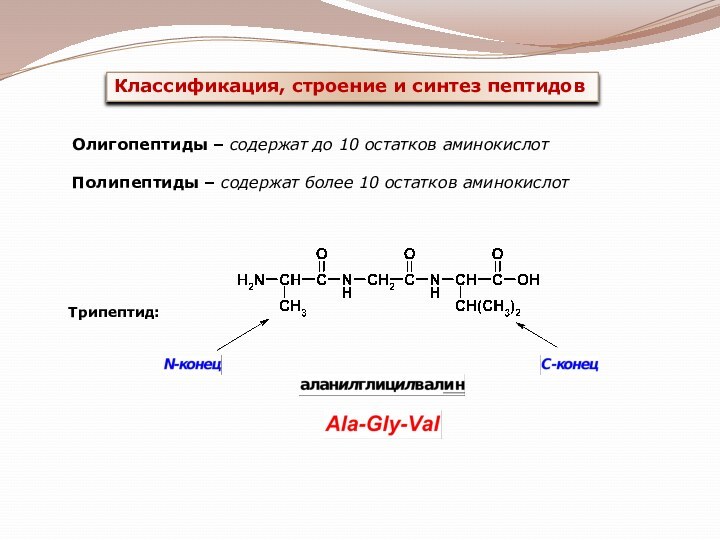
гетероциклические;
- по количеству карбоксильных групп – одно-, двукарбоновые;
- по
числу аминогрупп – моноамино-, диаминокарбоновые кислоты;по взаимному расположению амино- и карбоксильной группы - α, β, γ, δ-аминокислоты;
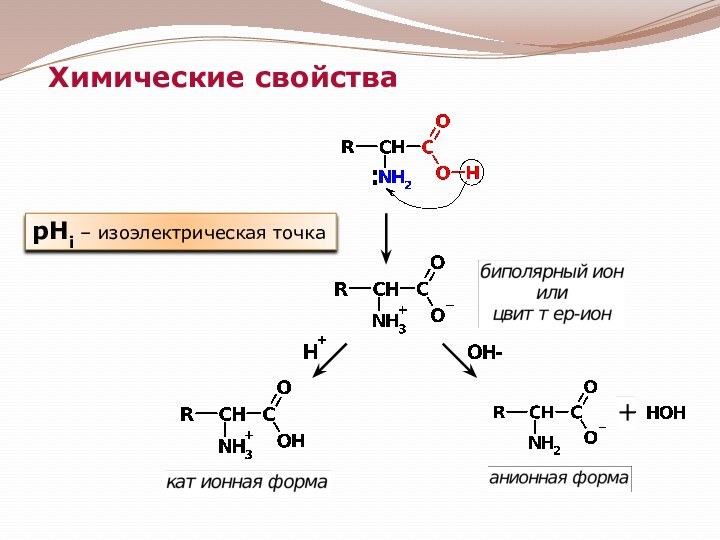
по значению изоэлектрической точки – кислые, нейтральные, основные.
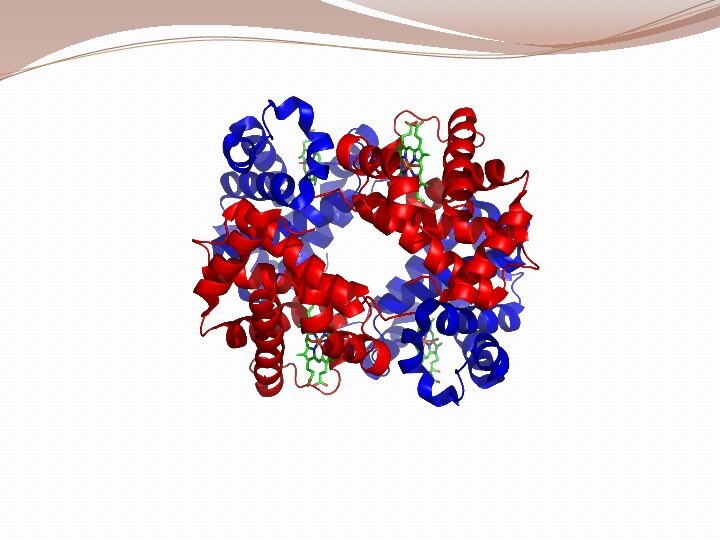
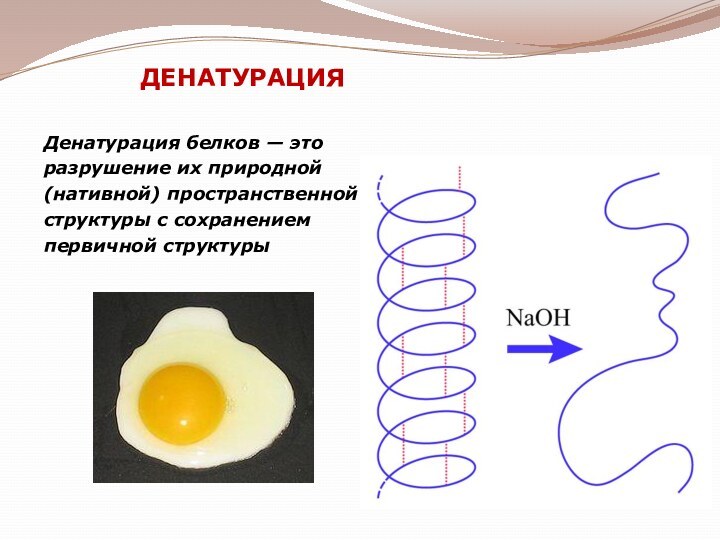
Классификация аминокислот