Слайд 2
Биотрансформация (био... и позднелат. transformatio — преображение), биохимическое превращение проникающих в организм чужеродных веществ (ксенобиотиков), в
результате чего образуются либо менее токсические вещества (обезвреживание, или
детоксикация), либо соединения более токсичные, чем исходное вещество.
Биотрансформация – комплекс физико-химических и биохимических превращений ксенобиотиков, в процессе которых образуются полярные водорастворимые вещества (метаболиты), легче выводимые из организма.
Биотрансформация – высокоспецифичные реакции, осуществляемые в организме как с естественными для них, так и с чужеродными веществами.
Слайд 3
Многие из органических соединений, не используемые на пластические
и энергетические нужды, по различным причинам попадают в живые
организмы, вызывая всевозможные последствия.
Химические вещества, не входящие в состав живых организмов, относят к чужеродным, или ксенобиотикам.
Прежде чем оказать положительное или отрицательное действие на организм, химическое вещество претерпевает ряд превращений, которые могут быть решающими в проявлении эффекта.
Ферментативное превращение большинства ксенобиотиков называют по аналогии с процессами классической биохимии метаболическим.
Слайд 4
Метаболизм, или биотрансформация ксенобиотиков — самостоятельный раздел биохимии.
Исследования в этой области имеют свою теоретическую базу и
технические приемы.
Развитие ксенобиохимии ведется по двум направлениям.
В задачу первого (статическая ксенобиохимия) входит установление структуры метаболитов ксенобиотиков, образующихся в организме, их распределение в органах и тканях, формы и способы выведения.
Это направление также исследует структуру образующихся в организме метаболитов из веществ, которые апробируются как лекарственные, проверяет их активность, токсичность, канцерогенность или мутагенность. Оно возникло в результате практической деятельности фармакологов и токсикологов.
Слайд 5
Для решения задач статической ксенобиохимии используются сложные и
многостадийные приемы физико-химических методов анализа.
Они направлены на извлечение
метаболитов из биологических жидкостей, их хроматографическое разделение, идентификация и количественное определение.
Слайд 6
Второе направление (динамическая ксенобиохимия) занимается вопросами механизмов реакций
метаболизма ксенобиотиков.
Наибольший объем информации о метаболических процессах дают
результаты изучения их кинетики, установления природы промежуточных и конечных продуктов биотрансформации.
Характер структурной избирательности, стереохимические изменения, сопровождающие реакцию, служат ценным критерием при установлении ее механизма..
Исследования структуры и каталитических свойств ферментов, их специфичность, локализация, кинетика помогают понять не только пути метаболизма ксенобиотиков, а и обмена эндогенных веществ..
Слайд 7
Биотрансформация осуществляется на всех уровнях организации живого: субклеточном,
клеточном, органно-тканевом, организменном, надорганизменных – биогеоценоз, биосфера.
Слайд 8
Значение исследований биотрансформации ксенобиотиков для биологии, химии, медицины.
Для биологии важны данные по биотрансформации веществ антропогенного происхождения
у микроорганизмов, растений и животных, так как органические соединения и их метаболиты могут передаваться по трофической цепи питания, что приводит к чрезмерной их аккумуляции.
Данные по адаптации организмов к условиям среды, зависящей от набора и мощности ферментов, метаболизирующих ксенобиотики, имеют первостепенное значение для экологии при проведении мероприятий по охране окружающей среды, разработке способов повышения резистентности организмов.
Слайд 9
В химии с успехом используются принципы метаболизма ксенобиотиков
и ферменты, принимающие участие в этих процессах, для синтеза
органических веществ.
В настоящее время известны ферментативные реакции превращения большинства классов органических соединений. Разрабатываются и используются модельные системы, имитирующие ферментативные процессы.
Специфичность и эффективность делают их более выгодными по сравнению с химическим синтезом.
Слайд 10
В медицине, ветеринарии создание новых лекарственных средств невозможно
без всестороннего знания механизмов их действия и биотрансформации (фармакокинетика
и фармакодинамика). Этим достигается безопасность лечения.
Активность ферментов, метаболизирующих лекарственные препараты при длительном их введении, определяют такие явления, как толерантность и привыкание.
В связи с изложенным особенно актуален система-тический анализ процессов метаболизма различных ксенобиотиков в филогенетическом и онтогенетическом аспектах, и метаболизма лекарственных веществ в органах и тканях человека и животных.
Слайд 11
В организм поступают:
жизненно необходимые соединения:
используются организмом для
синтеза полимеров (НК, белков, олиго- и полисахаридов, биорегуляторов и
др.),
служат источником энергии, требуемой для осуществления процессов жизнедеятельности.
В организме в процессе метаболизма образуются конечные продукты, одни из них удаляются из организма без изменений (СО₂), другие – (могут быть токсичными) подвергаются биотрансформации и, затем, удаляются.
Слайд 12
Ксенобиотики – чужеродные соединения не используются организмом.
Они могут выводится:
в неизменном виде,
подвергаться
модификации – биохимической трансформации (метаболизму ксенобиотиков), затем удаляться из организма.
Слайд 13
Таким образом, обезвреживанию подвергаются:
образующиеся в организме вещества
- (аммиак, пептидные и стероидные гормоны, катехоламины, продукты катаболизма
гема, продукты гниения аминокислот в кишечнике);
чужеродные соединения экзогенного происхождения, поступившие в организм.
Слайд 14
1.Чрескожное поступление:
а) через эпидермис;
б) через сальные и потовые
железы;
в) через волосяные фолликулы.
Для водорастворимых веществ кожа представляет практически
непреодолимый барьер.
Низкомолекулярные липидорастворимые и липофильные соединения могут поступать трансэпителиальным путем.
На процесс резорбции через кожу в наибольшей степени влияют физико-химические свойства ксенобиотика, прежде всего, его липофильность.
Слайд 15
Метаболизм некоторых ксенобиотиков осуществляется в эпидермальном слое.
Общая
активность процессов составляет 2 - 6 % по сравнению
с метаболической активностью печени.
Однако площадь кожных покровов большая, у взрослого человека составляет в среднем 1,6 м², у пятилетнего ребенка — 0,8 м. Поэтому метаболизм в коже вносит вклад в общие механизмы обезвреживания или проявления токсичности ксенобиотиков.
Слайд 16
При поступлении ксенобиотиков через кожу проявляется их высокая
токсичность даже в низких дозах.
Например, мыши, получающие 0,3
мкг диоксина на килограмм массы при нанесении на кожу, поглощали 40 % апплицированной дозы. А мыши, получающие от 32 до 320 мкг диоксина на килограмм массы перорально, накапливали меньше 20 % дозы.
В отношении дермального действия чужеродных химических веществ в низких концентрациях важно учитывать длительность и частоту периодов воздействия.
Пример – поступление алюминия через кожу за счет использования дезодорантов в аэрозольных баллончиках из этого металла.
Слайд 17
2. Резорбция через слизистые оболочки.
Слизистые оболочки лишены
рогового слоя и жировой пленки.
Резорбция веществ через слизистые
оболочки определяется следующими факторами:
1) агрегатным состоянием вещества;
2) дозой и концентрацией ксенобиотика;
3) видом слизистой оболочки, её толщиной;
4) продолжительностью контакта;
5) интенсивностью кровоснабжения анатомической структуры.
Слайд 18
3. Пероральное поступление.
Основным механизмом поступления является пассивная диффузия
веществ через эпителий ЖКТ.
Некоторые ксенобиотики поступают в организм
при помощи активного транспорта.
Таким способом, например, проникают гликозиды, среди которых немало высокотоксичных веществ (амигдалин, дигитоксин, буфотоксин и др.).
Токсичные белки и пептиды – эндоцитозом.
Слайд 19
4. Ингаляционное поступление.
Кроме вдыхаемого кислорода в кровоток
через легкие могут легко проникать и другие вещества, находящиеся
в газообразном или парообразном состоянии.
Благоприятным условием всасывания веществ является большая площадь поверхности легких, составляющая, например, у взрослого человека в среднем 70 м², у четырехлетнего ребенка - 22 м².
Слайд 20
При ингаляции аэрозолей глубина проникновения в дыхательные пути
зависит от размера частиц.
Аэрозоли представляют собой фазовые смеси,
состоящие из воздуха и мелких частиц жидкости (туман) или твердого вещества (дым).
Обычно размеры частиц в аэрозоли колеблются от 0,5 до 15 мкм.
Чем выше концентрация в воздухе распыляемого вещества, тем крупнее частицы.
Слайд 21
Глубокому проникновению частиц в дыхательные пути препятствует их
седиментация на слизистые оболочки.
Крупные частицы накапливаются на слизистой
верхних отделов дыхательных путей, средние – в белее глубоких отделах, мельчайшие – могут достичь поверхности альвеол.
Слайд 22
Лекарственные препараты могут вводиться в организм и
другими способами (инъекционным, ректальным, вагинальным, нозальным, электрофоретическим, лазерофоретическим, с
помощью ультразвука и др.)
Слайд 23
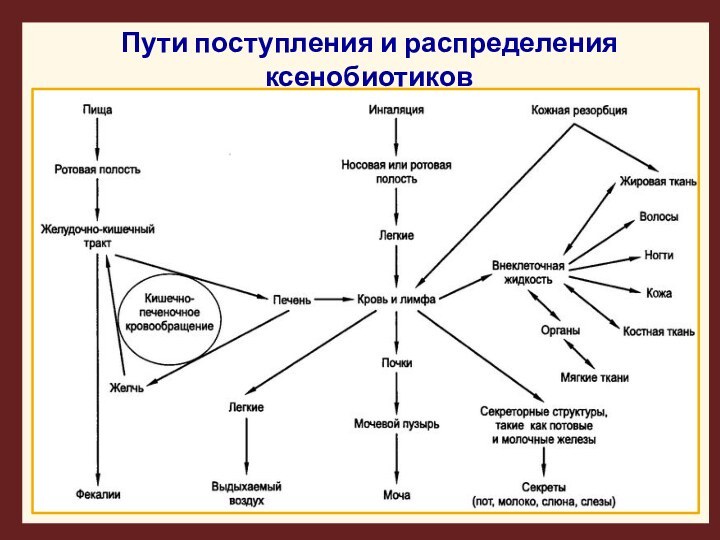
Пути поступления и распределения ксенобиотиков
Слайд 24
После резорбции в кровь вещества в соответствии с
градиентом концентрации распределяются по всем органам и тканям.
Распределение
неравномерное.
Некоторые избирательно накапливаются в том или ином органе, ткани, клетках определенного типа.
Различные ксенбиотики могут образовывать с биомолекулами ковалентные связи и таким образом накапливаться в тканях, приводить к мутациям, например, афлатоксины.
Слайд 25
Например: свинец, стронций – остеотропны и депонируются, в
основном, в костях.
Мышьяк вследствие высокого сродства к кератину
депонируется в ногтях.
Многие ксенобиотики жирорастворимы и могут накапливаться в биологических мембранах клеток органов и тканей, в жировых депо, например, полициклические ароматические углеводороды, пестициды, некоторые хлорорганические вещества.
Слайд 26
Поступившие в кровь ксенобиотики транспортируются в свободной
и связанной форме.
Способностью связывать ксенобиотики обладают альбумины, гликопротеины (кислый
α₁-гликопротеин) и липопротеины плазмы крови.
Слайд 27
Альбумины – основные белки плазмы крови, связывающие различные
гидрофобные вещества. Они могут функционировать в качестве белков-переносчиков билирубина,
ксенобиотиков, лекарственных веществ.
α₁-Гликопротеин – является индуцируемым белком, связывая ксенобиотики, он их инактивирует и переносит в печень, где комплекс с белком распадается, чужеродные вещества обезвреживаются и выводятся из организма.
Слайд 28
В основе связывания ксенобиотиков с белками лежит
образование между ними слабых гидрофобных, водородных и ионных связей,
реже ковалентные.
Связанные соединения приобретают характеристики распределения, свойственные белкам. Сильные связи белок – ксенобиотик затрудняют отток вещества в ткани.
Слайд 29
Кровь обеспечивает снижение токсичности поступивших в нее веществ.
Пассивное обезвреживание:
за счет разведения токсичных веществ,
за
счет связывания с белками плазмы и др., что снижает возможность проникновения в ткани и облегчает выведение из организма.
Слайд 30
Некоторые вещества могут надолго задерживаться в крови.
Например,
положительно заряженные ксенобиотики способны адсорбироваться на отрицательно заряженной мембране
эритроцитов, находиться на мембране вплоть до конца жизни эритроцита, изменять ее свойства.
Липофильные вещества проникают через эритроцитарную мембрану и взаимодействуют с гемоглобином.
Связавшийся с гемоглобином ксенобиотик не всегда диффундирует из клетки, а может длительно циркулировать в крови.
Слайд 31
2. Активное обезвреживание:
с помощью ферментов плазмы и клеток
крови (путем микросомального окисления и образования конъюгатов; работы аминооксидаз,
алкогольдегидрогеназы, холинэстеразы и др.).
Слайд 32
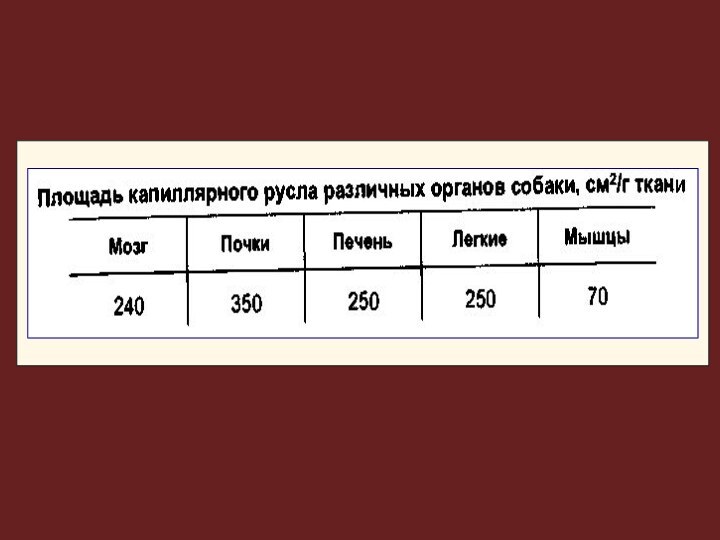
Поступление и накопление ксенобиотика в ткани зависит от:
кровоснабжения и массы органа,
особенностей организации эндотелия капиллярного русла
(например, гемато-энцефалического, плацентарного барьеров).
Слайд 33
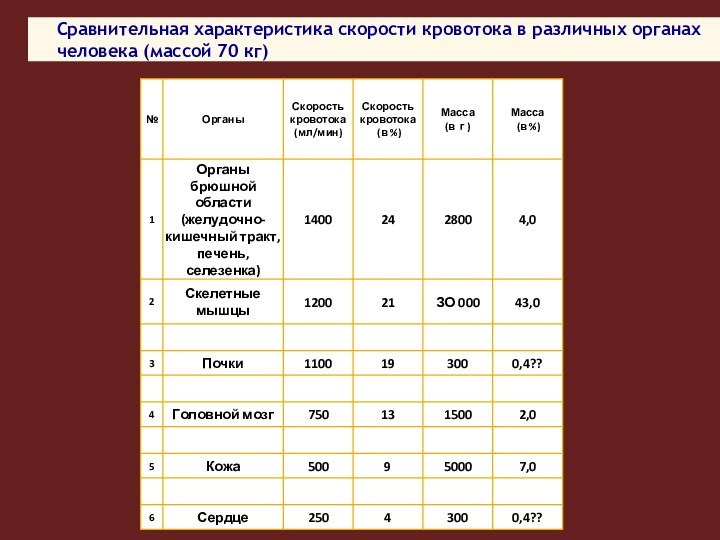
Сравнительная характеристика скорости кровотока в различных органах человека
(массой 70 кг)
Слайд 35
Важным элементом распределения в организме некоторых ксенобиотиков является
депонирование – накопление и длительное сохранение химического вещества в
относительно высокой концентрации в одном или нескольких органах (или тканях).
Депонирование может сопровождаться или не сопровождаться повреждением биологически значимых молекул-мишеней (т.о. токсический процесс или формируется, или не формируется).
Слайд 36
Ряд ксенобиотиков депонируются в тканях настолько прочно, что
выведение их из организма существенно затруднено или практически невозможно.
Например, период полуэлиминации кадмия из организма человека составляет 15-20 лет и более.
Слайд 37
ОБЕЗВРЕЖИВАНИЕ ЭНДОГЕННЫХ ТОКСИЧЕСКИХ И БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
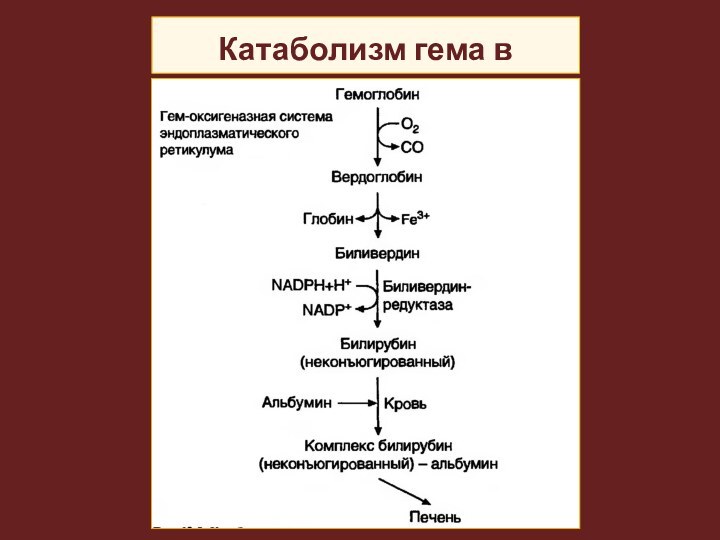
Катаболизм
гема
В клетках селезенки, костного мозга
и печени происходит распад гемоглобина при участии ферментов гемоксигеназной системы.
Образовавшийся из гема билирубин (непрямой или неконъюгированный), не дающий прямой реакции с диазореактивом, поступает в кровь и транспортируется в комплексе с альбуминами.
Концентрация билирубина в крови человека в норме 1,7-17 мкмоль/л.
Затем непрямой билирубин путем облегченной диффузии переносится в гепатоциты.
В ЭПР печени под действием УДФ-глюкуронилтрансферазы образуется конъюгированный (прямой) билирубин.
Слайд 39
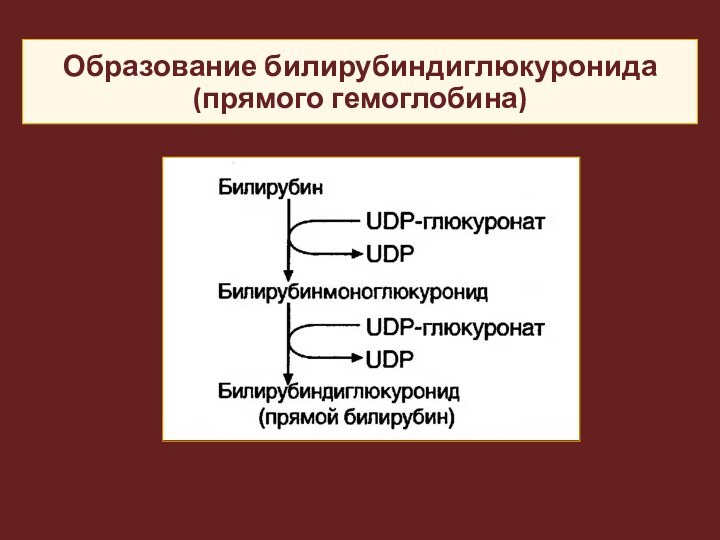
Образование билирубиндиглюкуронида (прямого гемоглобина)
Слайд 40
Из печени в составе желчи прямой билирубин секретируется
в двенадцатиперстную кишку и далее в толстый кишечник.
Там
под действием гидролаз бактерий происходит его деконъюгация на глюкуроновую кислоту и непрямой билирубин, последний при участии бактерий превращается в уробилиноген.
Образованные продукты в основном выводятся с калом, небольшая часть – с мочой.
Слайд 41
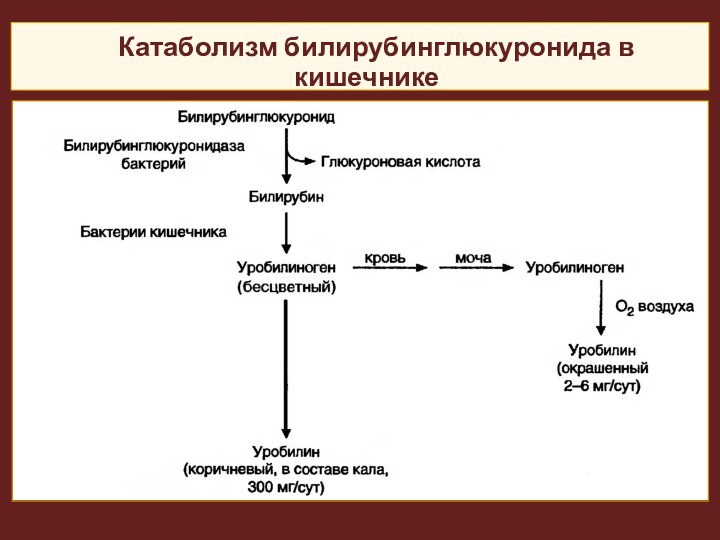
Катаболизм билирубинглюкуронида в кишечнике
Слайд 42
Обезвреживание аммиака
В сутки подвергается распаду 70 г аминокислот,
при этом освобождается NH₃. Норма NH₃ в крови не
превышает 60 мкмоль/л (3 ммоль/л – летальна).
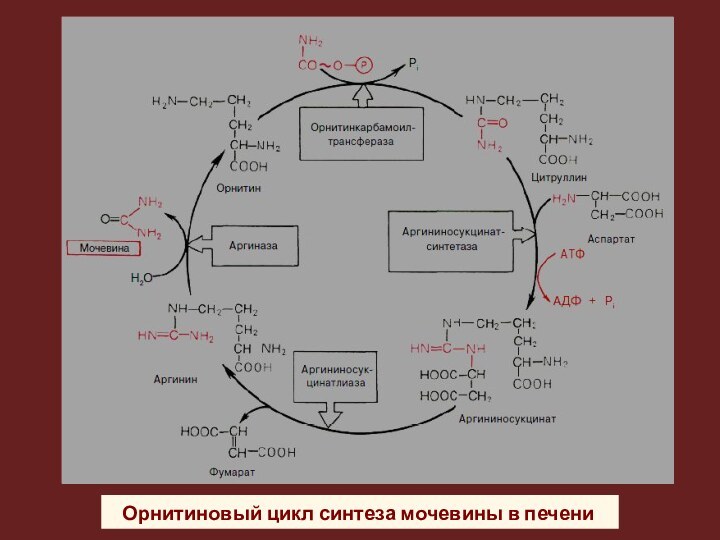
Механизм обезвреживания NH₃ (биосинтез мочевины в орнитиновом цикле) происходит в основном в печени.
На образование 1 моль мочевины расходуется 4 эквивалента АТФ).
Слайд 43
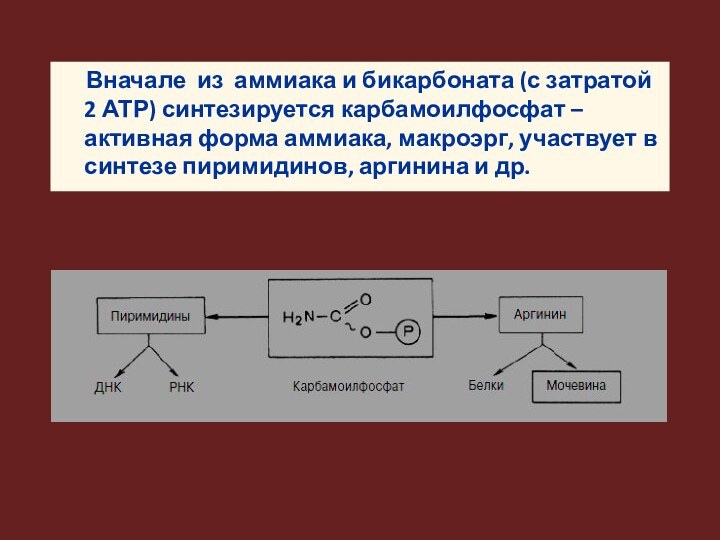
Вначале из аммиака и бикарбоната (с затратой 2
АТР) синтезируется карбамоилфосфат – активная форма аммиака, макроэрг, участвует
в синтезе пиримидинов, аргинина и др.
Слайд 44
Орнитиновый цикл синтеза мочевины в печени
Слайд 45
Орнитиновый цикл мочевинообразования поддерживает концентрацию аммиака на стационарном
уровне и удаляет метаболический бикарбонат.
При синтезе 1 моля мочевины
выводится 2 моль НСО₃⁻. Один ион НСО₃⁻ включается в молекулу мочевины, другой –протонируется с образованием СО₂.
Слайд 46
Обезвреживание гормонов
Гормоны после выполнения своих функций в организме
инактивируются в печени.
Стероидные гормоны:
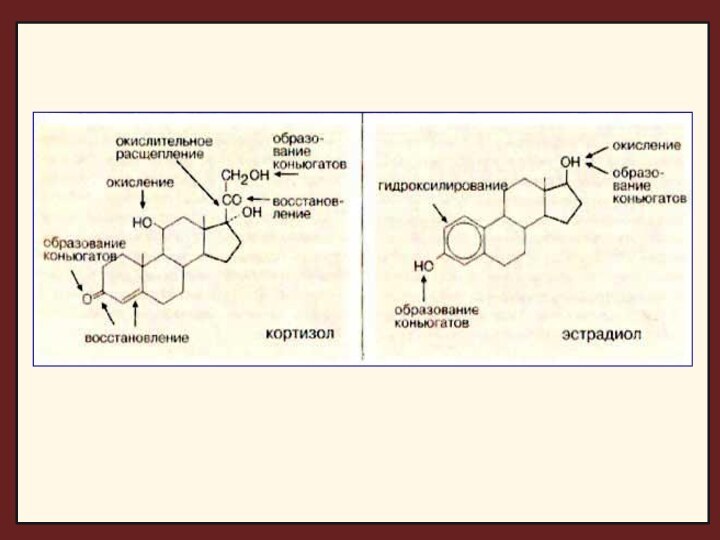
Молекулы стероидных гормонов подвергаются
восстановлению или гидроксилированию (цит. Р-450), а затем переводятся в конъюгаты. Восстановление идет по оксогруппе и двойной связи кольца А. Биосинтез конъюгатов заключается в образовании сернокислых эфиров или глюкуронидов и приводит к водорастворимым соединениям.
При инактивации стероидных гормонов образуются разнообразные производные с существенно более низкой гормональной активностью. Основные метаболиты – 17-кетостероиды (17-КС). Организм млекопитающих лишен способности разрушать углеродный скелет молекул стероидов.
17-КС выводятся из организма с мочой и частично с желчью. Содержание стероидов в моче используется в качестве критерия при изучении их метаболизма.
Слайд 48
17-КС – конечные продукты обмена гормонов коры надпочечников
и половых гормонов.
17-КС в зависимости от структуры окисляемого
гормона отличаются наличием или отсутствием функциональных групп у 11-го атома углерода, либо ароматичной структурой кольца А.
Слайд 49
У женщин источником основной массы 17-КС, удаляющихся с
мочой, является кора надпочечников.
У мужчин источником около 1/3
общего количества экскретирующихся с мочой 17-КС являются половые железы.
До 10 % 17-КС образуются из глюкокортикоидов коры надпочечников.
Количественно основным андрогеном надпочечников в плазме крови является дегидроэпиандростерон, действующий, в основном, как прогормон. На периферии он преобразуется в тестостерон, эстрогены, андростендион и андростендиол.
Слайд 50
Уровень андрогенов в плазме значительно варьирует, они секретируются
эпизодически, секреция зависит от циркадных ритмов.
Исключением является дегидроэпиандростерон-сульфат.
Его уровень достаточно точно отражает продукцию этого гормона.
Слайд 51
Обезвреживание катехоламинов
Только 5 % адреналина непосредственно удаляется с
мочой (у человека), остальной подвергается распаду.
В органах катехоламины
вступают в соединение с различными белками, образуя комплексные соединения. Образование комплексов имеет большое значение в стабилизации и временной инактивации гормона.
К числу наиболее вероятных путей ферментативных изменений структуры катехоламинов относятся хиноидное окисление, окислительное дезаминирование, метилирование.
Хиноидное окисление , вероятно, осуществляется катехолоксидазой, цитохромоксидазой, в результате образуются вещества индольной структуры типа адренолютина и аденохрома Эти продукты обладают выраженной биологической активностью.
В моче здорового человека продукты хиноидного окисления почти не обнаруживаются.
Слайд 52
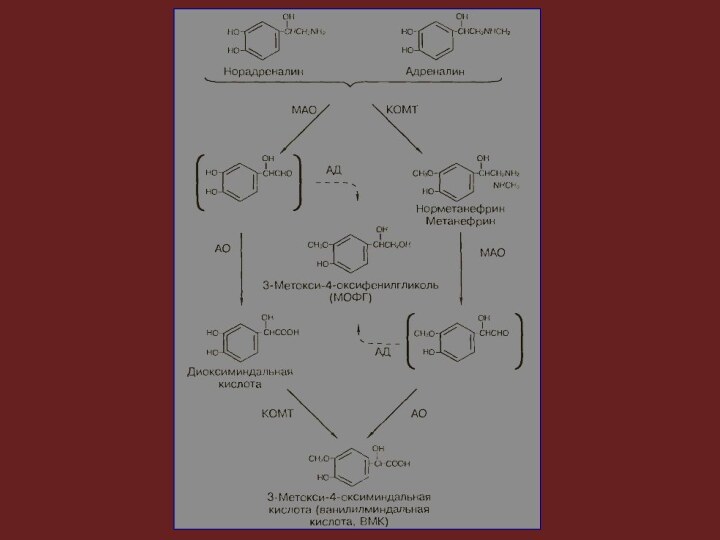
Распад протекает, главным образом, под влиянием двух ферментных
систем: катехол-О-метилтрансферазы (КОМТ) и моноаминоксидазы (МАО).
Под действием КОМТ
в присутствии донора метиловых групп S-адренозилметионина катехоламины превращаются в норметанефрин и метанефрин (З-О-метил-производные норадреналина и адреналина), которые под влиянием МАО переходят в альдегиды, и далее (в присутствии альдегидоксидазы) в ванилилминдальную кислоту (ВМК) — основной продукт распада норадреналина и адреналина.
Слайд 53
Если катехоламины вначале подвергаются действию МАО, а не
КОМТ, они превращаются в 3,4-диоксиминдалевый альдегид, а затем под
влиянием альдегидоксидазы и КОМТ — в 3,4-диоксиминдальную кислоту и ВМК.
В присутствии алкогольдегидрогеназы из катехоламинов может образовываться З-метокси-4-оксифенилгликоль, являющийся основным конечным продуктом деградации адреналина и норадреналина в ЦНС.