- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ДИОКСИД СЕРЫ
Содержание
- 2. Основные свойстваДиоксид серы, SO2, (Окси́д се́ры (IV),
- 3. Воздействие на окружающую среду Участвует в образовании
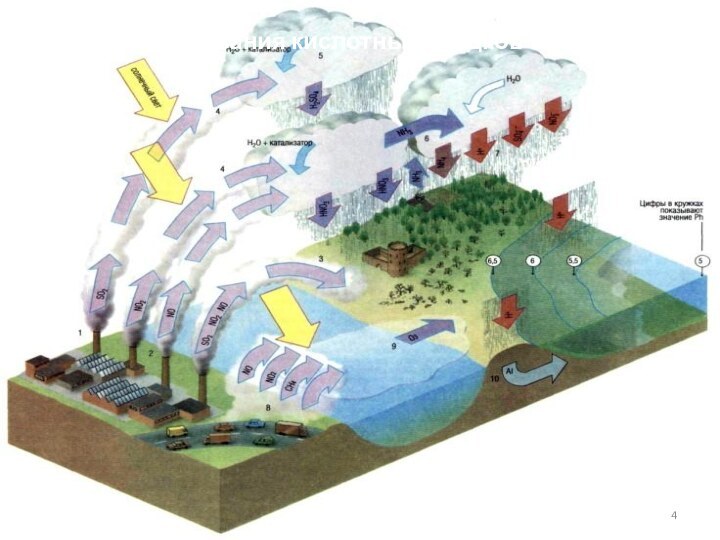
- 4. Схема образования кислотных осадков
- 5. Продолжительность жизни» самого сернистого газа в атмосфере
- 6. Токсическое действие Люди по-разному реагируют на двуокись
- 7. Токсическое действиеВывод: Токсическое действие двуокиси серы
- 8. Диоксид серы в атмосфере Попадает в
- 9. SО2 получают сжиганием серы, а также как побочный продукт обжига медных
- 10. Пирометаллургические предприятия цветной и чёрной
- 11. Основные методы очистки газов от диоксида серы:АммиачныйАммиачно-сернокислотныйАммиачно-циклическийИзвестковыйМагнезитовыйМарганцевыйСорбционный
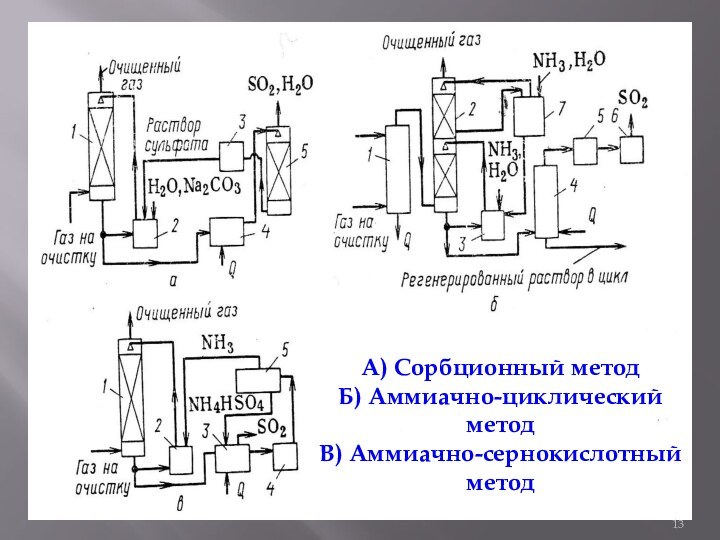
- 12. Аммиачный метод Процесс очистки газов от
- 13. А) Сорбционный методБ) Аммиачно-циклический методВ) Аммиачно-сернокислотный метод
- 14. Вывод: Преимущества: Так как при
- 15. Абсорбционный метод Очистка газовых выбросов проходит
- 16. Вода, водные растворы: Na2SO3 (18-25%-ные), NH4OH (5-15%-ные),
- 17. Преимущества: Достоинство метода абсорбции заключается в непрерывности ведения
- 18. Абсорбция водой Абсорбция водой диоксида серы
- 19. В Норвегии разработан процесс «Flakt-Hydro», в котором
- 20. Схемы установки абсорбции диоксида серы: а –
- 21. Газы сначала очищают от золы
- 22. Адсорбционный метод При адсорбционных методах газы
- 23. Основные адсорбенты:При адсорбции газов, содержащих SO2, применяютактивированные угли, полукоксы, активированный силикагель,карбонат кальция,активированный MnO2.
- 24. Вывод:Преимущества: Достоинствами этого процесса являются высокая степень
- 25. ХемосорбцияМетод хемосорбции основан на поглощении газов и
- 26. Основными хемосорбентами являются:Оксиды металлов (Al, Bi, Ce,
- 27. Оксидно-марганцевая очисткаПо этому методу горячие дымовые газы
- 28. 1 – адсорбер; 2 – циклон; 3
- 29. Вывод: Преимущества
- 30. Каталитический методКаталитический метод предназначен для превращения вредных
- 31. Основные катализаторы: В качестве катализаторов используют
- 32. Скачать презентацию
- 33. Похожие презентации
Основные свойстваДиоксид серы, SO2, (Окси́д се́ры (IV), серни́стый газ, серни́стый ангидри́д) , Бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г





























Слайд 3
Воздействие на окружающую среду
Участвует в образовании кислотных
осадков, что в свою очередь
приводит к повышению кислотности почв и водоемов.Негативно влияет на растительный покров
Слайд 5 Продолжительность жизни» самого сернистого газа в атмосфере сравнительно
невелика (от двух-трех недель, если воздух сравнительно сухой и
чистый, до нескольких часов, если воздух влажен и в нем присутствует аммиак или некоторые другие примеси). Он, растворяясь в каплях атмосферной влаги, в результате каталитических, фотохимических и других реакций окисляется и образует раствор серной кислоты. Агрессивность выбросов еще более возрастает. В конечном счете переносимые воздушными массами сернистые соединения переходят в форму сульфатов. Их перенос в основном происходит на высоте от 750 до1500 м, где средние скорости близки к 10 м/с, и дальность переноса сернистого газа простирается до 300—400 км. На этом же удалении от источника выбросов в струе переноса отмечается максимум концентрации раствора серной кислоты. Ее обнаруживают и на расстоянии до 1000—1500 км, где в основном завершается ее переход в форму сульфатов.
Слайд 6
Токсическое действие
Люди по-разному реагируют на двуокись серы. Некоторые
безболезненно переносят до 4 г сульфита в день (т.е.
примерно 50 мг на 1 кг массы тела), а другие уже после приема очень малых количеств жалуются на головные боли, тошноту, понос или ощущение тяжести в желудке. Связанная сернистая кислота действует на организм, в принципе, так же, как и свободная. Различие заключается лишь в силе и быстроте реакции, что объясняется разной кинетикой.Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации —удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
Слайд 7
Токсическое действие
Вывод:
Токсическое действие двуокиси серы на
человека весьма многообразно. В первую очередь оно связано с
раздражением верхних дыхательных путей, что при длительном воздействии даже малых концентраций приводит к возникновению бронхитов и других заболеваний органов дыхания, к снижению иммунобиологической реактивности организма. Неблагоприятное действие сернистого ангидрида может усиливаться при воздействии многих других вредных веществ, например окиси углерода и окислов азота. ПДК м.р. 0,5 мг/м3, ПДК р.з. 10,0 мг/м3
Слайд 8
Диоксид серы в атмосфере
Попадает в атмосферу
при сжигании серосодержащих видов топлива ( в первую очередь
угля и тяжелых фракций нефти),природного газа, а также при выплавке цветных металлов и производстве серной кислоты.Слайд 9 SО2 получают сжиганием серы, а также как побочный продукт обжига медных и
цинковых сульфидных руд. Основной промышленный способ получения SО2 -из
железного колчедана FeS2. Горячий обжиговый газ, полученный при сжигании FeS2(4FeS2 + 11O2 = 2Fe2O3 + 8SO2),
после отделения пыли обрабатывают слабой холодной H2SO4; при этом примеси (As2O3, SeO2 и др.) образуют туман, их отделяют в электрофильтрах; затем SО2 сушат.
Слайд 10 Пирометаллургические предприятия цветной и чёрной металлургии,
а также ТЭС ежегодно выбрасывают в атмосферу десятки миллионов
тонн серного ангидрида. Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, зарубежной Европы, европейской части России, Украины. В южном полушарии оно ниже.
Слайд 11
Основные методы очистки газов от диоксида серы:
Аммиачный
Аммиачно-сернокислотный
Аммиачно-циклический
Известковый
Магнезитовый
Марганцевый
Сорбционный
Слайд 12
Аммиачный метод
Процесс очистки газов от SO2
аммиачным методом заключается в промывке газа аммиачной водой. При
этом протекает реакцияSO2 + 2NH3 + H2O = (NH4) + 2SO3;
(NH4)2 SO3 + SO2 + H2O = 2 NH4 + HSO3.
В газовую смесь впрыскивают аммиак, который, взаимодействуя c кислыми веществами, образует соединения аммония. Собранная на электрофильтре твердая фаза направляется на регенерацию аммиака, благодаря чему расход аммиака в процессе невелик.
Слайд 14
Вывод:
Преимущества: Так как при взаимодействии
сернистого газа с аммиачной водой получаются аммиачные соли, используемые
как удобрение в сельском хозяйстве, аммиачный метод очистки газов от SO2 перспективен. Позволяет одновременно с очисткой газов от SO2 получать сульфит и бисульфит аммония, которые используются, как товарные продукты либо разлагаются кислотой с образованием высококонцентрированной SO2 и соответствующей соли.Недостатки: Аммиачные методы относительно экономичны и эффективны, но недостаток их - безвозвратные потери дефицитного продукта - аммиака.
Слайд 15
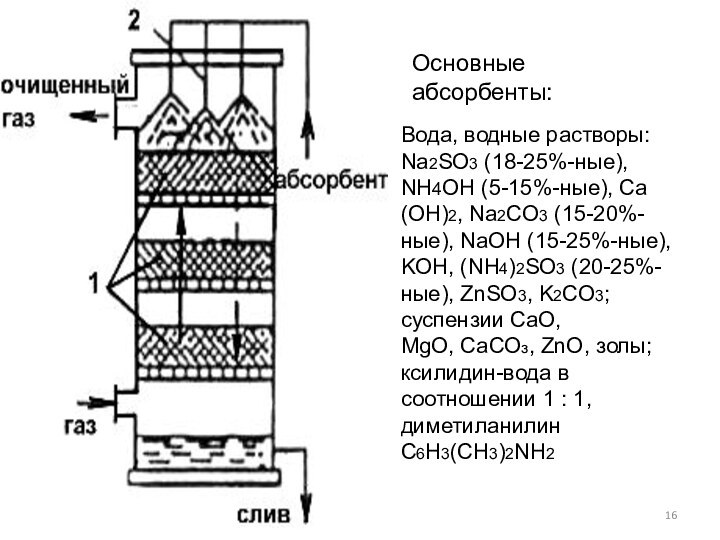
Абсорбционный метод
Очистка газовых выбросов проходит путем
разделения газовой смеси на составные части за счет поглощения
одной или нескольких вредных примесей (абсорбатов), содержащихся в этой смеси, жидким поглотителем (абсорбентом) с образованием раствора.Контакт очищаемых газов с абсорбентом осуществляется пропусканием газа через насадочную колонну, либо распылением поглощающей жидкости, либо барботажем через ее слой.
Слайд 16 Вода, водные растворы: Na2SO3 (18-25%-ные), NH4OH (5-15%-ные), Са(ОН)2,
Na2CO3 (15-20%- ные), NaOH (15-25%-ные), KОН, (NН4)2SО3 (20-25%-ные), ZnSO3,
K2СО3; суспензии CaO,MgO, СаСОз, ZnO, золы; ксилидин-вода в соотношении 1 : 1, диметиланилин C6H3(CH3)2NH2
Основные абсорбенты:
Слайд 17 Преимущества: Достоинство метода абсорбции заключается в непрерывности ведения технологического
процесса и экономичности очистки больших количеств газовых выбросов.
Недостатки: Недостаток —
громоздкость оборудования и необходимость создания систем жидкостного орошения. В процессе очистки газы подвергаются охлаждению, что снижает эффективность их рассеяния при отводе в атмосферу. В процессе работы абсорбционных аппаратов образуется большое количество отходов, состоящих из смеси пыли, поглощающей жидкости и вредных примесей, которые подлежат транспортировке и утилизации, что усложняет и удорожает процесс очистки.
Слайд 18
Абсорбция водой
Абсорбция водой диоксида серы сопровождается
реакцией
SO2 + Н2O → H+ + HSO3-
Растворимость
SO2 в воде мала. В связи с низкой растворимостью диоксида серы в воде для очистки требуется большой ее расход и абсорберы с большими объемами. Удаление SO2 из раствора ведут при нагревании его до 100 °С. Таким образом, проведение процесса связано с большими энергозатратами.Слайд 19 В Норвегии разработан процесс «Flakt-Hydro», в котором в
качестве поглотителя SO2 используют морскую воду, которая имеет слабощелочную
реакцию. За счет этого растворимость в ней SO2 возрастает.Слайд 20 Схемы установки абсорбции диоксида серы: а – морской водой:
1 – электрофильтр; 2, 3 – абсорберы; 4 –
подогреватель; 5 – реактор; б – суспензией известняка: 1 – абсорбер; 2 – сборник; 3 – вакуум-фильтр
Слайд 21
Газы сначала очищают от золы в
электрофильтрах или мультициклонах, а затем охлаждают в скруббере Вентури
водой. Абсорбцию SO2 проводят в полом скруббере, после которого газы нагревают теплом горячих топочных газов, частично отобранных после экономайзера. Сточные воды после скруббера и абсорбера обрабатывают воздухом для окисления сульфитных соединений в сульфатные и сбрасывают в море.
Слайд 22
Адсорбционный метод
При адсорбционных методах газы поглощаются твердыми пористыми
веществами. Поглощаемые молекулы газа удерживаются на поверхности твердых тел
за счет физической адсорбции (силы Ван-дер-Ваальса) либо химическими силами.Адсорбция рекомендуется для очистки газов с невысокой концентрацией вредных компонентов. Адсорбированные вещества удаляются из адсорбентов десорбцией инертным газом или паром. В некоторых случаях проводят термическую регенерацию.
Адсорбционную очистку газов проводят в аппаратах адсорберах периодического и непрерывного действия.
Слайд 23
Основные адсорбенты:
При адсорбции газов, содержащих SO2, применяют
активированные угли,
полукоксы,
активированный силикагель,
карбонат кальция,
активированный MnO2.
Слайд 24
Вывод:
Преимущества: Достоинствами этого процесса являются высокая степень очистки,
газы не охлаждаются, и отсутствуют жидкости.
Недостатки: Основной недостаток адсорбционного метода
заключается в большой энергоемкости стадий десорбции и последующего разделения, что значительно осложняет его применение для многокомпонентных смесей.
Слайд 25
Хемосорбция
Метод хемосорбции основан на поглощении газов и паров
твёрдыми или жидкими поглотителями с образованием малолетучих или малорастворимых
химических соединений.Большинство реакций хемосорбции являются экзотермическими и обратимыми.
Слайд 26
Основными хемосорбентами являются:
Оксиды металлов (Al, Bi, Ce, Co,
Cr, Cu, Fe, Hf, Mn, Ni, Sn, Th, Ti,
V, U, Zr).Ионообменные смолы
Кислотостойкие цеолиты (как природные так и искусственные)
Слайд 27
Оксидно-марганцевая очистка
По этому методу горячие дымовые газы (≈135°С)
обрабатывают оксидом марганца в виде порошка. В процессе контакта
оксида марганца с диоксидом серы и кислородом происходит реакцияMnOх • nH2O+SO2+((1— х)/2)О2 → MnSO4+nH2O,
где х=1,6—1,7.
Образующийся сульфат марганца после его выделения из газа обрабатывают в виде водной пульпы аммиаком с целью регенерации оксида марганца:
МnSО4+2NН3+(n+1)Н2О+(x—1)/2О2 → MnOх • nH2O +(NH4)2SO4.
Слайд 28 1 – адсорбер; 2 – циклон; 3 –
электрофильтр; 4 – дымовая труба; 5 – аммонийный скруббер;
6 – реактор; 7 – сепаратор; 8 – фильтр; 9 – кипятильник; 10 – кристаллиза¬тор; 11-центрифуга; 12 – циклон
Слайд 29
Вывод:
Преимущества
сухих методов очистки газов от SO2: возможность обработки газов
при повышенных температурах без увлажнения очищаемых потоков, что позволяет снизить коррозию аппаратуры, упрощает технологию газоочистки и сокращает капитальные затраты на нее. Наряду с этим они обычно предусматривают возможность цикличного использования поглотителя и (или) утилизацию продуктов процесса очистки газов.Недостатки: - значительные затраты на регенерацию; - необходимость выполнения реакционной аппаратуры из дорогостоящих материалов, так как процессы идут в условиях коррозионных и повышенных температурах.





























