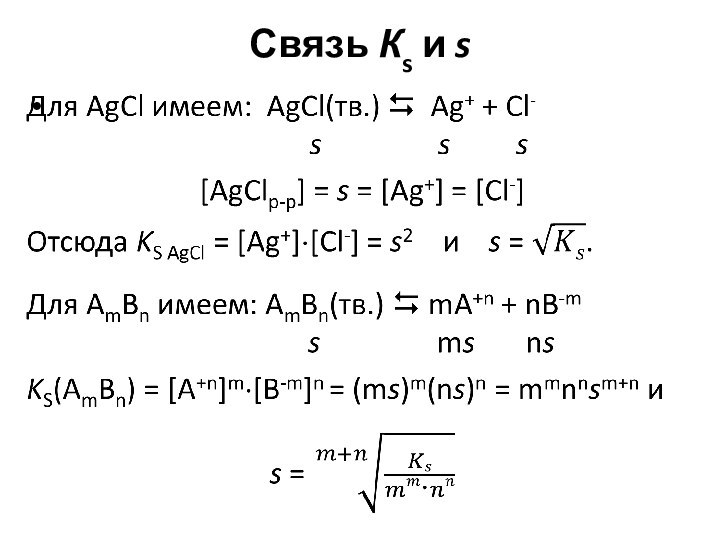Слайд 3
Растворимость малорастворимого вещества
Слайд 6
Эффект общего иона
Добавление общего иона уменьшает растворимость малорастворимых
соединений
Задача. Найти растворимость AgCl в 0,1 М растворе NaCl.
Решение.
AgCl ⇄ Ag+ + Cl-
s s s+0,1 0,1
Ks AgCl = [Ag+][Cl-] = s 0,1 = 1,610-10,
s = 1,610-9 моль/л.
Растворимость AgCl в воде (находили ранее) равна 1,3410-5 моль/л, растворимость AgCl в 0,1М NaCl равна 1,610-9 моль/л, т.е. в 104 раз меньше.
Слайд 7
Солевой эффект
Увеличение ионной силы раствора увеличивает растворимость малорастворимых
соединений
Поскольку концентрации ионов, образующихся при диссоциации малорастворимых соединений, то
оказывается возможным использовать в выражениях KS концентрации ионов, а не их активности. В тех случаях, когда в растворе присутствуют сильные электролиты, обусловливающие большую ионную силу раствора, необходимо в выражении для KS подставлять активность ионов.
Солевой эффект слабее, чем эффект общего иона.
Так учет солевого эффекта при расчете растворимости AgCl в 0,1М растворе NaCl увеличивает растворимость в 1,64 раза, что меньше, чем эффект общего иона, уменьшающий растворимость, как показано ранее, в ~10000 раз.
Слайд 8
Условие осаждения и растворения осадка
Для AgCl: AgCl
Ag+ + Cl- и KS = [Ag+][Cl-] имеем:
а) условие равновесия между осадком и раствором: [Ag+][Cl-] = KS
б) условие осаждения [Ag+][Cl-] > KS; в ходе осаждения концентрации ионов уменьшаются до установления равновесия
в) условие растворения осадка или существования ненасыщенного раствора записывается в виде [Ag+][Cl-] < KS; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия