- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гидролиз солей
Содержание
- 2. Вид урока: Проблемно-исследовательскийЦель урока: Сформировать у учащихся понятие гидролиза солей
- 3. 1) Развивать у учащихся умение пользоваться опорными
- 4. Оборудование:Таблицы сильных и слабых электролитов, компьютер, дискета с презентациями, видеофрагменты.
- 5. Ход урока:I этап урока – подготовка к изучению нового материала, актуализация знаний и опыта
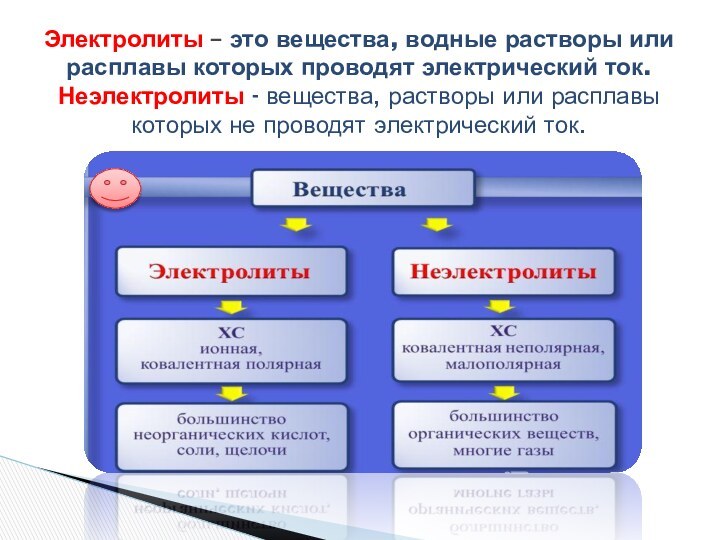
- 6. Какие вещества называются электролитами и неэлектролитами?
- 7. Электролиты – это вещества, водные растворы или
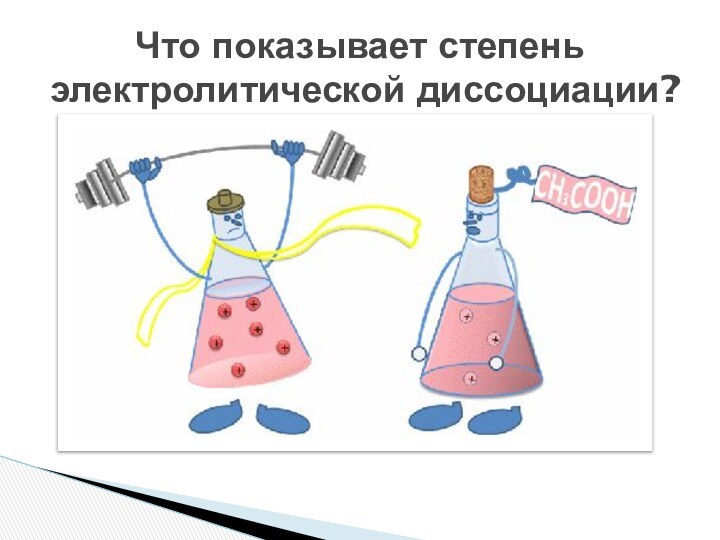
- 8. Что показывает степень электролитической диссоциации?
- 9. Степень электролитический диссоциации зависит от природы электролита
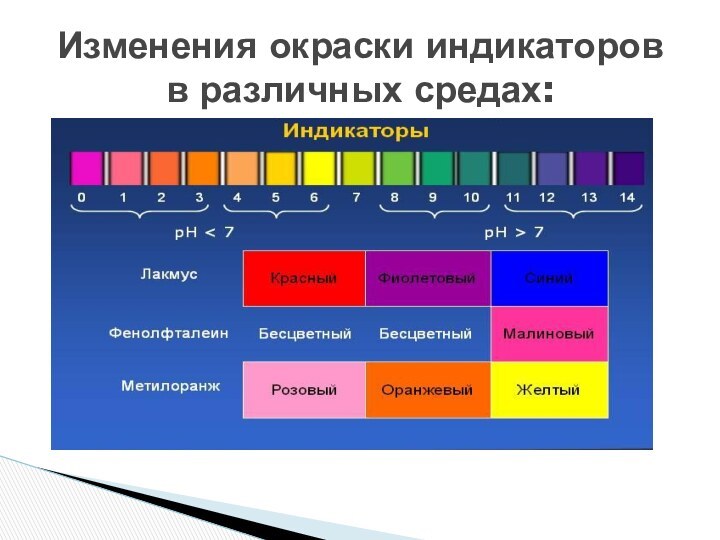
- 10. Как индикаторы изменяют свой цвет в кислой и щелочной среде? Какие вы знаете индикаторы?
- 11. Изменения окраски индикаторов в различных средах:
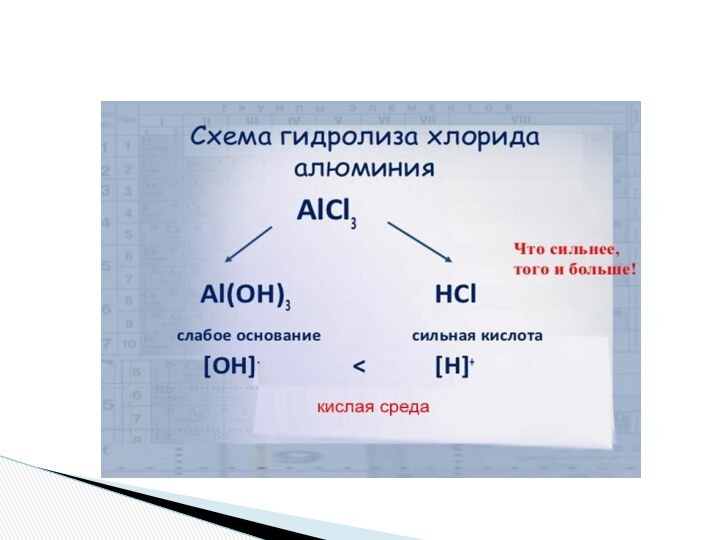
- 13. II этап урока – составление упрощенной схемы гидролиза солей по схеме.
- 18. Избыток ионов водорода дает кислую реакцию, поэтому лакмус краснеет
- 19. ОН+-Избыток гидроксид-ионов дает щелочную реакцию,поэтому лакмус синеет, а фенолфталеин становится малиновым
- 20. I вариант:Нитрата цинка;Сульфата калия;II вариант:Нитрат бария;Сульфид натрия.Закрепление:
- 21. Ответы:1)2)1)2)(среда нейтральная)I вариант:II вариант:
- 22. Скачать презентацию
- 23. Похожие презентации
Вид урока: Проблемно-исследовательскийЦель урока: Сформировать у учащихся понятие гидролиза солей

















Слайд 2
Вид урока: Проблемно-исследовательский
Цель урока: Сформировать у учащихся понятие
гидролиза солей
Слайд 3 1) Развивать у учащихся умение пользоваться опорными знаниями,
умение работать с таблицами, справочными материалами;
2) Развивать мышление, уметь
делать логические выводы из наблюдений по опыту. Научить составлять ионное уравнение реакции гидролиза солей по первой стадии;3) Сформировать понимание практического значения гидролиза в природе и жизни человека.
Задачи урока:
Слайд 4
Оборудование:
Таблицы сильных и слабых электролитов, компьютер, дискета с
презентациями, видеофрагменты.
Слайд 5
Ход урока:
I этап урока – подготовка к изучению
нового материала, актуализация знаний и опыта
Слайд 7 Электролиты – это вещества, водные растворы или расплавы
которых проводят электрический ток. Неэлектролиты - вещества, растворы или
расплавы которых не проводят электрический ток.Слайд 9 Степень электролитический диссоциации зависит от природы электролита и
растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся
на ионы (n) к общему числу молекул, введенных в раствор (N).
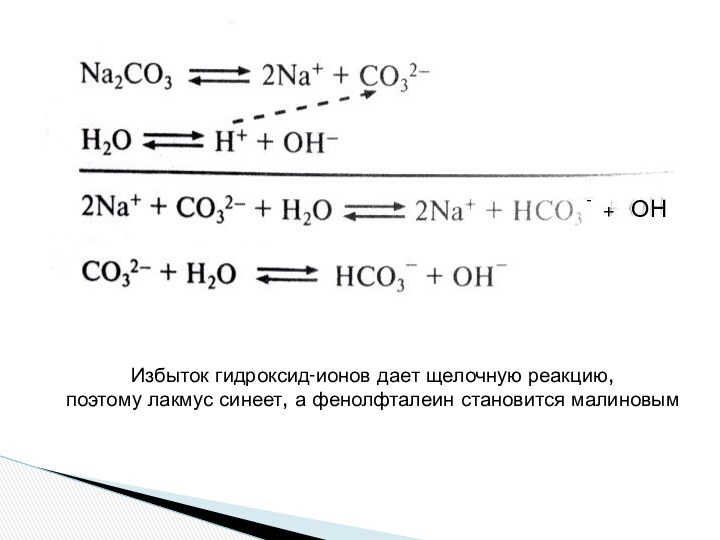
Слайд 19
ОН
+
-
Избыток гидроксид-ионов дает щелочную реакцию,
поэтому лакмус синеет, а
фенолфталеин становится малиновым
Слайд 20
I вариант:
Нитрата цинка;
Сульфата калия;
II вариант:
Нитрат бария;
Сульфид натрия.
Закрепление:
Какую реакцию
будут иметь водные растворы следующих солей:
Составьте упрощенную схему гидролиза
этих солей;Составьте ионное уравнение гидролиза этих солей.