- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Глава 3
Содержание
- 2. 3.1. Общая характеристика растворов
- 3. Растворы – это гомогенные системы, состоящие из
- 4. Истинные или молекулярные (ионные) растворы образуются самопроизвольно
- 5. В объёме раствора все термодинамические параметры постоянны,
- 6. Систему, состоящую из нескольких таких гомогенных фаз
- 7. Растворы – однородные смеси молекул, атомов или ионов, между компонентами которых возможны химические и физические взаимодействия:
- 8. сольватация – взаимодействие между молекулами растворителя и
- 9. Один из компонентов раствора называют растворителем (обозначают
- 10. Если же раствор получен растворением в жидкости
- 11. Концентрации
- 12. Относительное содержание компонентов в растворе называют концентрацией.Существуют следующие способы выражения концентрации:
- 13. Молярная (мольная) доля - xi - это
- 14. Молярная концентрация
- 15. Молярная концентрация Сi равна числу моль i-го
- 16. Моляльная концентрация (моляльность раствора)
- 17. моляльность раствора - mi – число моль
- 18. Массовые и объёмные доли (проценты):
- 19. Массовый процент компонента (wi) – число граммов
- 20. Растворы бывают твердые, жидкие и газообразные.
- 21. Считается, что газы всегда смешиваются неограниченно, поэтому
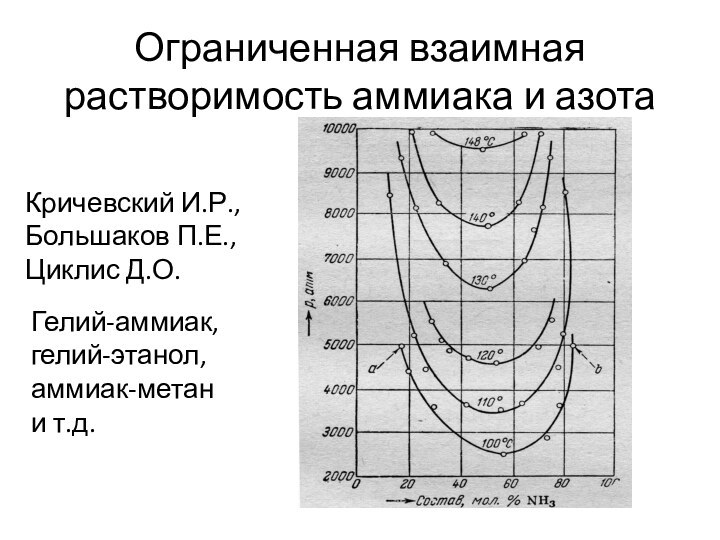
- 22. Ограниченная взаимная растворимость аммиака и азотаКричевский И.Р.,Большаков П.Е.,Циклис Д.О.Гелий-аммиак,гелий-этанол,аммиак-метани т.д.
- 23. Твердые растворы
- 24. Твердые растворы замещения (с ограниченной и неограниченной растворимостью компонентов).Твердые растворы внедренияТвердые растворы вычитания.
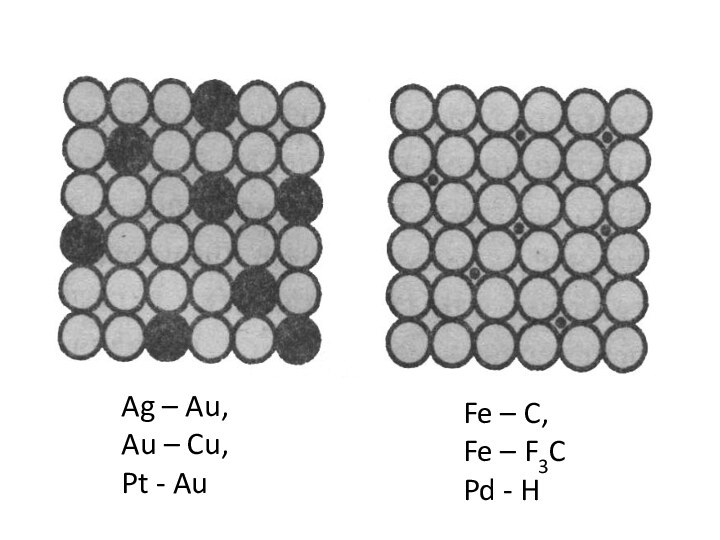
- 25. Ag – Au,Au – Cu,Pt - AuFe – C,Fe – F3CPd - H
- 27. Исторический экскурс в теорию растворов
- 28. История развития теории растворов – история «борьбы»
- 29. Представители же химической теории (Менделеев, Алексеев и
- 30. Почётный член АН СССР (1932), одновременно и
- 31. 3.3. Термодинамика образования растворов
- 32. Образование раствора из компонентов — процесс самопроизвольный,
- 33. Процесс растворения будет протекать самопроизвольно до тех
- 34. С точки зрения термодинамики раствор называется насыщенным,
- 35. Рассмотрим жидкий раствор, состоящий из растворителя А
- 36. Если раствор образуется из n1 моль А
- 37. Отнесем энергию Гиббса системы к одному молю раствора:где х1 и х2 — молярные доли.
- 38. Под молем раствора понимают такое количество раствора,
- 39. Если компоненты А и В смешать, то
- 40. Изменение энергии Гиббса при образовании 1 моля
- 41. Изменение энергии Гиббса при образовании раствораC изменением
- 42. Рассмотрим один из способов термодинамического описания процесса растворения
- 43. Уменьшение энергии Гиббса в процессе образования раствора делят на энтальпийный и энтропийный вклады:смG= смН TсмS
- 44. А сам процесс растворения представляют как сумму
- 45. Для каждого из этих этапов вычисляют изменение энтальпии и энтропии:ФПН и ФПSсН и сS
- 46. 1. ТД описание процесса растворения твёрдого (кристаллического) вещества в жидкости
- 47. Этапы растворения:1. разрушение кристаллической решетки - плавление;2. сольватация образующихся частиц молекулами растворителя.
- 48. Изменение энтальпии (тепловой эффект) при растворении кристаллических
- 49. 1. Если по абсолютной величине (по модулю)Dкр.рH
- 50. Изменение энтропии при растворении кристаллических тел также
- 51. 2. ТД описание процесса растворения газа в жидкости
- 52. Растворение газов в жидкостях представляют состоящим:1. фазового
- 53. Тепловой эффект растворения DсмH:DсмH = Dкр.рH +
- 54. 3. ТД описание процесса растворения двух жидкостей
- 55. Скачать презентацию
- 56. Похожие презентации
3.1. Общая характеристика растворов



















































Слайд 4 Истинные или молекулярные (ионные) растворы образуются самопроизвольно с
уменьшением энергии Гиббса системы.
Это термодинамически устойчивые системы (в
отличие от неустойчивых лиофобных коллоидных растворов). Слайд 5 В объёме раствора все термодинамические параметры постоянны, на
границе двух растворов (гомогенных систем) имеется граница раздела, на
которой параметры изменяются скачком.Слайд 6 Систему, состоящую из нескольких таких гомогенных фаз (например,
из двух несмешивающихся жидкостей), называют гетерогенной.
В этом случае
каждую гомогенную часть системы называют фазой. Слайд 7 Растворы – однородные смеси молекул, атомов или ионов,
между компонентами которых возможны химические и физические взаимодействия:
Слайд 8 сольватация – взаимодействие между молекулами растворителя и растворенного
вещества.
ассоциация – взаимодействие одинаковых молекул (растворителя или растворённого вещества).
Слайд 9 Один из компонентов раствора называют растворителем (обозначают индексом
1), а другие компоненты - растворёнными веществами, их обозначают
индексами 2,3 и т.д.Если раствор образован двумя жидкостями, то растворителем считают ту, которой в смеси больше, то же относится и к газовым смесям.
Слайд 10 Если же раствор получен растворением в жидкости твёрдого
вещества или газа, то растворителем всегда является жидкость.
Слайд 12
Относительное содержание компонентов в растворе называют концентрацией.
Существуют следующие
способы выражения концентрации:
Слайд 13 Молярная (мольная) доля - xi - это отношение
ni - числа моль i-го компонента к общему числу
моль веществ в растворе .Например, для растворителя (первого компонента) мольная доля равна:
Слайд 15 Молярная концентрация Сi равна числу моль i-го вещества,
растворенного в 1 литре раствора.
Для растворенного вещества (второго
компонента) молярная концентрация выражается: Слайд 17 моляльность раствора - mi – число моль i-
го вещества, растворенного в 1 кг (1000 г) растворителя.
В случае разбавленных водных растворов Ci mi.
Слайд 19 Массовый процент компонента (wi) – число граммов компонента
в 100 г раствора.
Объемный процент компонента (i) – объем
компонента в 100 см3 раствора.Слайд 21 Считается, что газы всегда смешиваются неограниченно, поэтому газообразные
растворы чаще называют «газовые смеси».
Однако при высоких давлениях
(сотни атмосфер) газы могут расслаиваться, например, при таких условиях аммиак не смешивается с азотом и водородом.
Слайд 22
Ограниченная взаимная растворимость аммиака и азота
Кричевский И.Р.,
Большаков П.Е.,
Циклис
Д.О.
Гелий-аммиак,
гелий-этанол,
аммиак-метан
и т.д.
Слайд 24 Твердые растворы замещения (с ограниченной и неограниченной растворимостью
компонентов).
Твердые растворы внедрения
Твердые растворы вычитания.
Слайд 28 История развития теории растворов – история «борьбы» физической
и химической теорий растворов.
Представители физической теории (Аррениус, Освальд и
т.д.) считали, что растворы – это результат диффузии молекул растворенного вещества в объём растворителя. Слайд 29 Представители же химической теории (Менделеев, Алексеев и т.д.)
предполагали, что между компонентами раствора происходит химическое взаимодействие с
образованием малоустойчивых соединений.Слайд 30 Почётный член АН СССР (1932), одновременно и независимо
от В. А. Кистяковского предложивший представление о сольватации ионов
и положивший начало объединению физической и химической теории растворов.Слайд 32 Образование раствора из компонентов — процесс самопроизвольный, и
при постоянстве Р и Т смG < 0.
Т.е. термодинамическим
условием образования раствора является убыль энергии Гиббса. Слайд 33 Процесс растворения будет протекать самопроизвольно до тех пор,
пока в системе не установится равновесие:
компонент (т,ж,г) раствор
Слайд 34 С точки зрения термодинамики раствор называется насыщенным, когда
химический потенциал чистого растворяемого вещества (т., ж. или г.)
равен химическому потенциалу этого вещества в растворе.Слайд 35 Рассмотрим жидкий раствор, состоящий из растворителя А и
растворенного вещества В. Пусть энергия Гиббса 1 моль чистого
компонента А равна G1, a 1 моль чистого компонента В равна G2.Слайд 36 Если раствор образуется из n1 моль А и
n2 моль В, то общая энергия Гиббса системы до
смешения равна:GI = n1G1 + n2G2,
Слайд 38 Под молем раствора понимают такое количество раствора, в
котором число молей каждого компонента равно его молярной доле.
Слайд 39 Если компоненты А и В смешать, то полученный
раствор будет иметь иное значение энергии Гиббса (GII,m), зависящее
от его состава.Слайд 40 Изменение энергии Гиббса при образовании 1 моля бинарного
раствора равно:
смG = GII,m GI,m =
= GII,m
(G1x1 + G2x2).
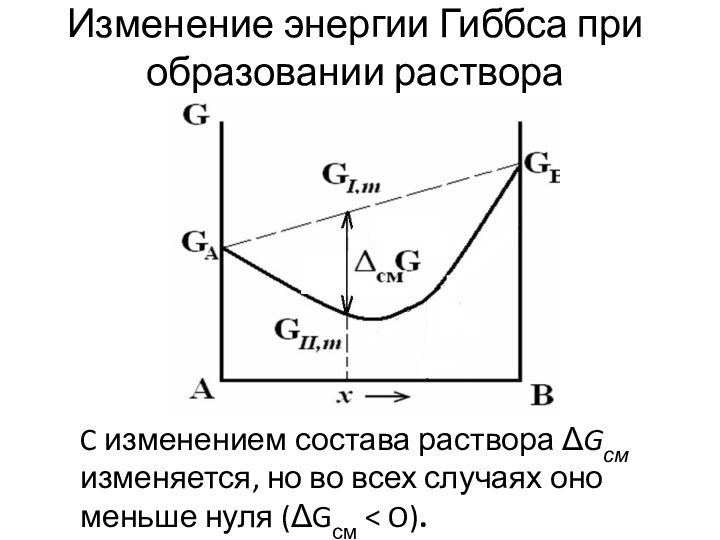
Слайд 41
Изменение энергии Гиббса при образовании раствора
C изменением состава
раствора Gсм изменяется, но во всех случаях оно меньше
нуля (Gсм < O).Слайд 43 Уменьшение энергии Гиббса в процессе образования раствора делят
на энтальпийный и энтропийный вклады:
смG= смН TсмS
Слайд 44 А сам процесс растворения представляют как сумму двух
этапов:
1. Фазовый переход (плавление или конденсация);
2. Сольватация образующихся частиц
(ионов, молекул, атомов) растворенного вещества молекулами растворителя.
Слайд 47
Этапы растворения:
1. разрушение кристаллической решетки - плавление;
2. сольватация
образующихся частиц молекулами растворителя.
Слайд 48 Изменение энтальпии (тепловой эффект) при растворении кристаллических тел
можно представить как:
DсмH = Dкр.рH + DсH
Dкр.рH >
0, DсH < 0. Суммарный тепловой эффект процесса зависит от их соотношения.
Слайд 49
1. Если по абсолютной величине (по модулю)
Dкр.рH >
DсH.
то при растворении энергия (в форме теплоты) поглощается
DсмH > 0. 2. Если по абсолютной величине (по модулю)
Dкр.рH < DсH.
то при растворении энергия (в форме теплоты) выделяется DсмH < 0.
Слайд 50 Изменение энтропии при растворении кристаллических тел также представляют
слагаемыми:
DсмS = Dкр.рS + DсS
Dкр.рS > 0, DсS
< 0. Суммарное DсмS процесса зависит от их соотношения.