Слайд 2
1 ОБЩИЕ СВЕДЕНИЯ
Принцип хроматографического анализа был впервые предложен
М.А. Цветом в 1903-1905 гг. для разделения компонентов растительных
пигментов, близких по своему строению. Поскольку при этом методе получаются раздельные полосы окрашенных веществ, он назвал этот метод хроматографией, что значит «цветопись».
Хроматография – процесс разделения веществ, основанный на разделении компонентов смеси между неподвижной (стационарной) и подвижной (мобильной) фазами.
В зависимости от строения разделяемые вещества в различной степени удерживаются той или иной фазой и вследствие этого могут быть отделены друг от друга. Хроматографический метод используют для разделения и очистки смесей веществ.
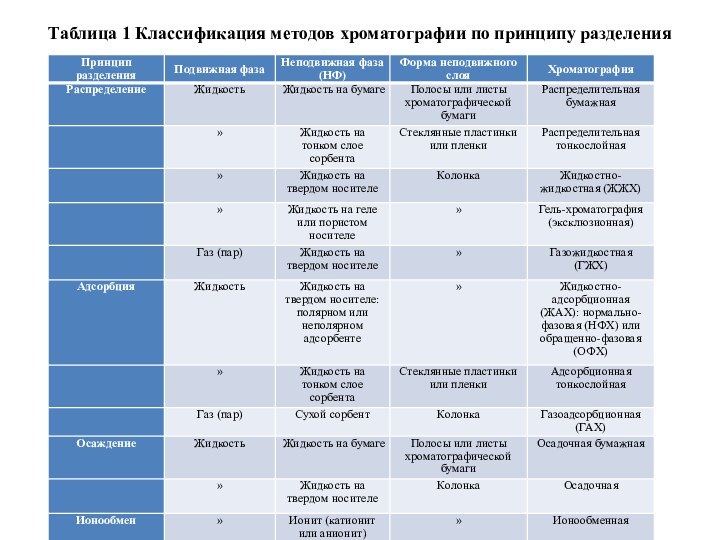
Хроматографические методы классифицируют по принципу разделения (таблица 1) в зависимости от агрегатного состояния подвижной фазы (элюента) (жидкостная и газовая) и по форме неподвижного слоя (бумажная, тонкослойная, колоночная).
Слайд 3
Таблица 1 Классификация методов хроматографии по принципу разделения
Слайд 4
2 РАСПРЕДЕЛИТЕЛЬНАЯ ХРОМАТОГРАФИЯ
Хроматография распределения характеризуется тем, что обе
фазы жидкие и представляют собой несмешивающиеся или частично смешивающиеся
жидкости. В качестве неподвижной фазы служит вода хроматографической бумаги (бумажная хроматография – БХ) или сорбента, нанесенного на подложку в виде пластинки или пленки и покрытого жидкой фазой (тонкослойная хроматография – ТСХ) или упакованного в колонку (колоночная хроматография). В качестве подвижной фазы при разделении, например аминокислот, применяют органические растворители, частично смешивающиеся с водой: фенол, креозолы, смесь бутилового спирта с уксусной кислотой и пр. Этот метод был разработан для разделения аминокислот, но в дальнейшем оказалось, что его можно применять для разделения и определения веществ различных классов.
Слайд 5
2.1 Бумажная хроматография
Бумажная хроматография подразделяется на одномерную, двухмерную
и круговую.
Одномерная хроматография заключается в том, что на полоску
хроматографической бумаги шириной 1,5-5 см и длиной 20-70 см наносят исследуемый раствор (0,005-0,007 см3) на расстоянии нескольких сантиметров от верхнего края бумаги, который погружают в растворитель (хроматограмма нисходящая), или – исследуемый раствор наносят на расстоянии нескольких сантиметров от нижнего края бумаги, который погружают в ванночку с растворителем, а верхний конец закрепляют (хроматограмма восходящая).
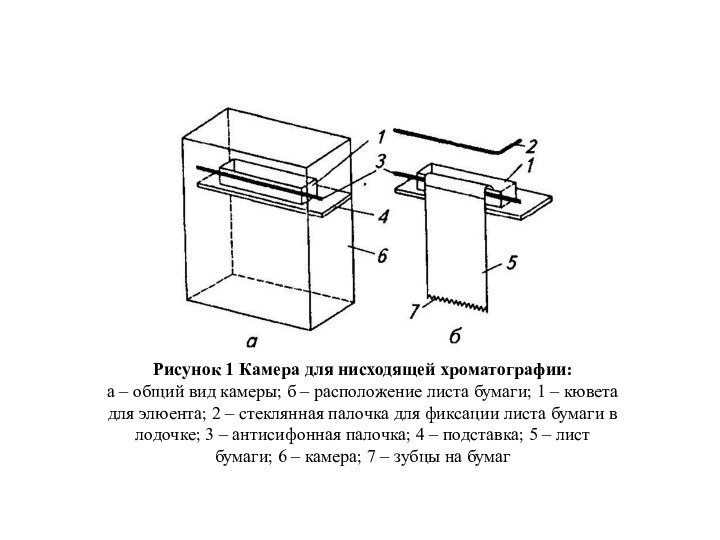
При получении хроматограммы (рисунок 1) лист бумаги подвешивают в камере, погрузив верхний край в кювету с элюентом (Элюент – подвижная фаза: газ, жидкость). Под действием силы тяжести и капиллярных сил растворитель продви¬гается сверху вниз и по достижении края листа стекает на дно камеры. Чтобы поток был равномерным, нижний край листа нарезают зубцами.
Слайд 6
Рисунок 1 Камера для нисходящей хроматографии:
а – общий
вид камеры; б – расположение листа бумаги; 1 –
кювета для элюента; 2 – стеклянная палочка для фиксации листа бумаги в лодочке; 3 – антисифонная палочка; 4 – подставка; 5 – лист бумаги; 6 – камера; 7 – зубцы на бумаг
Слайд 7
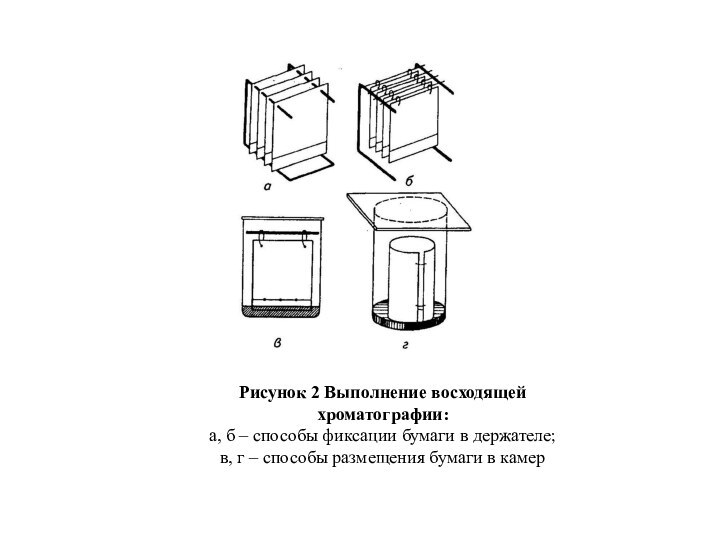
Восходящую хроматограмму (рисунок 2) вследствие слабой механической прочности

бумаги подвешивают на специальных держателях. Растворитель поднимается до верхнего
края листа бумаги за счет капиллярных сил. При этом все компоненты анализируемой смеси остаются в пределах листа. Это особенно важно в том случае, когда разделяют вещества с неизвестной подвижностью. Тогда по полученной хроматограмме можно определить коэффициент распределения R(f) всех компонентов смеси. К недостаткам метода относится низкое разрешение малоподвижных компонентов. Проблему в этом случае решают, применяя метод нисходящей хроматографии в режиме протока, когда процесс продолжается сколь угодно долго. В результате вещества даже с очень низкими R(f) имеют достаточный для хорошего разделения пробег. Для стандартизации результатов одновременно хроматографируют контрольную смесь или окрашенные вещества с известными R(f).
Как только растворитель достигает намеченного рубежа, лист извлекают из камеры, отмечают положение фронта растворителя и высушивают. Поскольку большинство веществ лишено окраски, их положение на хроматограмме выявляют подходящим способом. Например, вещества, несущие радиоактивную метку, выявляют при помощи счетчиков импульсов; вещества, имеющие собственную флуоресценцию, выявляют при облучении УФ-светом (365 нм). Остальные вещества обычно обнаруживают по окрашенным продуктам, которые образуются под действием специфических реагентов. Так, аминокислоты и полипептиды образуют с нингидрином хромофор, имеющий фиолетовую окраску.
Положение пятна, получаемого в результате распределения испытуемого вещества, выражают коэффициентом распределения. Он представляет собой отношение скорости движения (см) испытуемого вещества к скорости движения (см) фронта растворителя на полосе бумаги за определенный промежуток времени.
Например, испытуемое вещество (аминокислота) продвинулось от места нанесения на 20 см (место расположения пятна), за этот же промежуток времени фронт растворителя прошел 30 см, следовательно: R(J) = 20/30 = 0,66.
Слайд 8
Рисунок 2 Выполнение восходящей хроматографии:
а, б – способы
фиксации бумаги в держателе;
в, г – способы размещения бумаги
в камер
Слайд 9
2.2 Тонкослойная хроматография
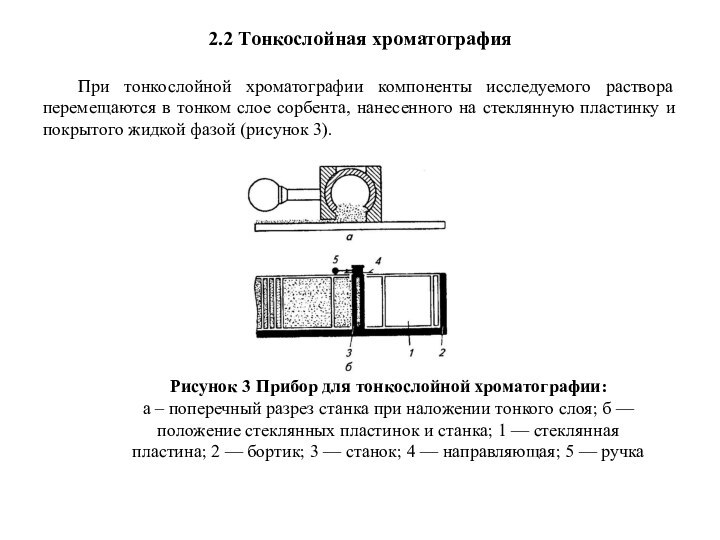
При тонкослойной хроматографии компоненты исследуемого раствора
перемещаются в тонком слое сорбента, нанесенного на стеклянную пластинку
и покрытого жидкой фазой (рисунок 3).
Рисунок 3 Прибор для тонкослойной хроматографии:
а – поперечный разрез станка при наложении тонкого слоя; б — положение стеклянных пластинок и станка; 1 — стеклянная пластина; 2 — бортик; 3 — станок; 4 — направляющая; 5 — ручка
Слайд 10
Он состоит из металлического стола или металлической доски

с ровной поверхностью и бортиками, не позволяющими сдвигаться стеклянным
пластинкам, которые кладут на стол или доску. Высота бортика не должна превышать толщину стеклянных пластин. Пять стеклянных пластин (точно 20 х 20 см) толщиной не менее 4 мм должны плотно входить между бортиками стола. Их укладывают последовательно на поверхность стола или доски без промежутков. Перед нанесением сорбента стеклянные пластины тщательно моют, обезжиривают и сушат.
Образцы и растворители необходимо подготовить. Жирные кислоты глицеридов без предварительного омыления переводят в метиловые эфиры метанолом в диэтиловом эфире в присутствии гидроксида калия.
Для разделения нейтральных липидов и их гидролизатов рекомендуют различные растворители и смеси (петролейный эфир (или гексан) + бензол; гексан + тетралин; петролейный эфир + диэтиловый эфир и др.).
В качестве сорбентов при тонкослойной хроматографии используют силикагель в смеси с гипсом и оксидом алюминия, оксид алюминия, кизельгур (для разделения триглицеридов, кетокислот, жирных кислот применяют кизельгур, который пропитывают высококипящими фракциями нефти).
Слайд 11
2.3 Жидкостно-жидкостная хроматография
В жидкостно-жидкостной хроматографии (ЖЖХ) неподвижную фазу
помещают в колонку, затем вносят в нее анализируемую смесь
и элюируют подходящим растворителем. При продвижении по колонке компоненты смеси удерживаются сорбентом в соответствии с их физико-химическими свойствами и, следовательно, мигрируют с разной скоростью. Из колонки разделяемые вещества смеси выходят в определенной последовательности и могут быть собраны в виде отдельных фракций.
Слайд 12
2.4 Гель-хроматография
Гель-хроматография (молекулярно-ситовая хроматография) – метод, основанный на
различной способности молекул разного размера проникать в поры нейтрального
геля, который служит неподвижной фазой.
Схематично принцип работы молекулярных сит показан на рисунок 4. В качестве неподвижной фазы служит пористый гель с порами определенного диаметра. Крупные молекулы не диффундируют в поры гранул и элюируются быстрее, молекулы небольшого размера удерживаются в порах гранул и элюируются позднее.
Слайд 13
Рисунок 4 Схема разделения веществ методом гель-хроматографии