Spectrometry - Лазерная десорбция/ионизация при содействии матрицы + времяпролетная
масс-спектрометрияразработано в 1980-х Karas & Hillenkamp и К. Tanaka с соавторами
Нобелевская премия по химии K. Tanaka, 2002
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


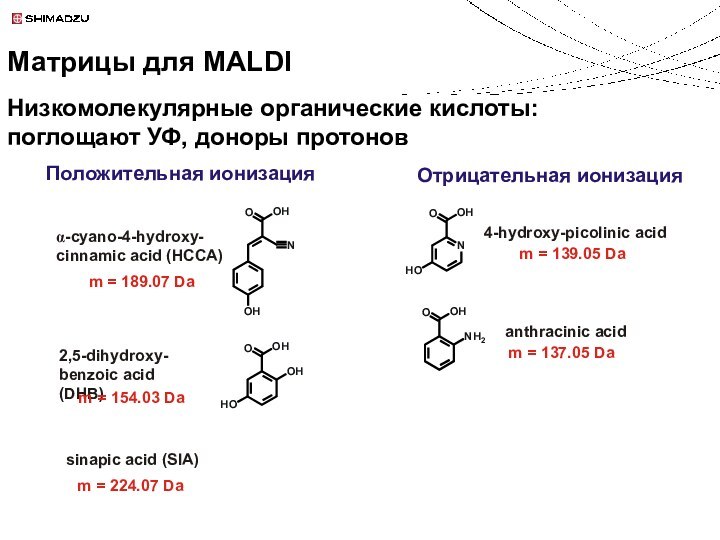
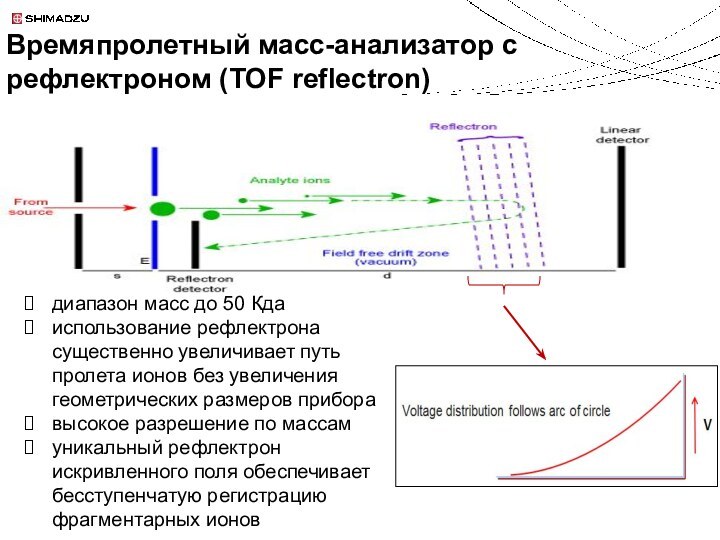
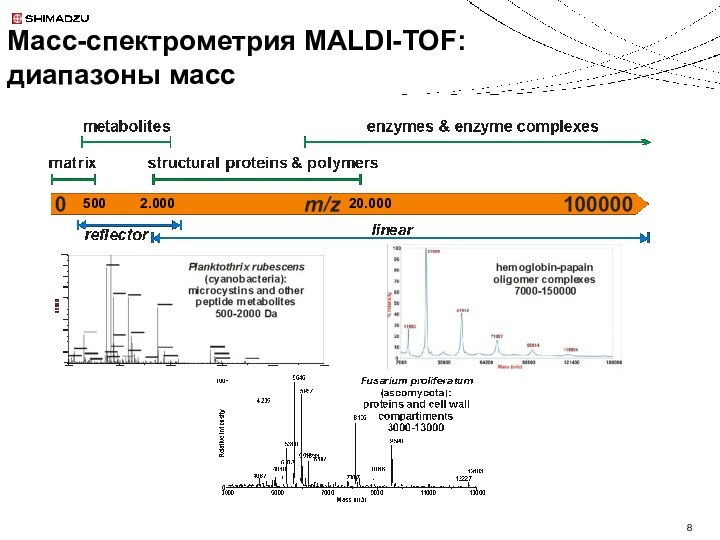




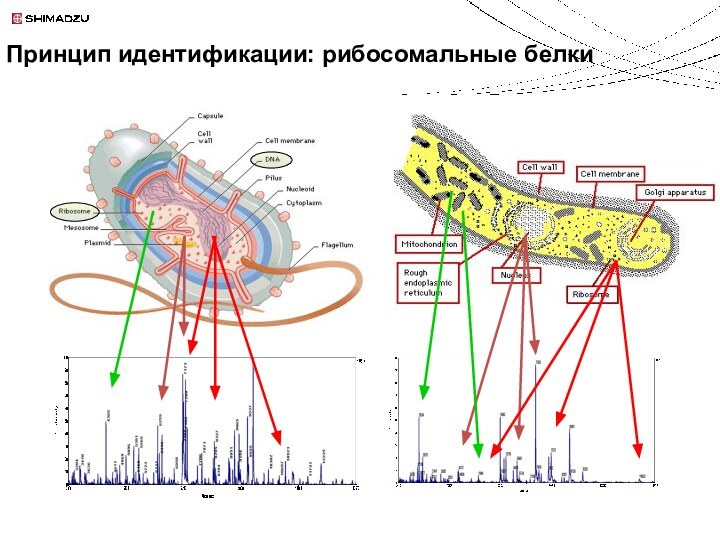







m = 154.03 Da
Положительная ионизация
sinapic acid (SIA)
m = 224.07 Da
Низкомолекулярные органические кислоты:
поглощают УФ, доноры протонов
Матрицы для MALDI
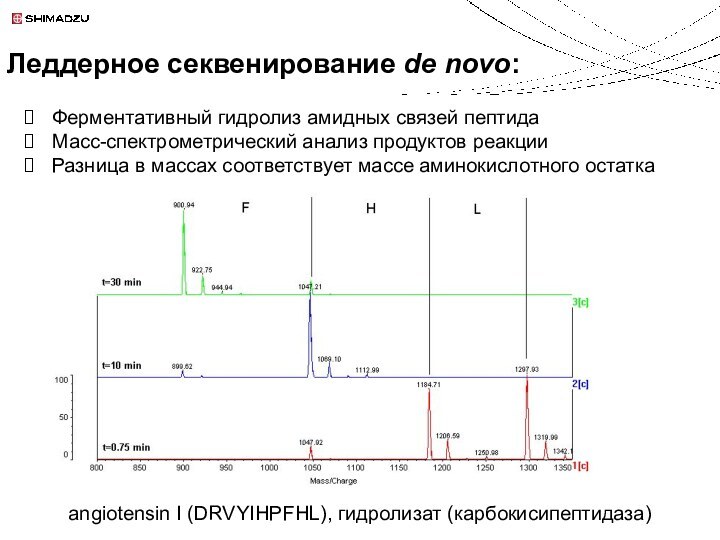
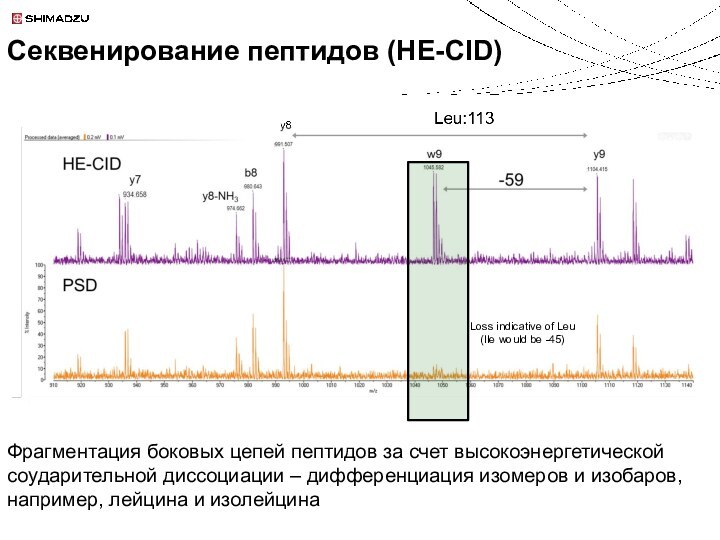
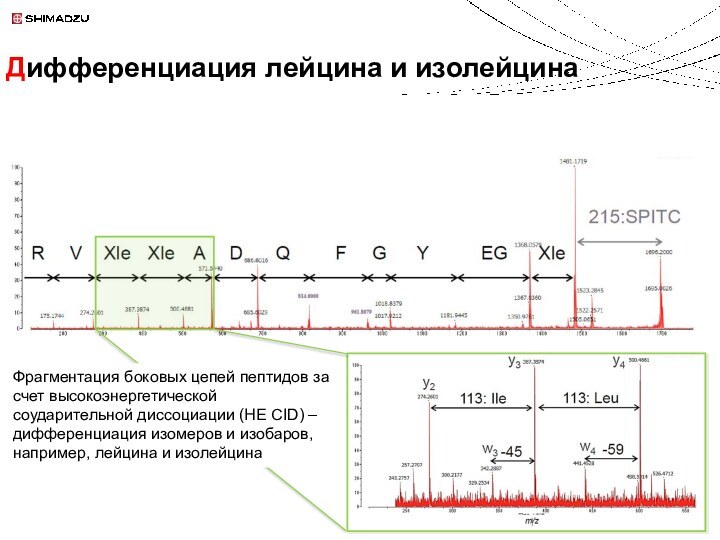
Loss indicative of Leu
(Ile would be -45)
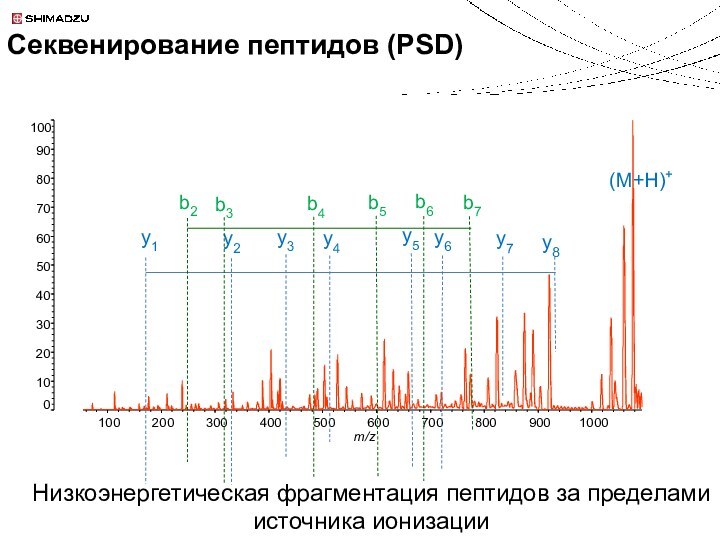
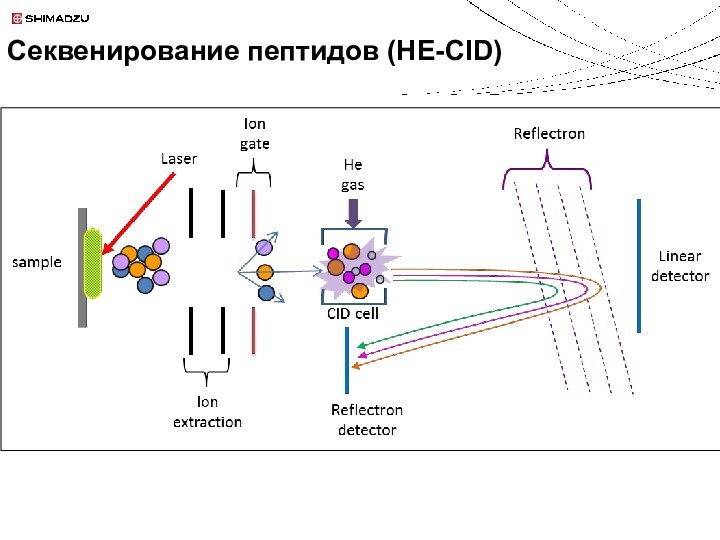
Секвенирование пептидов (HE-CID)
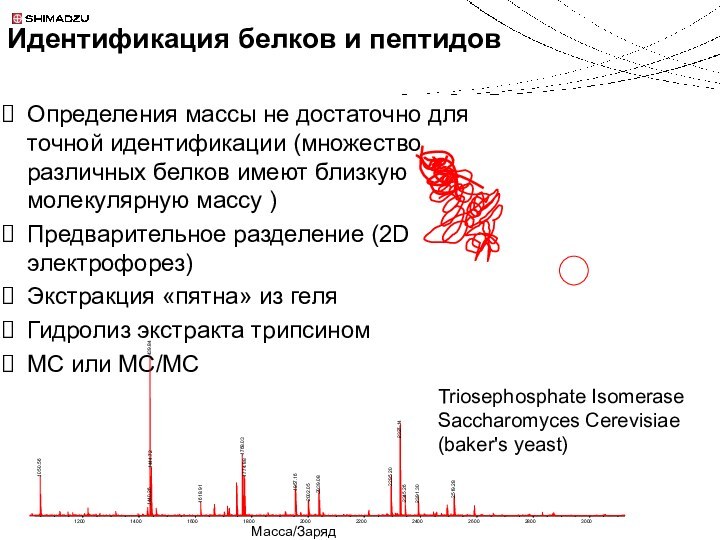
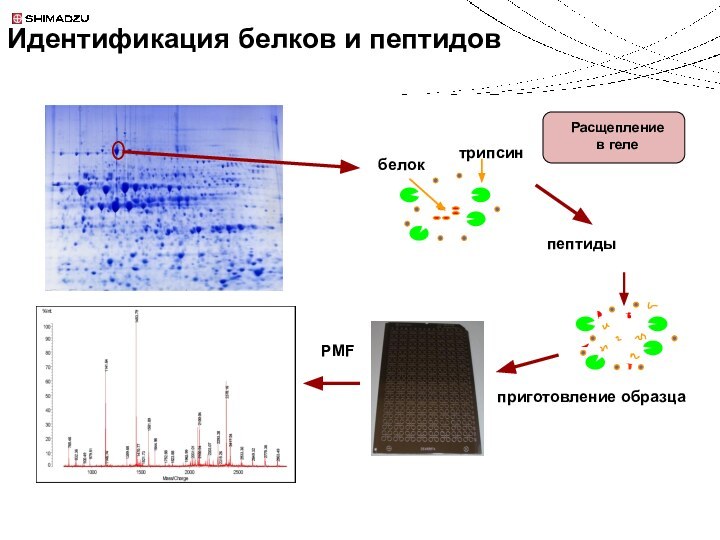
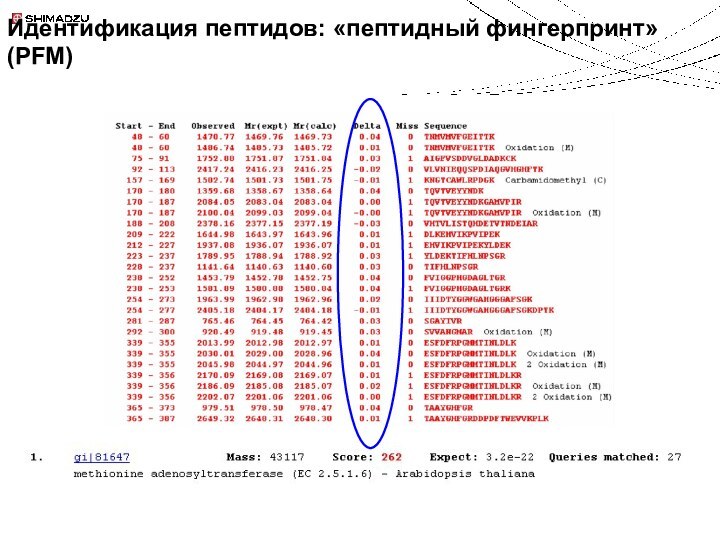
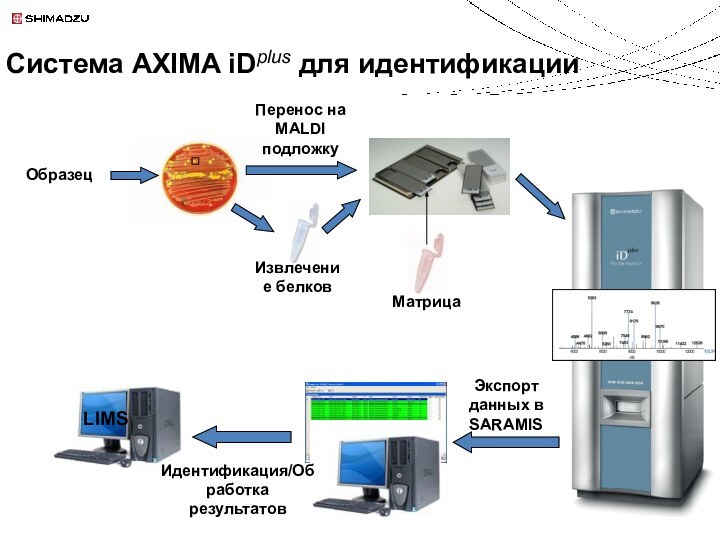
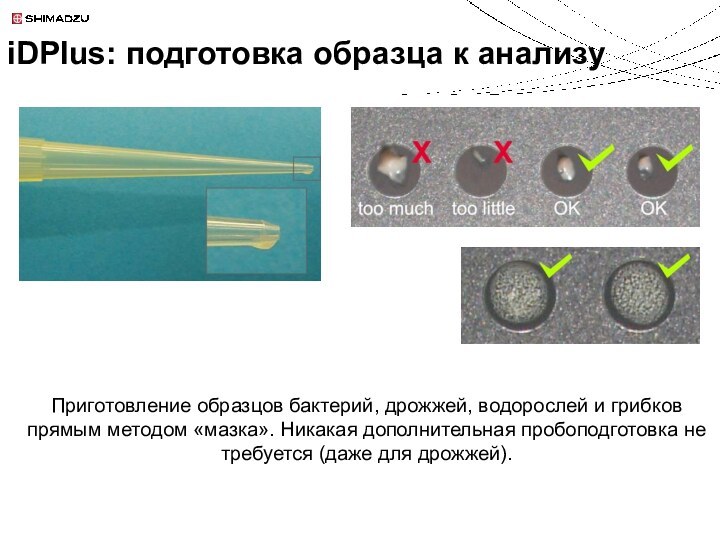
Идентификация белков и пептидов
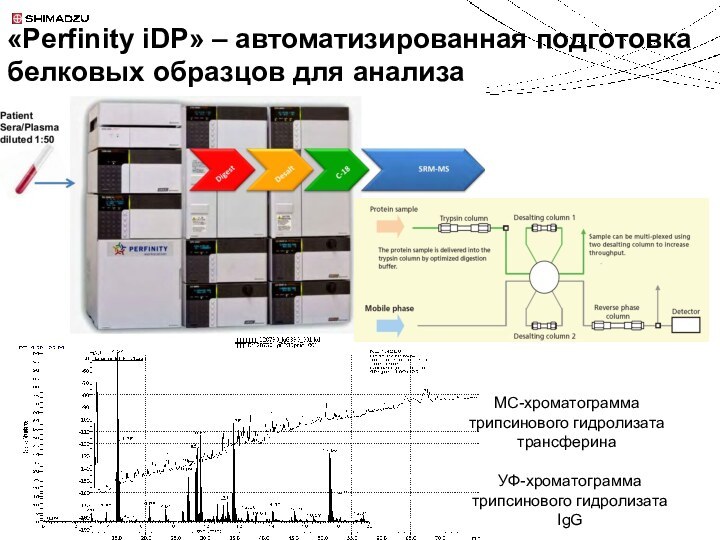
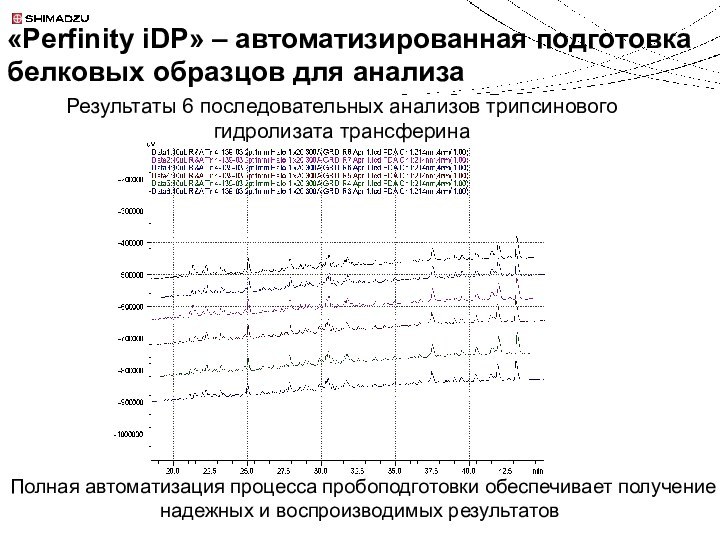
Колонка с иммобилизованным трипсином
ОФ хроматография
MS анализ
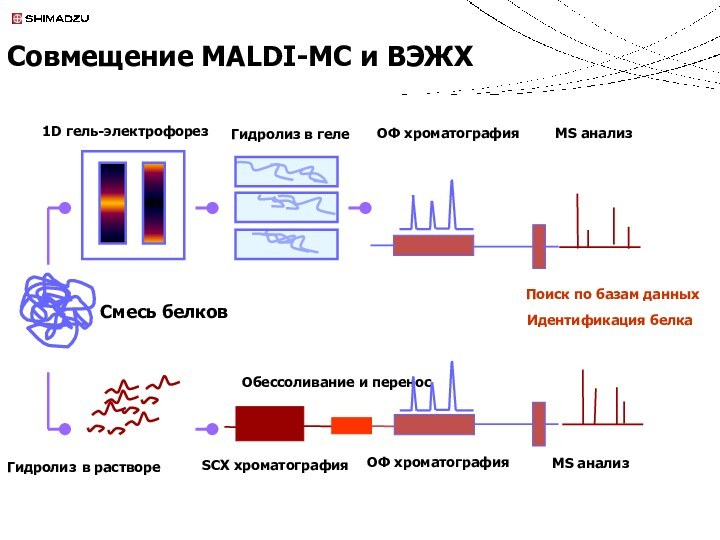
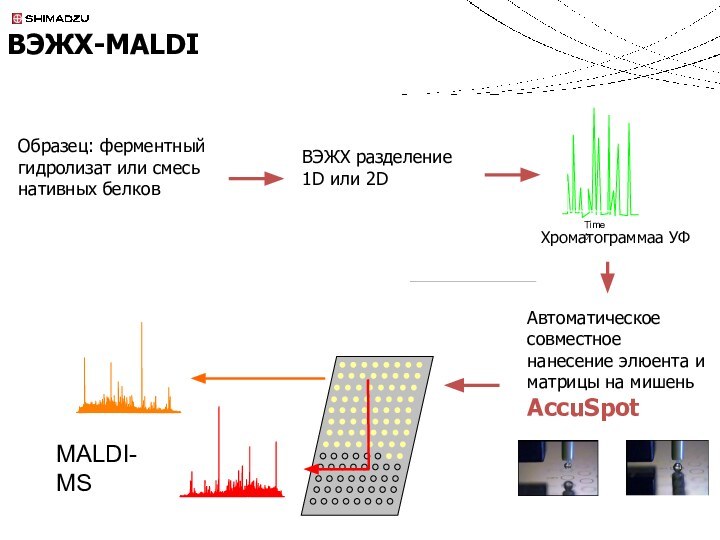
Совмещение MALDI-МС и ВЭЖХ
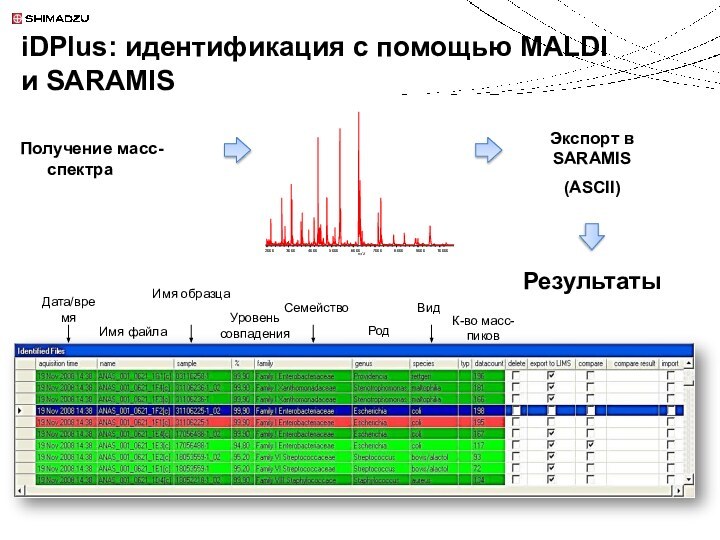
Неизвестный микроорганизм
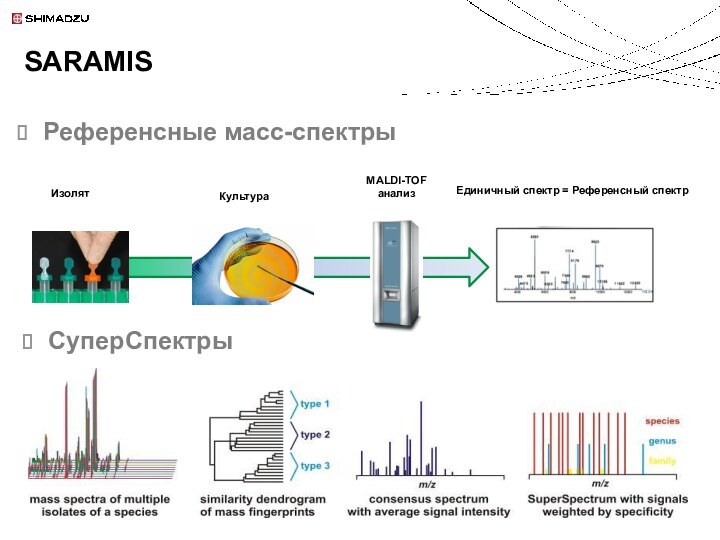
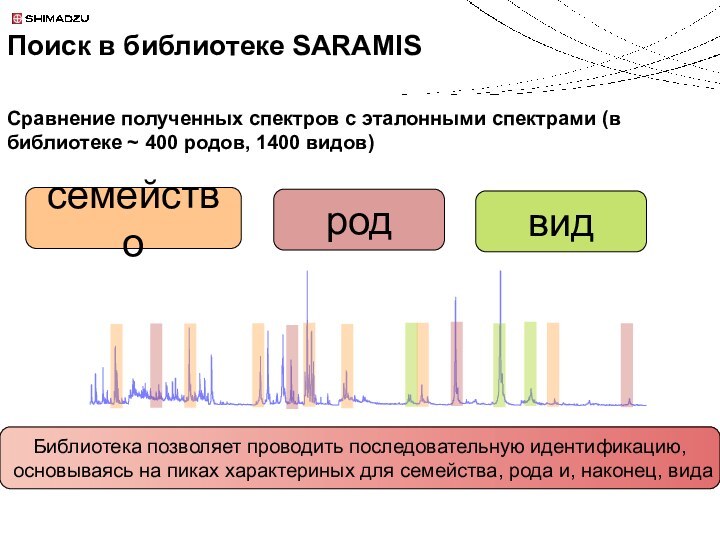
Поиск в библиотеке SARAMIS
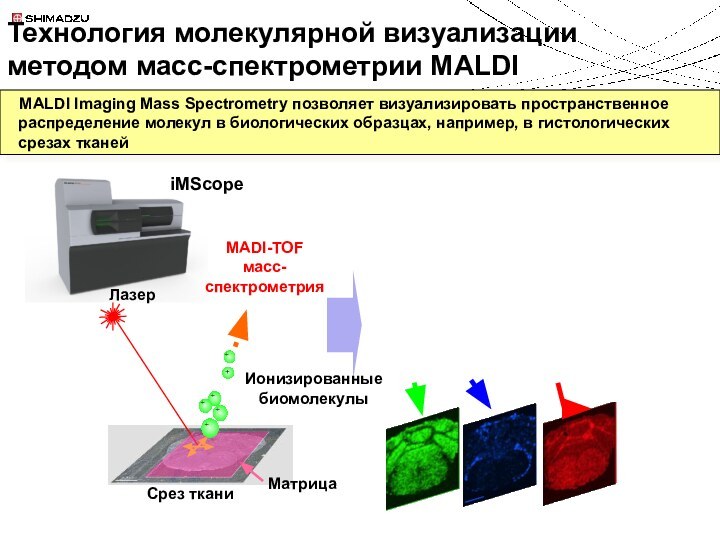
Ионизированные биомолекулы
Матрица
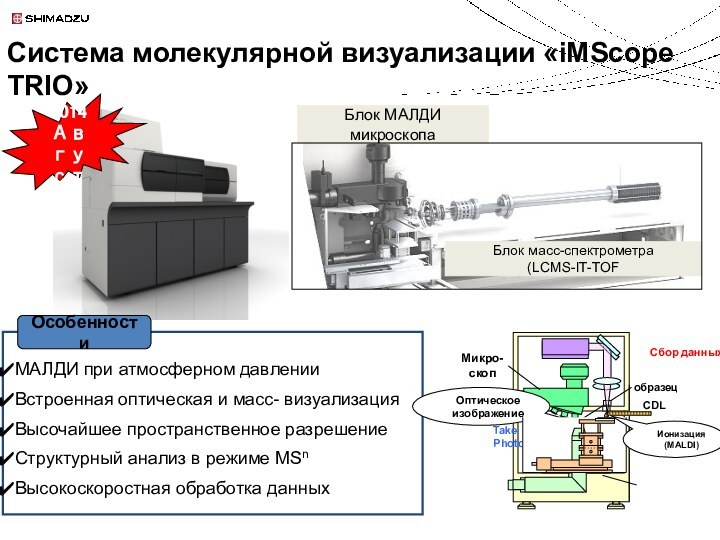
Технология молекулярной визуализации методом масс-спектрометрии MALDI
MADI-TOF
масс-спектрометрия
iMScope
Масс-спектр
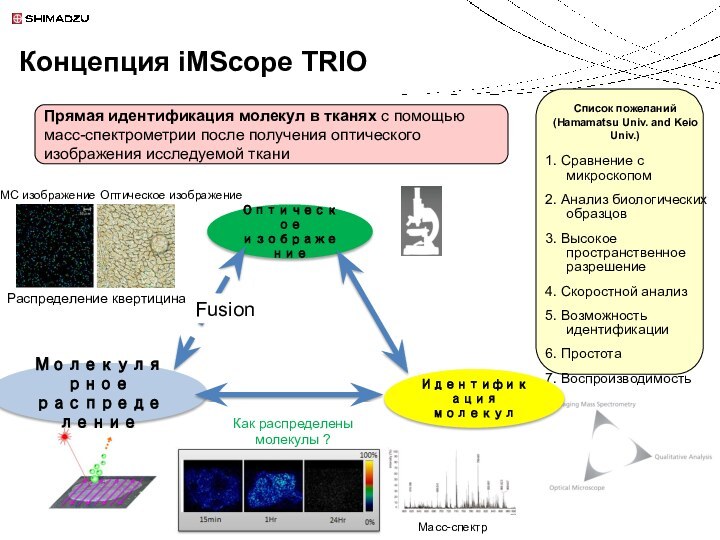
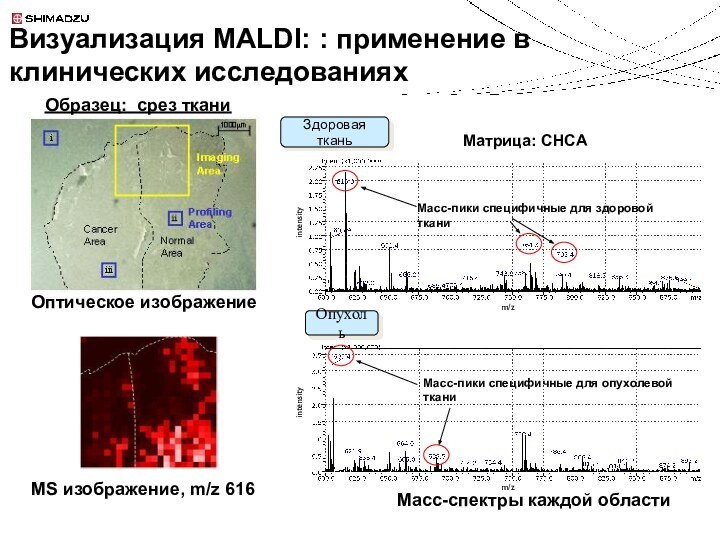
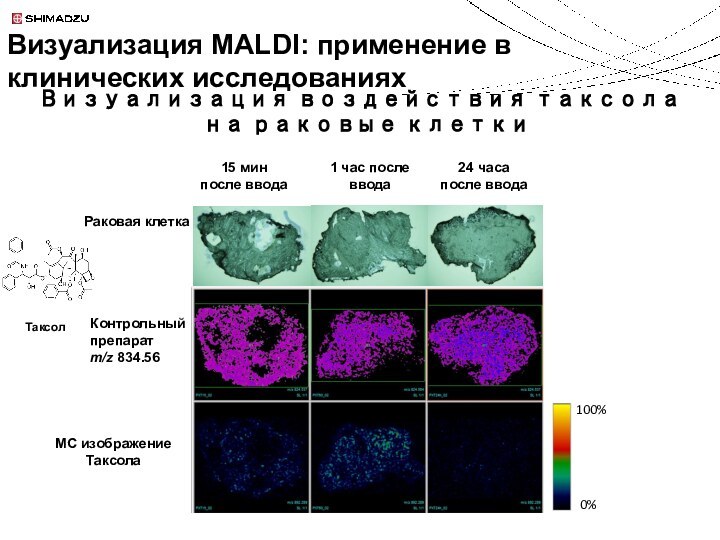
Идентификация молекул
MС изображение
Оптическое изображение
Концепция iMScope TRIO
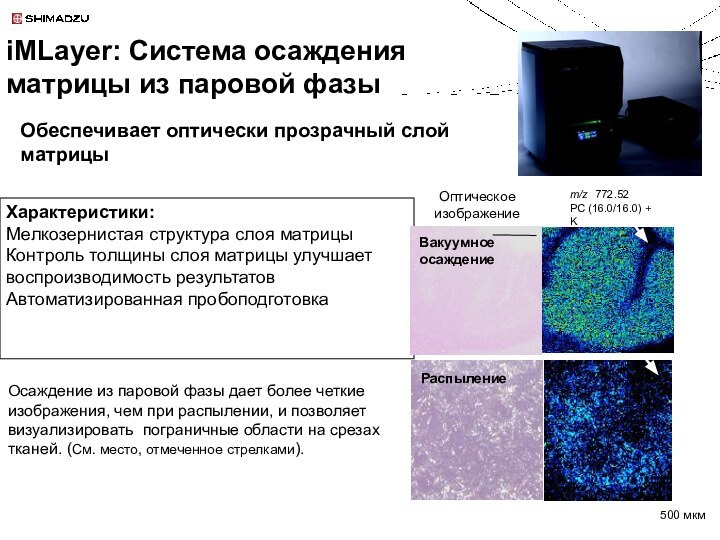
iMLayer: Система осаждения матрицы из паровой фазы
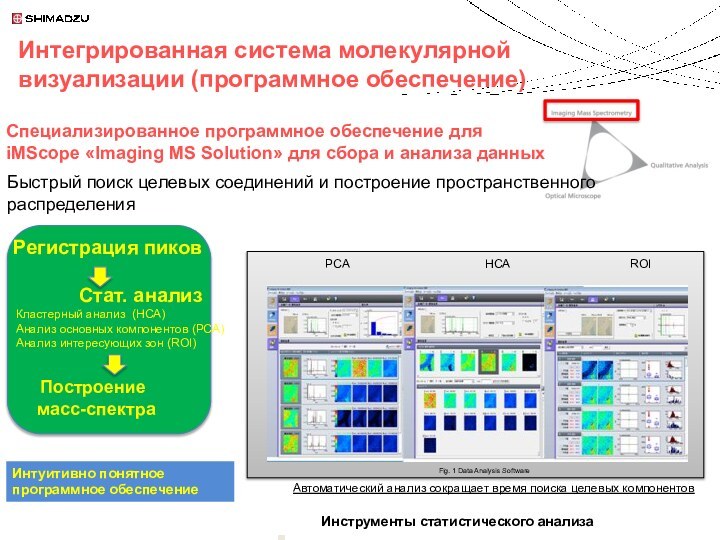
Регистрация пиков
Стат. анализ
Кластерный анализ (HCA)
Анализ основных компонентов (PCA)
Анализ интересующих зон (ROI)
Построение
масс-спектра
Интуитивно понятное программное обеспечение
Быстрый поиск целевых соединений и построение пространственного распределения
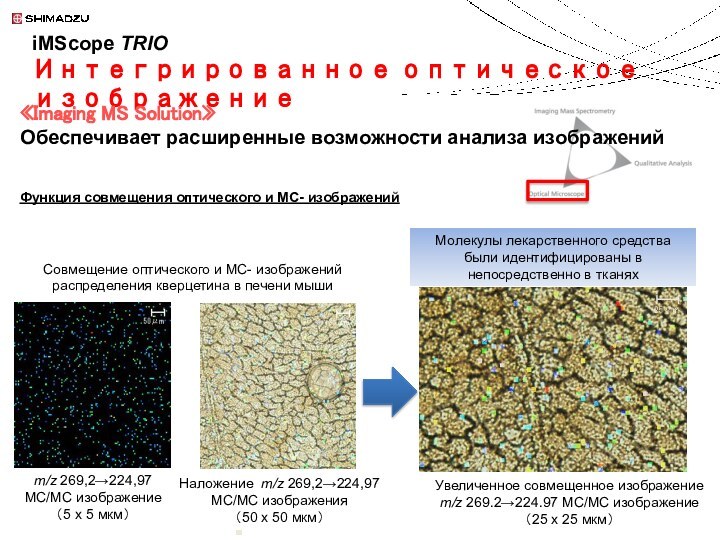
Молекулы лекарственного средства были идентифицированы в непосредственно в тканях
Наложение m/z 269,2→224,97
MС/MС изображения
(50 х 50 мкм)
m/z 269,2→224,97
MС/MС изображение (5 х 5 мкм)
Увеличенное совмещенное изображение
m/z 269.2→224.97 MС/MС изображение
(25 х 25 мкм)
«Imaging MS Solution»
Обеспечивает расширенные возможности анализа изображений
Visualizing ESI condition on PC
Подключение блока ESI
Увеличение чувствительности и точности структурного анализа за счет MСn (n≦10 ) и предварительной сепарации при помощи ВЭЖХ
iMScope TRIO
Качественный и количественный анализ
DL
ESI
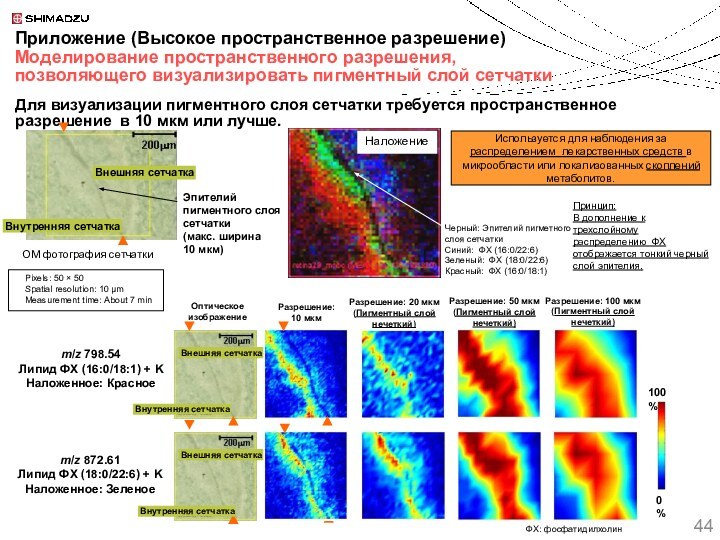
Используется для наблюдения за распределением лекарственных средств в микрообласти или локализованных скоплений метаболитов.
Принцип:
В дополнение к трехслойному распределению ФХ отображается тонкий черный слой эпителия.
1 час после ввода
24 часа после ввода
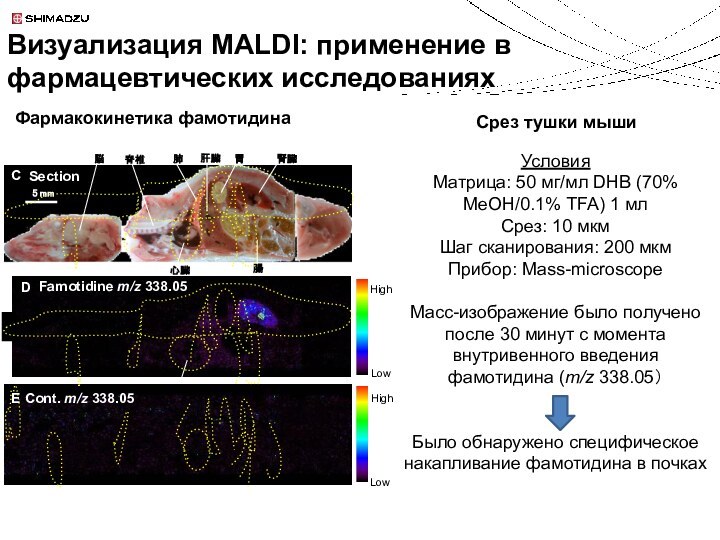
Фармакокинетика фамотидина
Срез тушки мыши
Визуализация MALDI: применение в фармацевтических исследованиях