Слайд 2
Насичені альдегіди та кетони
За номенклатурою IUPAC альдегіди називають
за назвою відповідного вуглеводня з додаванням закінчення -аль. Кетони
- з додаванням закінчення -он. Нумерація ланцюга в молекулах альдегідів починається з вуглецевого атома оксогрупи, а у кетонів - з того кінця ланцюга, до якого ближче розташована карбонільна група, при цьому положення оксогрупи вказують локантом.
За радикало-функціональною номенклатурою кетони називають, вказуючи за алфавітним порядком вуглеводневі залишки, що зв'язані з карбонільною групою з додаванням суфіксу -кетон. Тривіальні назви альдегідів походять, як правило, від назв кислот, в які вони перетворюються при окисненні, з додаванням у кінці слова "альдегід".
Слайд 4
СПОСОБИ ОДЕРЖАННЯ
1. Окиснення
1.1. Окиснення або каталітичне дегідрування спиртів
Як
окиснювач найчастіше використовується кисень повітря у присутності Сu. При
цьому з первинних спиртів отримують альдегіди, а з вторинних – кетони:
Слайд 5
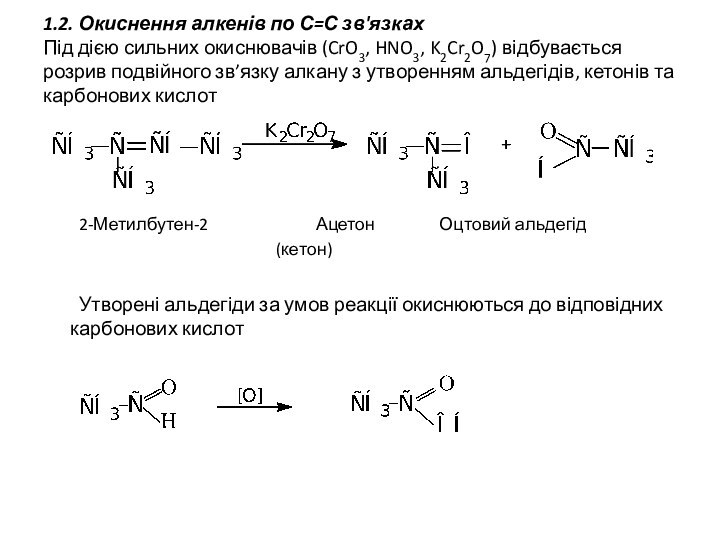
1.2. Окиснення алкенів по С=С зв'язках
Під дією сильних
окиснювачів (CrO3, HNO3, K2Cr2O7) відбувається розрив подвійного зв’язку алкану
з утворенням альдегідів, кетонів та карбонових кислот
2-Метилбутен-2 Ацетон Оцтовий альдегід
(кетон)
Утворені альдегіди за умов реакції окиснюються до відповідних карбонових кислот
Слайд 6
1.3. Окиснення алканів
Важливою промисловою реакцією є каталітичне окиснення
метану до формальдегіду:
2. Реакція оксосинтезу (гідроформілювання алкенів),
О.Роєлен, 1938 р.
Алкени в присутності кобальтового каталізатора під тиском взаємодіють з синтез-газом з утворенням альдегідів:
Слайд 7
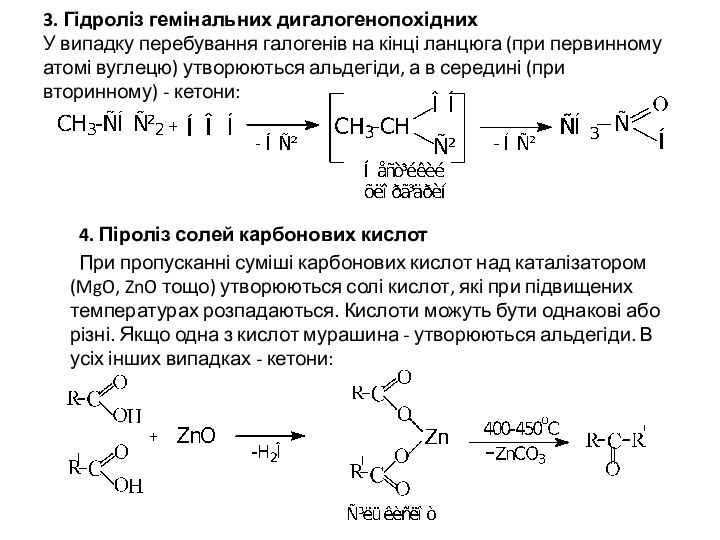
3. Гідроліз гемінальних дигалогенопохідних
У випадку перебування галогенів на
кінці ланцюга (при первинному атомі вуглецю) утворюються альдегіди, а
в середині (при вторинному) - кетони:
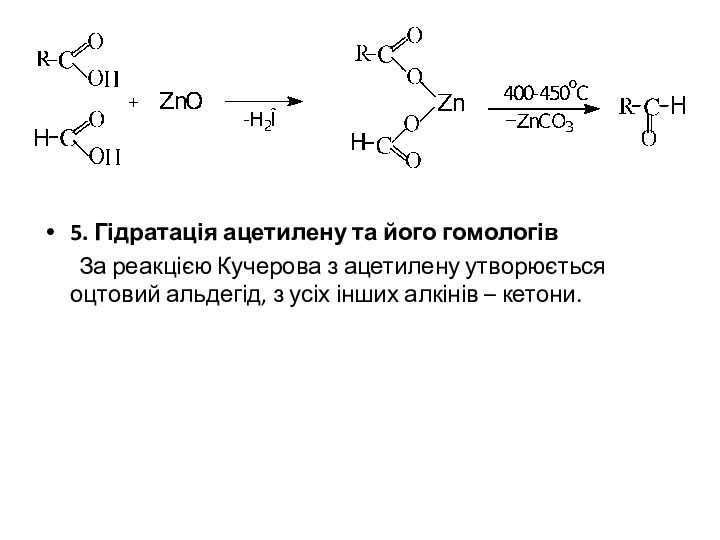
4. Піроліз солей карбонових кислот
При пропусканні суміші карбонових кислот над каталізатором (MgO, ZnO тощо) утворюються солі кислот, які при підвищених температурах розпадаються. Кислоти можуть бути однакові або різні. Якщо одна з кислот мурашина - утворюються альдегіди. В усіх інших випадках - кетони:
Слайд 8
5. Гідратація ацетилену та його гомологів
За реакцією Кучерова
з ацетилену утворюється оцтовий альдегід, з усіх інших алкінів
– кетони.
Слайд 9
ФІЗИЧНІ ВЛАСТИВОСТІ
Насичені альдегіди та кетони - це безбарвні
рідини. Метаналь - газ з різким запахом. Їх температури
кипіння нижчі, ніж у спиртів, тому що для альдегідів і кетонів утворення водневого зв'язку не характерне. Кетони киплять при вищій температурі, ніж альдегіди.
Слайд 10
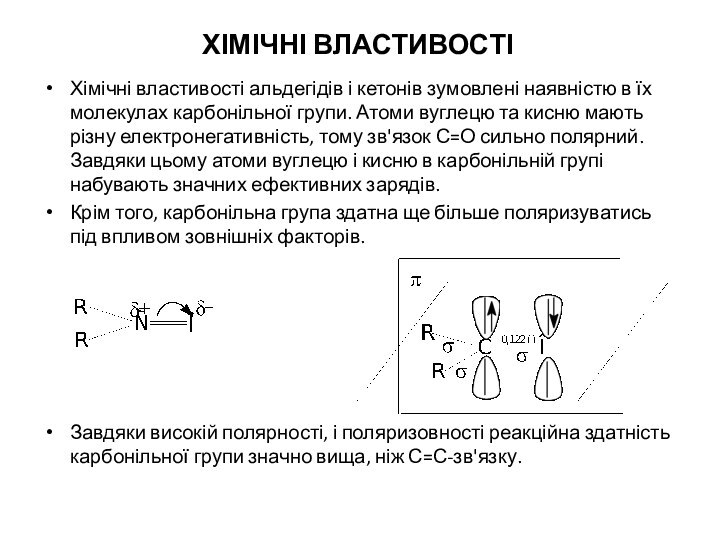
ХІМІЧНІ ВЛАСТИВОСТІ
Хімічні властивості альдегідів і кетонів зумовлені наявністю
в їх молекулах карбонільної групи. Атоми вуглецю та кисню
мають різну електронегативність, тому зв'язок С=О сильно полярний. Завдяки цьому атоми вуглецю і кисню в карбонільній групі набувають значних ефективних зарядів.
Крім того, карбонільна група здатна ще більше поляризуватись під впливом зовнішніх факторів.
Завдяки високій полярності, і поляризовності реакційна здатність карбонільної групи значно вища, ніж С=С-зв'язку.
Слайд 11
Вуглець карбонільної групи виявляє електрофільні властивості, а кисень
- нуклеофільні. Завдяки цьому, атом вуглецю карбонільної групи здатний
реагувати з нуклеофільними реагентами, а атом кисню з електрофільними.
Головними типами хімічних реакцій альдегідів і кетонів є:
1) реакції приєднання за карбонільною групою;
2) реакції заміщення;
3) реакції окиснення;
4) реакції полімеризації та поліконденсації.
Слайд 12
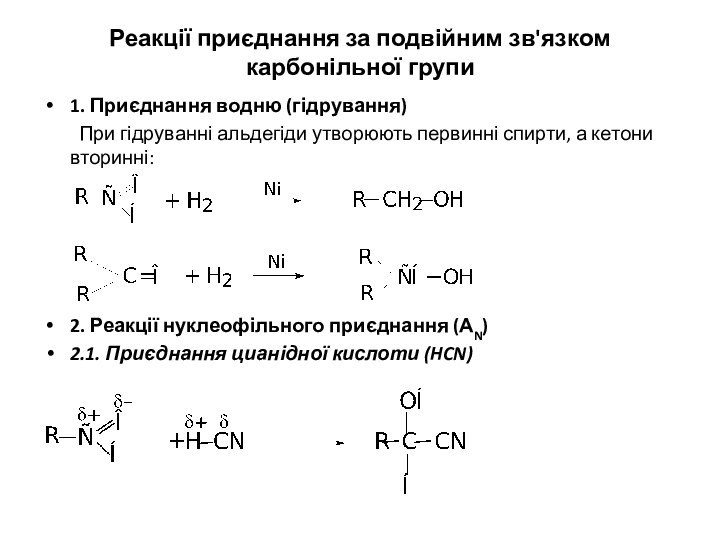
Реакції приєднання за подвійним зв'язком карбонільної групи
1. Приєднання
водню (гідрування)
При гідруванні альдегіди утворюють первинні спирти, а кетони
вторинні:
2. Реакції нуклеофільного приєднання (АN)
2.1. Приєднання цианідної кислоти (HCN)
Слайд 13
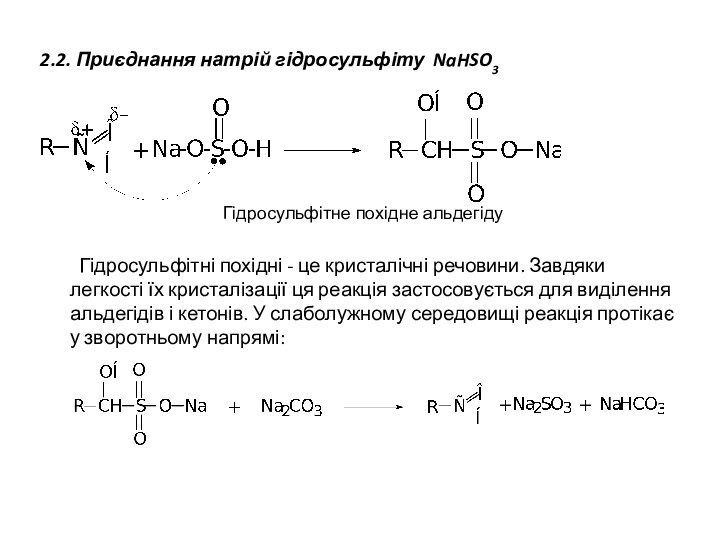
2.2. Приєднання натрій гідросульфіту NaHSO3
Гідросульфітне похідне альдегіду
Гідросульфітні похідні
- це кристалічні речовини. Завдяки легкості їх кристалізації ця
реакція застосовується для виділення альдегідів і кетонів. У слаболужному середовищі реакція протікає у зворотньому напрямі:
Слайд 14
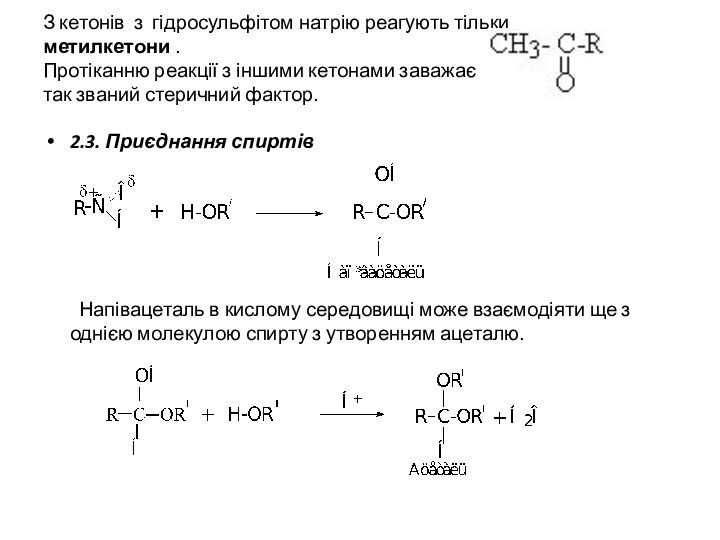
З кетонів з гідросульфітом натрію реагують тільки
метилкетони
.
Протіканню реакції з іншими кетонами заважає
так званий
стеричний фактор.
2.3. Приєднання спиртів
Напівацеталь в кислому середовищі може взаємодіяти ще з однією молекулою спирту з утворенням ацеталю.
Слайд 15
Ацеталі при нагріванні з розведеними кислотами піддаються гідролізу:
2.5.
Приєднання аміаку
Альдегіди приєднують аміак з утворенням гідроксиамінів. Дана реакція
практично завжди закінчується відщепленням води і утворенням зв'язку C=N. Одержані сполуки називають альдімінами.
Кетони з аміаком реагують складніше і значно повільніше.
Слайд 16
2.6. Взаємодія з гідроксиламіном (NH2OH)
Дана реакція застосовується для
кількісного визначення альдегідів і кетонів. При цьому утворюються альдоксими
і кетоксими:
Слайд 17
2.7. Приєднання гідразину та його похідних
Гідразин, аналогічно до
аміаку і гідроксиламіну, приєднується до електрофільного атома вуглецю карбонільної
групи з наступним відщепленням води.
При співвідношенні 1:1 утворюються гідразони:
При співвідношенні карбонільна сполука гідразин - 2:1 утворюються азини (альдазини і кетазини):
Слайд 18
Аналогічно протікають реакції з фенілгідразином NH2-NH-C6H5. При цьому
утворюються фенілгідразони:
2.9. Взаємодіяз галоген-нуклеофілами (РСІ5, PCl3)
При взаємодії з
РСІ5, який є сильним електрофілом, спочатку відбувається активація карбонільної сполуки, а потім реакція з галогенід-йоном. Цю реакцію використовують для одержання гемінальних дихлоралканів:
Слайд 19
Реакції заміщення (S)
Атоми гідрогену біля α-вуглецевого атому характеризуються
підвищеною рухливістю і можуть легко обмінюватися на інші атоми
чи функціональні групи.
Ці реакції протікають за механізмом електрофільного заміщення (SЕ):
2-Хлоропропаналь
Слайд 20
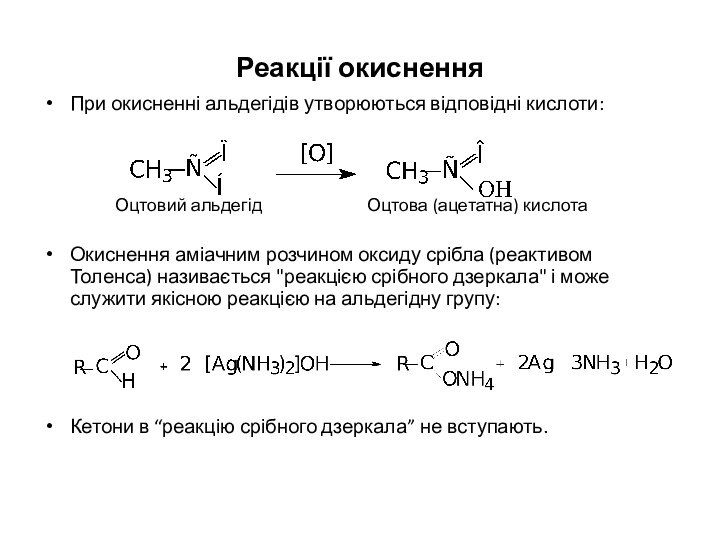
Реакції окиснення
При окисненні альдегідів утворюються відповідні кислоти:
Оцтовий альдегід Оцтова
(ацетатна) кислота
Окиснення аміачним розчином оксиду срібла (реактивом Толенса) називається
"реакцією срібного дзеркала" і може служити якісною реакцією на альдегідну групу:
Кетони в “реакцію срібного дзеркала” не вступають.
Слайд 21
Окиснення кетонів відбувається складніше і протікає лише в
жорстких умовах. При їх окисненні спостерігається розрив вуглецевого ланцюга:
Суміш
карбонових кислот
Слайд 22
Реакції полімеризації і конденсації
Реакції полімеризації характерні тільки для
альдегідів.
1. Полімеризація формальдегіду
У присутності певних каталізаторів формальдегід здатний до
полімеризації за рахунок розкриття π-зв'язку карбонільної групи (аналогічно до полімеризації алкенів):
При цьому утворюється лінійний високомолекулярний поліформальдегід, який застосовується для виробництва синтетичного волокна.
Слайд 23
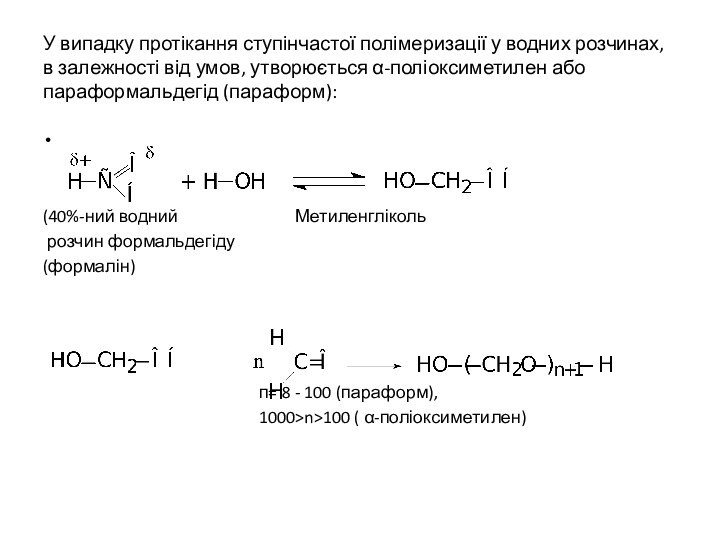
У випадку протікання ступінчастої полімеризації у водних розчинах,
в залежності від умов, утворюється α-поліоксиметилен або параформальдегід (параформ):
(40%-ний водний Метиленгліколь
розчин формальдегіду
(формалін)
п= 8 - 100 (параформ),
1000>n>100 ( α-поліоксиметилен)
Слайд 24
2. Реакції конденсації (димеризації)
Особливу групу реакцій альдегідів і
кетонів складають реакції конденсації, зумовлені рухливістю атомів водню що
зв’язані з α-вуглецевим атомом.
2.1. Альдольна конденсація або альдольне приєднання (О.П.Бородін, Ж.Вюрц, 1872)
У цю реакцію вступають альдегіди, які в α-положенні до С=О групи мають атоми водню:
Слайд 25
Продукт реакції містить спиртову і альдегідну функціональні групи.
Такі сполуки називаються альдолями.
Механізм альдольної конденсації. Під впливом карбонільної
групи атом водню, що зв’язаний з α-вуглецевим атомом, протонізується і набуває здатності в присутності основ легко відщеплюватися у вигляді протона:
Слайд 26
2.2. Кротонова конденсація
Якщо утворений в результаті альдольної конденсації
альдоль містить в α-положенні атоми водню, то при нагрівання
він може відщеплювати воду з утворенням ненасиченого альдегіду. Таке продовження реакції альдольної конденсації називається кротоновою конденсацією, за назвою альдегіду, вперше одержаного таким шляхом.
Слайд 27
2.3. Реакція диспропорціювання (Канніццаро 1853)
(формальдегід і альдегіди) при
α –вуглецевому атомі, які в α-положенні до групи не мають
атомів водню (четвертинний атом вуглецю), вступають в реакцію диспропорціювання (окиснення-відновлення). Одна молекула альдегіду відновлюється і перетворюється на спирт, а друга окиснюється і перетворюється на карбонову кислоту.
Слайд 28
Отже, в лужному середовищі альдегіди, що містять хоча
б один атом водню при α-вуглецевому атомі вступають в
альдольну конденсацію. Якщо цих атомів водню є хоча б два, то альдольна конденсація супроводжується кротоновою. А якщо у молекулі альдегіду нема жодного атома водню при α-вуглецевому атомі, то такі альдегіди вступають у реакцію Канніццаро.
Слайд 29
2.4. Естерна конденсація (В.Є.Тищенко, 1906)
У присутності алкоголяту алюмінію
відбувається диспропорціювання альдегідів, тобто одна молекула альдегіду відновлюється, а
друга окиснюється за рахунок переносу гідрид-йона, з утворенням естеру:
Слайд 30
НЕНАСИЧЕНІ АЛЬДЕГІДИ ТА КЕТОНИ
Ненасиченими альдегідами і кетонами називаються
сполуки, які містять в молекулі карбонільну групу і кратні
зв'язки С=С або С≡С.
Слайд 31
Акролеїн (2-пропеналь) одержують кротоновою конденсацією суміші метаналю та
етеналю через стадію альдолю:
3-Гідроксипропаналь Пропеналь
(акролеїн)
Крім того його отримують окисненням пропену
молекулярним киснем без каталізатора. При цьому утворюється гідропероксид, який далі розпадається на спирт та альдегід:
3-Гідроксипропаналь Пропеналь
(акролеїн)
Слайд 32
Кротоновий альдегід (2-бутеналь). Кротоновий альдегід отримують реакцією кротонової
конденсації оцтового альдегіду.
Вінілметилкетон (3-бутен-2-он) - кротоновою конденсацією формальдегіду з
ацетоном через альдоль:
Слайд 33
Хімічні властивості
Хімічні властивості ненасичених альдегідів і кетонів
залежать від взаємного розташування і впливу один на одного
карбонільної групи і кратних зв'язків. У випадку спряження зв'язків С=С і СО їм притаманні специфічні властивості. Так, за рахунок значних (-І) і (-М)-ефектів, що проявляє карбонільна група, подвійний С=С-зв'язок сильно поляризується. Тому, приєднання галогеноводнів відбувається проти правила Марковнікова:
Приєднання HCN (цианідної кислоти) відбувається тільки за участю СО групи:
Слайд 34
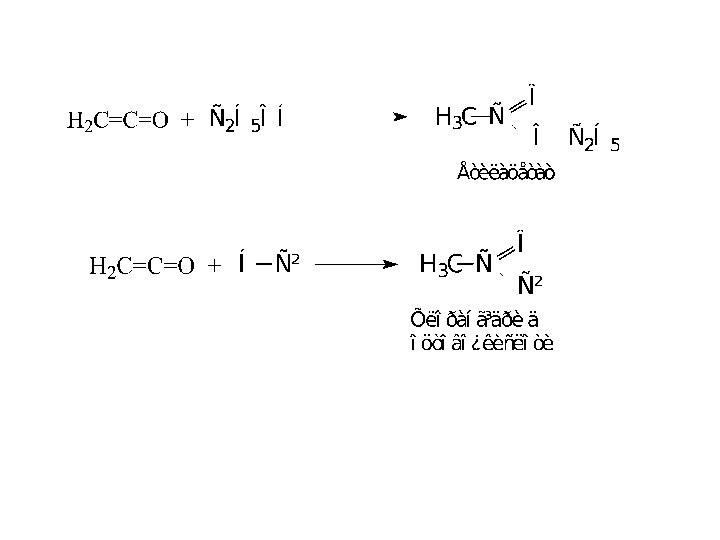
Кетени
Кетенами називаються сполуки з системою кумульованих зв'язків, подібних
до алкадієнів типу алену.
Кетен (Н2С = С = О)
отримують піролізом ацетону:
Кетени характеризуються значним позитивним зарядом на карбонільному атомі вуглецю, що перебуває в sp-гібридному стані. Тому вони проявляють високу реакційну здатність і реагують з водою, спиртами, кислотами (нуклеофільними сполуками)
Слайд 36
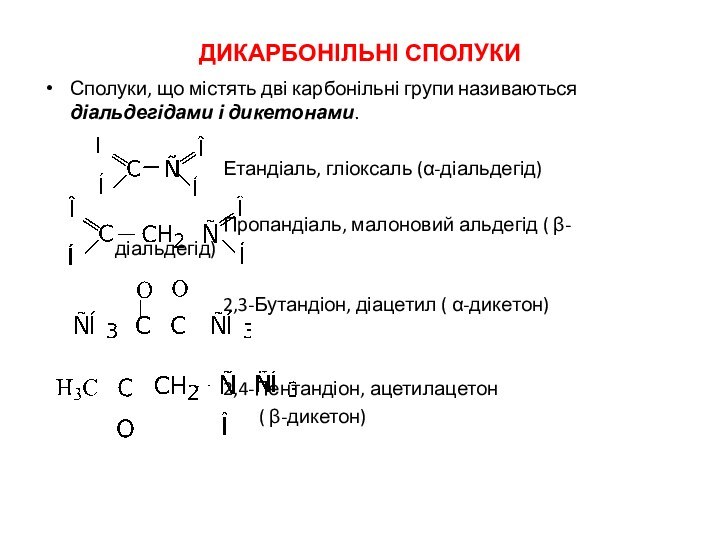
Дикарбонільні сполуки
Сполуки, що містять дві карбонільні групи називаються
діальдегідами і дикетонами.
Етандіаль, гліоксаль (α-діальдегід)
Пропандіаль, малоновий альдегід ( β- діальдегід)
2,3-Бутандіон, діацетил
( α-дикетон)
2,4-Пентандіон, ацетилацетон
( β-дикетон)
Слайд 37
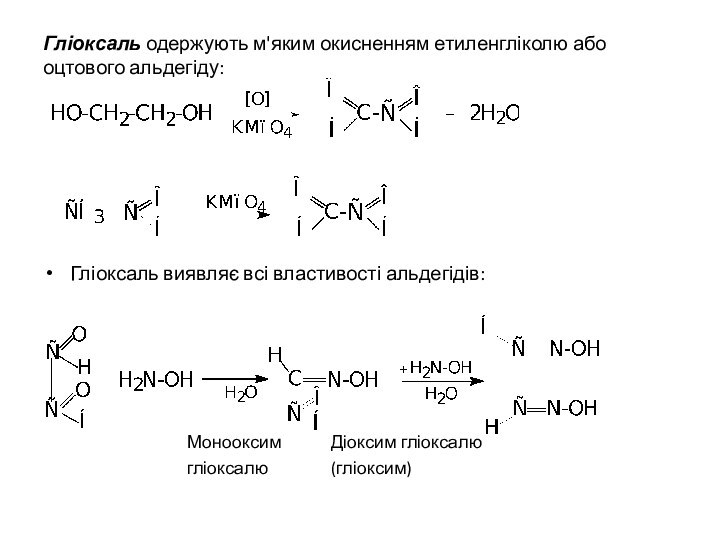
Гліоксаль одержують м'яким окисненням етиленгліколю або оцтового альдегіду:
Гліоксаль
виявляє всі властивості альдегідів:
Монооксим Діоксим гліоксалю
гліоксалю (гліоксим)
Слайд 38
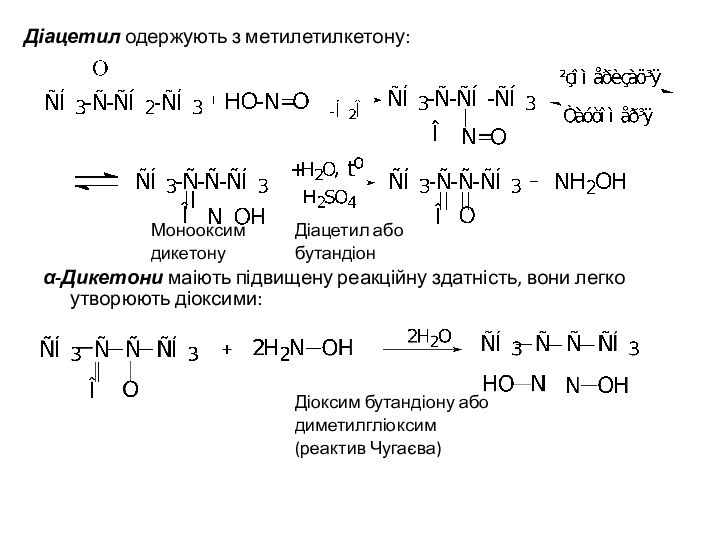
Діацетил одержують з метилетилкетону:
Монооксим Діацетил або
дикетону бутандіон
α-Дикетони маіють
підвищену реакційну здатність, вони легко утворюють діоксими:
Діоксим бутандіону або
диметилгліоксим
(реактив
Чугаєва)
Слайд 39
Диметилгліоксим застосовується як реактив на іони Ni2+ з
якими він утворює комплексну сполуку хелат - яскраво-червоного кольору: