- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Коррозия
Содержание
- 2. Коррозия конструкции Шуховской башни в Москве
- 3. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического
- 4. В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление».
- 5. Коррозия металлов
- 6. Ржавчина, самый распространенный вид коррозии.
- 7. Коррозия металлов — разрушение металлов вследствие химического или
- 8. Типы коррозии
- 9. Корриозный элемент При соприкосновении двух металлов с
- 10. Коориозия металла Если растворяющийся электрод коррозионно-стоек, процесс
- 11. Водородная и кислородная коррозия
- 12. Если происходит восстановление ионов H3O+ или молекул воды
- 13. Химическая коррозия
- 14. Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой,
- 15. Виды коррозии Некоторые виды (всего 36)
- 16. Газовая коррозияАтмосферная коррозияКоррозия при неполном погруженииКоррозия по
- 17. 1Коррозия ухудшает работу трубопроводов. 2Обрушение Серебряного моста.
- 18. Борьба с коррозией
- 19. Коррозия приводит ежегодно к миллиардным убыткам, и
- 20. Обычно выделяют три направления методов защиты от коррозии:1.Конструкционный2.Активный3.Пассивный
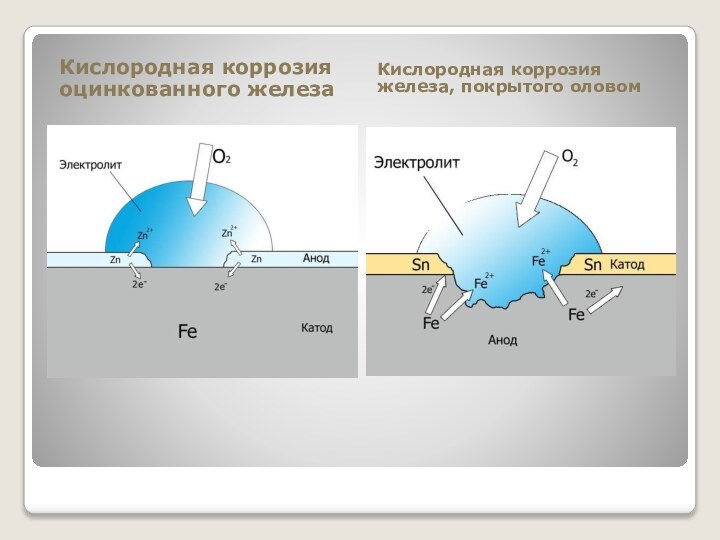
- 21. Кислородная коррозия оцинкованного железаКислородная коррозия железа, покрытого оловом
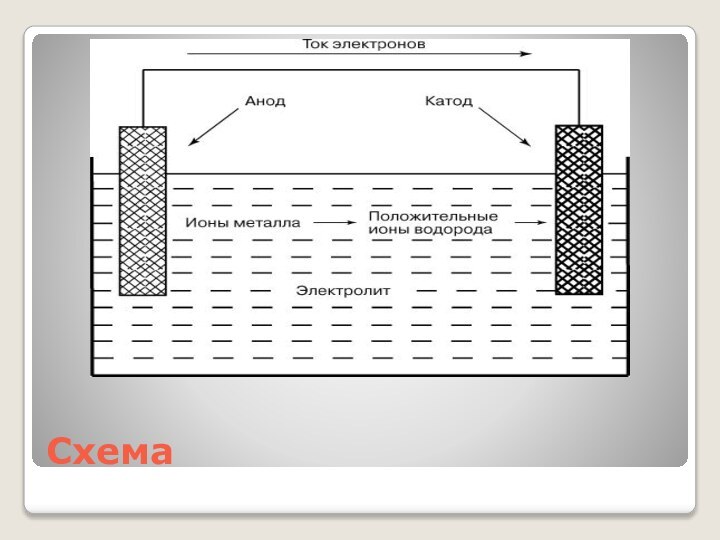
- 22. Схема
- 23. Скачать презентацию
- 24. Похожие презентации
Коррозия конструкции Шуховской башни в Москве





















Слайд 3 Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или
Слайд 4 В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее
известны случаи коррозии полимеров. Применительно к ним существует понятие «старение»,
аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.Слайд 7 Коррозия металлов — разрушение металлов вследствие химического или электрохимического
взаимодействия их с коррозионной средой. Для процесса коррозии следует
применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Слайд 9
Корриозный элемент
При соприкосновении двух металлов с различными
окислительно-восстановительными потенциалами и погружении их в раствор электролита, например,
дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Слайд 10
Коориозия металла
Если растворяющийся электрод коррозионно-стоек, процесс коррозии
замедляется. На этом основана, например, защита железных изделий от
коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.Слайд 12 Если происходит восстановление ионов H3O+ или молекул воды H2O,
говорят о водородной коррозии или коррозии с водородной деполяризацией.
Восстановление ионов происходит по следующей схеме:2H3O+ + 2e− → 2H2O + H2
или
2H2O + 2e− → 2OH− + H2
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
O2 + 2H2O + 4e− → 4OH−
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.
Слайд 14 Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не
сопровождающееся возникновением электрохимических процессов на границе фаз. В этом
случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:4Fe + 3O2 → 2Fe2O3
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде)
Слайд 16
Газовая коррозия
Атмосферная коррозия
Коррозия при неполном погружении
Коррозия по ватерлинии
Коррозия
при полном погружении
Коррозия при переменном погружении
Подземная коррозия
Биокоррозия
Коррозия внешним током
Коррозия
блуждающим токомКонтактная коррозия
Коррозия при трении
Слайд 19 Коррозия приводит ежегодно к миллиардным убыткам, и разрешение
этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией,
заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения. Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата является абразивоструйная очистка.





























