- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Лекции: ЭНЗИМОЛОГИЯ
Содержание
- 2. ЛЕКЦИЯ № 2КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
- 3. Актуальность темыНоменклатура и классификация ферментов – «путеводитель»
- 4. План лекцииНоменклатура ферментовКлассы ферментов:характеристика структурных единиц классификатора (классов, подклассов)примеры ферментов
- 5. Цель Знать:принципы номенклатуры и классификации ферментовхарактеристику классов
- 6. Номенклатура ферментовПротеазаАльдолазаЛипазаНуклеазаТривиальные названия: пепсин, трипсин, ренинНазвание субстрата + аза
- 7. Номенклатура IUBMBНоменклатура международного союза биохимии и молекулярной
- 8. Классы ферментовОснова деления ферментов на классы:тип катализируемой
- 9. Что означает кодовый номер фермента?КФ 1.1.1.1. Алкоголь:
- 10. Класс 1. Оксидоредуктазытип реакций: окислительно-восстановительныеподклассы и подподклассы
- 11. Группы оксидоредуктазОксидазыАэробные дегидрогеназыАнаэробные дегидрогеназыОксигеназыГидропероксидазы
- 12. Группы оксидоредуктаз: оксидазытип реакций: дегидрирование (отщепление водорода)акцептор
- 13. Группы оксидоредуктаз: аэробные дегидрогеназытип реакций: дегидрированиеакцептор водорода:
- 14. Группы оксидоредуктаз: анаэробные дегидрогеназытип реакций: дегидрированиеакцептор водорода: NAD+ , NADP+ , FMN, FAD
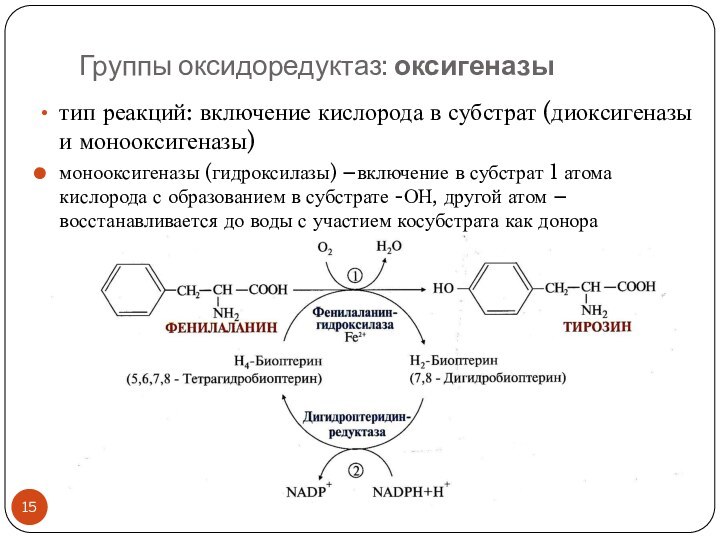
- 15. Группы оксидоредуктаз: оксигеназытип реакций: включение кислорода в
- 16. Монооксигеназы как ферменты микросомальной системы гидроксилирования (МСГ)цитохром
- 17. Механизм работы электронтранспортной цепи МСГ
- 18. Механизм работы электронтранспортной цепи МСГ (см. схему
- 19. Группы оксидоредуктаз: гидропероксидазыcубстрат: Н2О2продукт: Н2Оферменты: ГПО, каталазаПример:
- 20. Группы оксидоредуктаз: гидропероксидазыПример: каталаза«чемпион» катализакофактор: гем (Fe
- 21. Оксидоредуктазы - антиоксидантыАнтиоксиданты – ингибиторы свободно-радикального окисленияАктивные
- 22. Класс 2. Трансферазытип реакций: перенос функциональных групп
- 23. АминотрансферазыПример: аспартатаминотрансферазаКофермент: пиридоксальфосфат (vit В6)
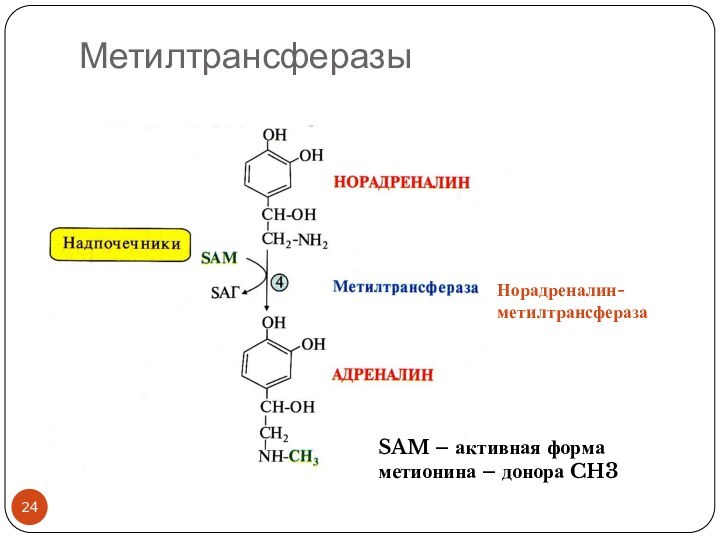
- 24. МетилтрансферазыSAM – активная форма метионина – донора CH3 Норадреналин-метилтрансфераза
- 25. Фосфотрансферазы (киназы)
- 26. Класс 3. Гидролазытип реакций: гидролиз (расщепление ковалентной
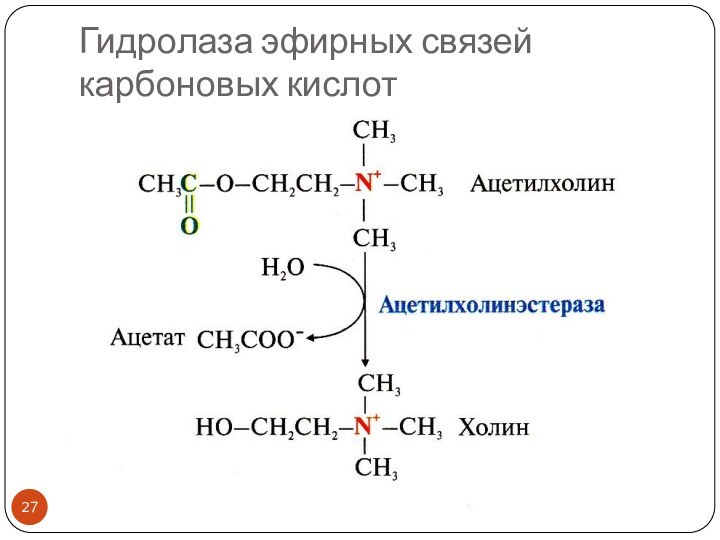
- 27. Гидролаза эфирных связей карбоновых кислот
- 28. Класс 4. Лиазытипы реакций:1) расщепление связей негидролитическим
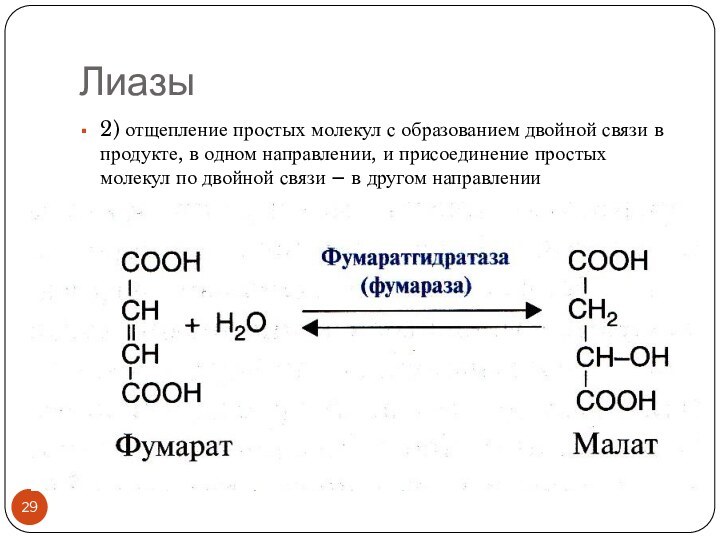
- 29. Лиазы2) отщепление простых молекул с образованием двойной
- 30. Класс 5. Изомеразытип реакций: внутримолекулярные превращения (образование
- 31. Внутримолекулярная трансфераза Внутримолекулярная оксидоредуктаза
- 32. Класс 6. Лигазы (синтетазы)тип реакций: соединение двух
- 33. С-С лигазыв реакции карбоксилирования участвует биотин (vit H)
- 34. С-N лигазыУниверсальная реакция обезвреживания аммиака в организме
- 35. C-S и C-O лигазыРеакция активации жирной кислотыРеакция активации аминокислоты в момент трансляции
- 36. Задание для самостоятельной работы1. Используя материал слайдов
- 37. ЗаключениеВ настоящее время число различных известных реакций,
- 38. Скачать презентацию
- 39. Похожие презентации
ЛЕКЦИЯ № 2КЛАССИФИКАЦИЯ ФЕРМЕНТОВ































![Лекции: ЭНЗИМОЛОГИЯ Литература1. Березов Т.Т. Биологическая химия: учебник для студ. мед. ВУЗов [Рекомендовано УМО]](/img/tmb/13/1269339/3cb12b9b35e35c38f3081a99f68ef18d-720x.jpg)
Слайд 4
План лекции
Номенклатура ферментов
Классы ферментов:
характеристика структурных единиц классификатора (классов,
подклассов)
примеры ферментов
Слайд 5
Цель
Знать:
принципы номенклатуры и классификации ферментов
характеристику классов ферментов
и основных подклассов
Уметь:
использовать знания о номенклатуре и классификации ферментов
для понимания сущности химических превращений, катализируемых основными ферментами организма человека, в том числе используемых в диагностике заболеванийприводить примеры реакций, характеризующих «работу» ферментов отдельных классов
Слайд 6
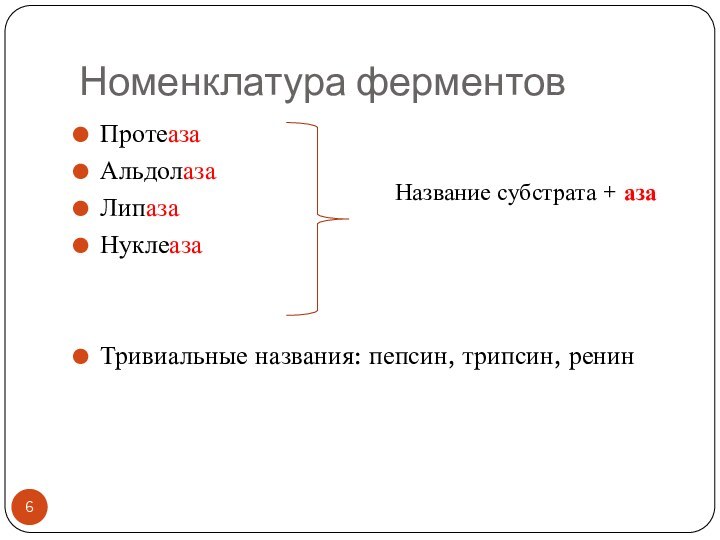
Номенклатура ферментов
Протеаза
Альдолаза
Липаза
Нуклеаза
Тривиальные названия: пепсин, трипсин, ренин
Название субстрата +
аза
Слайд 7
Номенклатура IUBMB
Номенклатура международного союза биохимии и молекулярной биологии
(1961 г)
Название фермента:
название субстрата (или субстратов) + тип
реакции + азаПРИМЕР:
алкоголь: NAD+ оксидоредуктаза (алкогольдегидрогеназа)
Слайд 8
Классы ферментов
Основа деления ферментов на классы:
тип катализируемой реакции
6
КЛАССОВ ФЕРМЕНТОВ :
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы
Классы
делят на подклассы, подподклассы Каждый фермент имеет кодовый номер
Слайд 9
Что означает кодовый номер фермента?
КФ 1.1.1.1. Алкоголь: NAD+
оксидоредуктаза (алкогольдегидрогеназа)
1 - Класс: оксидоредуктазы (реакции окисления-восстановления)
1 - Подкласс:
действующие на СН-ОН группу доноров1 - Подподкласс: с NAD+ в качестве акцептора
1 – Порядковый номер фермента в группе
CH3 CH2OH + NAD+ ↔ CH3CHO + NADH + H+
Слайд 10
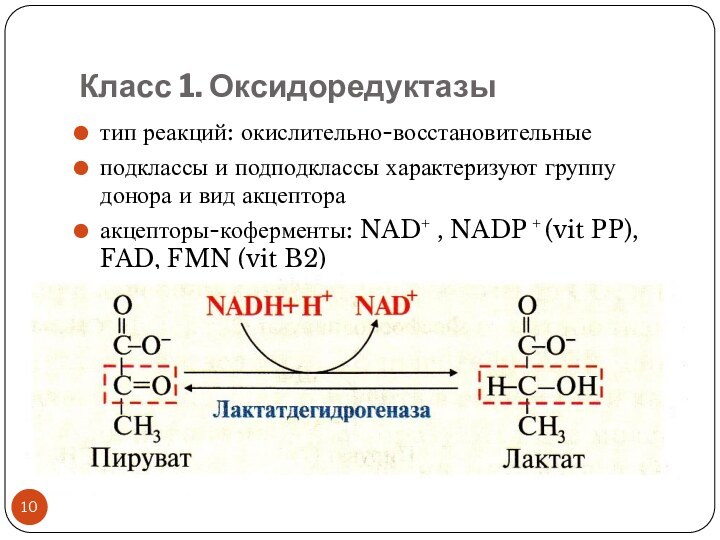
Класс 1. Оксидоредуктазы
тип реакций: окислительно-восстановительные
подклассы и подподклассы характеризуют
группу донора и вид акцептора
акцепторы-коферменты: NAD+ , NADP +
(vit PP), FAD, FMN (vit B2)
Слайд 11
Группы оксидоредуктаз
Оксидазы
Аэробные дегидрогеназы
Анаэробные дегидрогеназы
Оксигеназы
Гидропероксидазы
Слайд 12
Группы оксидоредуктаз: оксидазы
тип реакций: дегидрирование (отщепление водорода)
акцептор водорода:
кислород
продукт реакции: вода
кофакторы: медь, железо
ПРИМЕР: цитохромоксидаза
электроны, высвобождаемые из молекул
различных субстратов при их полном окислении в клетке, переносятся на кислород с образованием метаболический водыО2 + 4Н+ + 4 е- → 2Н2О
Fe 3+ + e- → Fe2+ / Fe 2+ - e- → Fe3+
Cu 2+ + e- → Cu 1+ / Cu 1+ - e- → Cu 2+
Слайд 13
Группы оксидоредуктаз:
аэробные дегидрогеназы
тип реакций: дегидрирование
акцептор водорода: кислород
продукт реакции:
Н2О2
простетическая группа: FMN, FAD
кофакторы: ионы металлов
ПРИМЕР: ксантиноксидаза (FAD, Mo2+,
Fe3+)ксантин + H2O + O2 → мочевая кислота + Н2О2
(реакция метаболизма пуриновых нуклеотидов)
Слайд 14
Группы оксидоредуктаз:
анаэробные дегидрогеназы
тип реакций: дегидрирование
акцептор водорода: NAD+ ,
NADP+ , FMN, FAD
Слайд 15
Группы оксидоредуктаз: оксигеназы
тип реакций: включение кислорода в субстрат
(диоксигеназы и монооксигеназы)
монооксигеназы (гидроксилазы) –включение в субстрат 1 атома
кислорода с образованием в субстрате -ОН, другой атом – восстанавливается до воды с участием косубстрата как донора электронов
Слайд 16
Монооксигеназы как ферменты микросомальной системы гидроксилирования (МСГ)
цитохром Р-450-содержащие
монооксигеназы микросом печени – ферменты метаболизма ксенобиотиков (например, лекарственных
препаратов)R-Н + О2 + 2Fe 2+ (Р-450) + 2H+ → R-ОН + Н2О + 2Fe 3+
R-H – субстрат окисления (ксенобиотик, гидрофобный)
R-OH – метаболит микросомального окисления (гидрофильный за счет образования -ОН, что способствует его выведению из организма)
Слайд 18 Механизм работы электронтранспортной цепи МСГ (см. схему слайда
17)
(1) Связывание в активном центре цитохрома Р450 вещества RH
активирует восстановление железа в геме - присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса P450-Fe2+·RH к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe2+O2--RH (4).На следующем этапе (5) Fe2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe3+O22-. Восстановленный атом кислорода (О2-) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-OH отделяется от фермента (7).
Слайд 19
Группы оксидоредуктаз: гидропероксидазы
cубстрат: Н2О2
продукт: Н2О
ферменты: ГПО, каталаза
Пример: глутатиопероксидаза
(ГПО)
кофермент-донор водорода: глутатион GS-H (трипептид: γ-глутамил-цистеинил-глицин)
кофактор: селен
Н2О2 + 2GS-H
→ 2Н2О + GSSG GS-H – восстановленный глутатион
GSSG – окисленный глутатион
Восстановление глутатиона после реакции обеспечивает глутатион редуктаза (донор водорода - NADPH)
Слайд 20
Группы оксидоредуктаз: гидропероксидазы
Пример: каталаза
«чемпион» катализа
кофактор: гем (Fe 3+)
роль: разложение перекиси водорода (сильнейший окислитель), образованной при действии
аэробных дегидрогеназ2Н2О2 → 2Н2О + О2
Чем отличается «работа» каталазы и ГПО?
Слайд 21
Оксидоредуктазы - антиоксиданты
Антиоксиданты – ингибиторы свободно-радикального окисления
Активные метаболиты
кислорода – окислители (НО•, Н2О2 , О2·- )
Ферменты-антиоксиданты: каталаза,
ГПО, СОДсупероксиддисмутаза (СОД)
О2·- + О2·- + 2Н+ → Н2О2 + О2
Реакция дисмутации супероксид-аниона довольно быстро протекает спонтанно, но супероксид ещё быстрее реагирует с NO, образуя пероксинитрит – сильнейший окислитель
Супероксиддисмутаза обладает самой высокой скоростью катализа
Слайд 22
Класс 2. Трансферазы
тип реакций: перенос функциональных групп с
одного субстрата на другой
подклассы характеризуют переносящую группу:
аминотрансферазы
метилтрансферазы
фосфотрансферазы (киназы) и
др.
Слайд 26
Класс 3. Гидролазы
тип реакций: гидролиз (расщепление ковалентной связи
с присоединением молекулы воды по месту разрыва)
Подклассы характеризуют тип
гидролизуемой связи:пептидазы (гидролиз пептидных связей): пепсин, трипсин
гликозидазы (гидролиз гликозидных связей): сахараза, лактаза, амилаза
гидролазы эфирных связей: эстеразы, липазы, фосфатазы
Слайд 28
Класс 4. Лиазы
типы реакций:
1) расщепление связей негидролитическим путем,
отщепление простых молекул (СО2, Н2О, NH2, SH2). Подклассы характеризуют
вид расщепляемой связи (C-C, C-N, C-O,C-S, P-O)в реакции декарбоксилирования аминокислот участвует кофермент пиридоксальфосфат (ПФ, vit B6)
Слайд 29
Лиазы
2) отщепление простых молекул с образованием двойной связи
в продукте, в одном направлении, и присоединение простых молекул
по двойной связи – в другом направлении
Слайд 30
Класс 5. Изомеразы
тип реакций: внутримолекулярные превращения (образование изомеров)
Подклассы:
рацемазы
(внутримолекулярные превращения субстрата, имеющего один хиральный атом углерода, например,
взаимопревращения L и D –изомеров) и эпимеразы (внутримолекулярные превращения субстратов, имеющих несколько хиральных атомов углерода)цис-транс-изомеразы
внутримолекулярные оксидоредуктазы (окисление одной части молекулы с одновременным восстановлением другой)
внутримолекулярные трансферазы
Слайд 32
Класс 6. Лигазы (синтетазы)
тип реакций: соединение двух субстратов
ковалентной связью (C-C, C-N, C-O,C-S) с образованием более сложного
соединения (синтез нового вещества, в структуру которого входят оба субстрата)подклассы характеризуют вид образуемой связи
реакции синтеза сопряжены с затратой энергии АТФ или ГТФ
!!! Не путать с синтазами (представители лиаз)
Слайд 35
C-S и C-O лигазы
Реакция активации жирной кислоты
Реакция активации
аминокислоты в момент трансляции
Слайд 36
Задание для самостоятельной работы
1. Используя материал слайдов 16,17,18
и материал учебника, объясните механизм работы и роль электронтранспортной
цепи микросомального окисления субстратов в печени2. Используя знания из курса химии, слайды 19,20,21, объясните понятие «свободно-радикальное окисление», «активные метаболиты кислорода», «ферменты-антиоксиданты». Назовите ферменты-антиоксиданты. Какие реакции они катализируют? К какому классу ферментов они относятся?
Слайд 37
Заключение
В настоящее время число различных известных реакций, катализируемых
ферментами, составляет около 2 тысяч и число их непрерывно
возрастает. Для того, чтобы ориентироваться в этом множестве биохимических превращений Международный союз биохимии и молекулярной биологии создал классификацию и номенклатуру ферментов.В основу классификации ферментов положен тип катализируемой реакции.
В основу номенклатуры – субстрат и тип реакции.