- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Лекция № 3, 4
Содержание
- 2. Биотехнологическая система ( БТС)- это технологический комплекс, создаваемый для производства определенного продукта путем биосинтеза.
- 3. Культура- это клетки или организмы, выращенные в
- 4. Клон- совокупность клеток или особей , произошедших
- 5. Основные компоненты БТСБиологический агентАппаратура для осуществления процесса
- 6. Преимущества производства органических продуктов биотехнологическими способами перед
- 7. Но вместе с тем биологические способы в
- 8. Схема типового биотехнологического процесса
- 9. СырьеШтамм продуцентПриготовление и стерилизация питательных средСтерилизация оборудования
- 10. К ЖОтделение биомассы от КЖ Клетки
- 11. КонцентрированиеСтабилизация продуктаСушкаСухой продуктЖидкий продуктСтандартизация и фасовкаХранение и применение
- 12. Основные стадии типового биотехнологического процессаПриготовление посевного материала
- 13. Вспомогательные стадии биотехнологического процессаСтерилизация оборудования и коммуникацийОчистка
- 14. В приведенной схеме типового биотехнологического процесса заложена
- 15. Если целевым продуктом являются вне- или внутриклеточные
- 16. 1. Штаммы продуцентов. Стадия приготовления посевного материала.Основным
- 17. В последние годы в
- 18. В России коллекции, обеспечивающие хранение генетического и
- 19. Основные коллекции (музеи) культур клеток (http://www.sevin.ru/collections)Национальный биоресурсный
- 20. БРЦ ВКПМ (при ФГУП ГосНИИгенетике)
- 21. Всероссийская коллекция непатогенных микроорганизмов - ВКМ (VKM)
- 22. Коллекция микроорганизмов III и IY групп патогенности
- 23. Всероссийская коллекция клеток высших растений (ВКК-ВР) ( Институт
- 24. В музейных коллекциях культуры клеток хранят в
- 25. Музейные культуры клеток продуцентов оживляют путем высева
- 27. Первым этапом биотехнологического процесса является получение посевного
- 28. При необходимости получения больших количеств посевного материала,
- 29. По своей конструкции и технологической оснащенности инокулятор
- 30. 2. Стадия приготовления питательных средВ производственных
- 31. Растворы сахаров, нуждающиеся в более щадящих режимах
- 32. Питательные среды обычно готовят в концентрированном виде.
- 33. Клетки микроорганизмов, а так же их споры
- 34. Тепловую стерилизацию питательных сред (по способу ее
- 35. При непрерывном способе стерилизации каждый элементарный процесс
- 36. Непрерывное нагревание среды может быть осуществлено без
- 37. 3. Ферментация – основная стадия биотехнологического процессаНа
- 38. Принципиальная технологическая схема глубинного культивирования микроорганизмов
- 39. 1 - смеситель питательной среды; 2 -
- 40. Перед началом производственного процесса пустой ферментатор тщательно
- 41. Конструкция типового ферментатора
- 42. Типовой ферментатор для глубинного стерильного выращивания культур
- 43. Ферментаторы для глубинного асептического культивирования клеток продуцентов
- 44. Ферментеры оборудованы арматурой и трубопроводами для подачи
- 45. Для предотвращения попадания нестерильного атмосферного воздуха в
- 46. Продолжительность культивирования микроорганизмов в ферментерах составляет в
- 47. Лабораторный ферментатор (Infors)
- 48. Лабораторные ферментаторы Minifors (Бактериальные/Культуральные) – 2,5 или
- 49. Minifors для клеточных культур аналогичен ферментатору Minifors
- 50. Контроль и управление процессами культивированияОсновной задачей управляемого
- 51. Основными управляющими воздействиями для поддержания и корректировки
- 52. Дозирование субстратов Как уже отмечалось насосы, трубопроводы
- 53. По окончании ферментации КЖ охлаждают до 10-15
- 54. Технология выделения и очистки целевого биотехнологического продукта
- 55. Основная масса товарной продукции выпускается биотехнологической промышленностью
- 56. Назначение вспомогательных стадий биотехнологического процесса (стерилизация оборудования
- 57. На вспомогательных стадиях, таких как стерилизация пеногасителей
- 58. На вспомогательных стадиях, таких как очистка и
- 59. Сжатый стерильный воздух необходим не только для
- 60. Очистку воздуха можно осуществить принципиально разными методами,
- 61. Промышленная схема очистки воздуха 1 - фильтр;
- 62. 1 предварительная ступень очистки воздухаАтмосферный воздух через
- 63. 2 ступень очистки воздуха – очистка сжатого
- 64. Недостатки ФГО: невоспроизводимость укладки фильтрующего материала; уплотнение
- 65. 3 ступень фильтрации воздуха – «стерилизующая» фильтрация(эффективность
- 66. Разработаны индивидуальные ФП, стойкие к высоким температурам.
- 67. Типовые конструкции фильтров а) ФГО: 1 -
- 68. Известны эффективные металлокерамические фильтрующие элементы для очистки
- 69. Скачать презентацию
- 70. Похожие презентации
Биотехнологическая система ( БТС)- это технологический комплекс, создаваемый для производства определенного продукта путем биосинтеза.





























































Слайд 2
Биотехнологическая система ( БТС)
- это технологический комплекс, создаваемый
для производства определенного продукта путем биосинтеза.
Слайд 3
Культура
- это клетки или организмы, выращенные в искусственных
условиях.
Штамм- это культура одного вида микроорганизмов, выделенная из разных мест обитания.
Слайд 4
Клон
- совокупность клеток или особей , произошедших от
общего предка путем бесполого размножения.
Популяция
(от лат. populus
- народ, население)- совокупность особей одного вида, обладающих
общим генофондом и занимающих определённую территорию.
Слайд 5
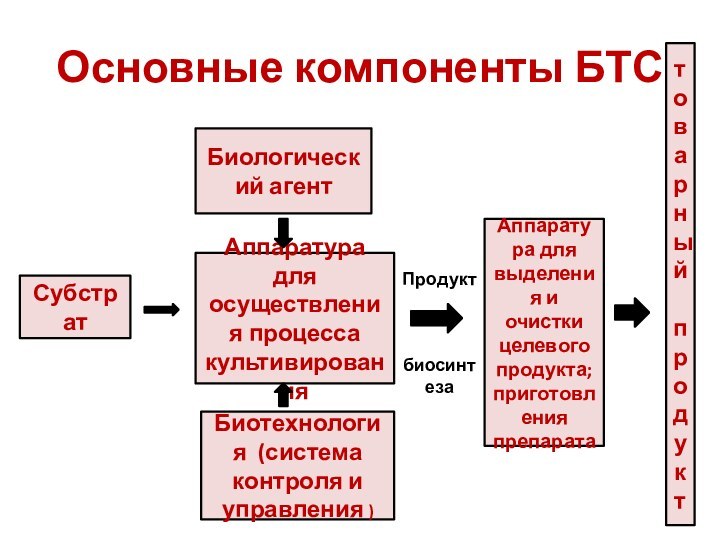
Основные компоненты БТС
Биологический агент
Аппаратура для осуществления процесса культивирования
Биотехнология
(система контроля и управления )
Субстрат
Аппаратура для выделения и очистки
целевого продукта; приготовления препарата Продукт
биосинтеза
товарный
продукт
Слайд 6 Преимущества производства органических продуктов биотехнологическими способами перед химическими
методами
1. Многие сложные органические молекулы, такие как белки, антибиотик
и др., практически не могут быть синтезированы химическими способами.2. Биоконверсия обеспечивает значительно больший выход целевого продукта.
3. Биологические системы функционируют при более низких температурах, менее высоких значениях рН (близких к нейтральному) и т. п.
4. Каталитические биологические реакции намного специфичнее, чем реакции химического катализа.
5. Биологические процессы обеспечивают почти исключительно продукцию чистых изомеров одного типа, а не их смесей, как это часто бывает в реакциях химического синтеза.
Слайд 7 Но вместе с тем биологические способы в сравнении
с химическими методами обладают рядом недостатков:
1. Биологические системы могут
легко быть загрязнены посторонней нежелательной микрофлорой.2. Целевой продукт, синтезируемый биологическим способом, присутствует в довольно сложной смеси, что обусловливает необходимость отделения его от примеси ненужных веществ.
3. Биотехнологические производства требуют больших количеств воды, которую в итоге необходимо удалять, сбрасывая в окружающую среду.
4. Биопроцессы обычно идут медленнее в сравнении со стандартными химическими процессами.
Слайд 9
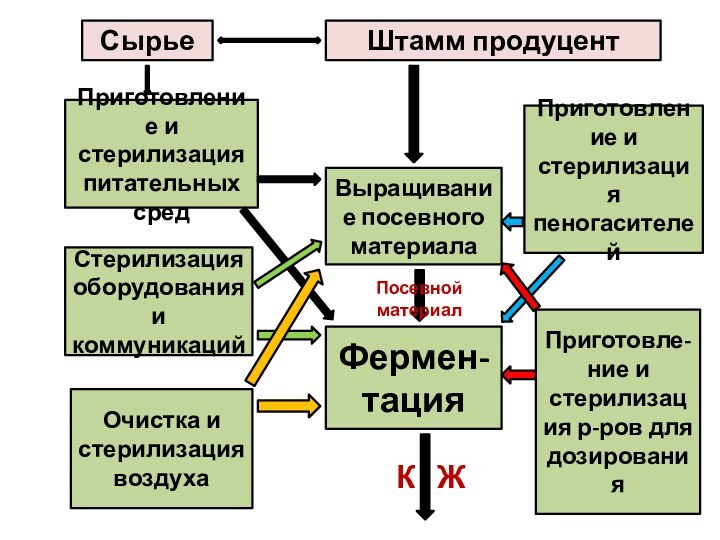
Сырье
Штамм продуцент
Приготовление и стерилизация питательных сред
Стерилизация оборудования и
коммуникаций
Очистка и стерилизация воздуха
Выращивание посевного материала
Фермен-
тация
Приготовление и
стерилизация пеногасителейПриготовле-ние и стерилизация р-ров для дозирования
Посевной материал
К Ж
Слайд 10
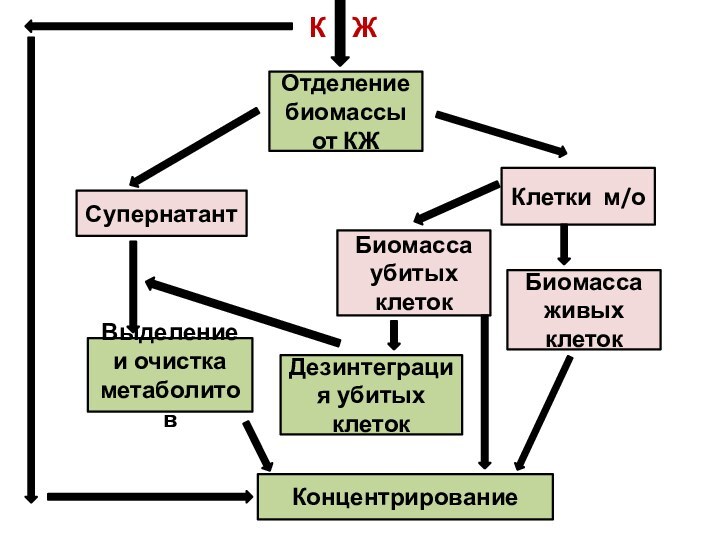
К Ж
Отделение биомассы от КЖ
Клетки м/о
Биомасса
живых клеток
Супернатант
Биомасса убитых клеток
Выделение и очистка метаболитов
Дезинтеграция убитых
клеток Концентрирование
Слайд 11
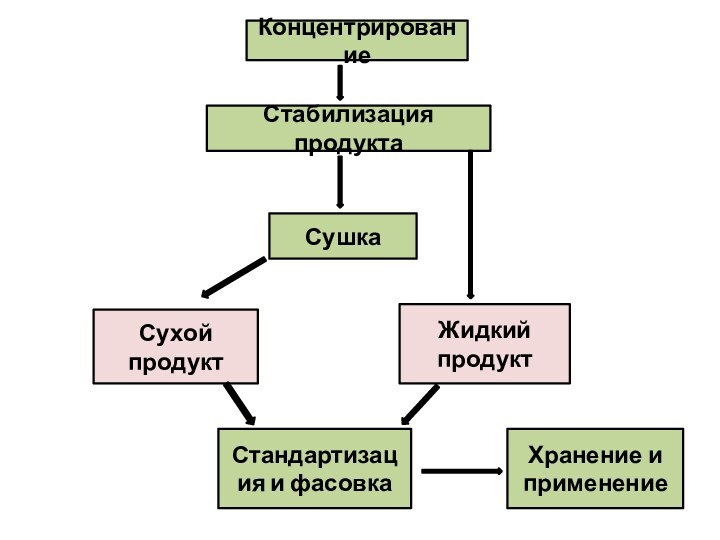
Концентрирование
Стабилизация продукта
Сушка
Сухой продукт
Жидкий продукт
Стандартизация и фасовка
Хранение и применение
Слайд 12
Основные стадии типового биотехнологического процесса
Приготовление посевного материала с
использованием определенного штамма-продуцента
Приготовление и стерилизация питательных сред
ФЕРМЕНТАЦИЯ
Выделение целевого продукта
и получение его товарной формы
Слайд 13
Вспомогательные стадии биотехнологического процесса
Стерилизация оборудования и коммуникаций
Очистка и
стерилизация воздуха
Приготовление и стерилизация пеногасителей и других различных добавок
Слайд 14 В приведенной схеме типового биотехнологического процесса заложена возможность
комплексной переработки КЖ (организация безотходного производства). При проектировании новых
биотехнологических производств эта возможность должна быть реализована.Отработанный пар и теплый очищенный после ферментации и обогащенный углекислым газом воздух целесообразно направлять в теплицы (позволяет на 20-25% увеличить урожай овощных тепличных культур). Теплая техническая вода после охлаждения ферментеров используется вторично, после чего ее можно пускать в бассейны для разведения рыбы или др.
Слайд 15 Если целевым продуктом являются вне- или внутриклеточные метаболиты,
то биомассу клеток после ее убивки (либо дезинтеграции и
убивки) и частичной предобработки можно направлять на корм скоту, использовать в качестве сельскохозяйственного удобрения или сырья в других биотехнологических процессах. Грибной мицелий можно добавлять в строительные материалы (например, кирпич) – при этом увеличивается его прочность ( как перспектива). Из мицелия можно извлекать отдельные фракции и использовать для определенных целей.Если целевым продуктом является биомасса клеток, то фильтрат КЖ (супернатант) после очистки и концентрирования можно также использовать как добавку в корм скоту или удобрение.
Слайд 16
1. Штаммы продуцентов. Стадия приготовления посевного материала.
Основным элементом
любого биотехнологического процесса является штамм-продуцент
Все промышленно важные продуценты биологически
активных веществ (БАВ) хранят в национальных музейных коллекциях культур клетокСлайд 17 В последние годы в связи
с бурным развитием биотехнологии резко меняется ситуация с сохранением
генетических ресурсов в коллекцияхВо-первых, появляются новые виды генетических ресурсов - библиотеки генов и ДНК.
Во-вторых, резко возрастает количество ресурсов, создаваемых в процессе научной деятельности.
В-третьих, генетический материал самых различных организмов активно используется для создания новых лекарственных препаратов, биотехнологий и прочих товаров и услуг, что существенно расширяет круг объектов, включаемых в понятие генетические ресурсы, и существенно повышает их экономическую ценность.
Слайд 18 В России коллекции, обеспечивающие хранение генетического и биологического
материала, представлены самостоятельными специализированными организациями - Ботанические сады РАН;
структурные подразделения научно-исследовательских организаций (коллекции микроорганизмов и клеточных культур); рабочие коллекции лабораторий, ведущих исследования в области генетики и селекции; а также рядом организаций, для которых хранение генетического материала не является основной функцией (питомники, зверофермы, зоопарки и т.п.). Эти организации принадлежат различным ведомствам (в т.ч. РАН, РАМН, РАСХН, Минсельхоз России, Минобразования и науки России, Минздрав России, Минобороны России).
Слайд 19
Основные коллекции (музеи) культур клеток (http://www.sevin.ru/collections)
Национальный биоресурсный центр
- Всероссийская коллекция промышленных микроорганизмов (БРЦ ВКПМ) – крупнейшая
национальная сервисная коллекция, в которой депонированы (хранение, гарантийное хранение, национальное патентное депонирование, международное патентное депонирование) культуры бактерий (включая стрептомицеты), низших грибов (включая дрожжи), бактериофагов, плазмид (в хозяйских клетках и/или в виде изолированной ДНК), культуры клеток растений, животных и человека.Слайд 20 БРЦ ВКПМ (при ФГУП ГосНИИгенетике) имеет
статус Международного депозитария.
В своей деятельности руководствуется
правилами Будапештского договора о международном признании депонирования культур для целей патентной процедуры (т.е. для защиты прав депозитора).Слайд 21 Всероссийская коллекция непатогенных микроорганизмов - ВКМ (VKM) (Институт
биохимии и физиологии микроорганизмов им. Г.К.Скрябина РАН)
Государственная коллекция патогенных
микроорганизмов (Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича (ГИСК))Слайд 22 Коллекция микроорганизмов III и IY групп патогенности (Научно-исследовательский
институт вакцин и сывороток им. И.И.Мечникова РАМН)
Государственная коллекция вирусов
(Научно-исследовательский институт вирусологии им. Д.И.Ивановского РАМН – ГКВ)Российская коллекция клеточных культур позвоночных (Институт цитологии РАН)
Слайд 23 Всероссийская коллекция клеток высших растений (ВКК-ВР) ( Институт физиологии
растений им. К. А. Тимирязева, РАН)
ATCC - American Type
Culture Collection - Американская коллекция типовых культур (не только микроорганизмов, но и множества клеточных линий и штаммов). ATCC - это американский банк биоматериалов, который активно используется во всем мире для научных и исследовательских работ по микробиологии. Слайд 24 В музейных коллекциях культуры клеток хранят в основном
в лиофилизированном состоянии (предварительно поместив их в защитные среды
/сахарозо-желатиновая, обезжиренное молоко, бычья или лошадиная сыворотки или др./) в течение 10-30 лет.Для консервации продуцентов применяют также такие способы, как хранение культур под слоем минерального масла, в стерильной почве, в кварцевом песке, в активированном угле, на высушенных питательных субстратах и др.
Слайд 25 Музейные культуры клеток продуцентов оживляют путем высева на
агаризованные обогащенные питательные среды. После нескольких пассажей (пересевов) культуры
уже используют для хранения и в качестве исходного посевного материала в производственном процессе.По графику проводят контроль чистоты и продуктивности хранящихся в лаборатории культур клеток продуцентов.
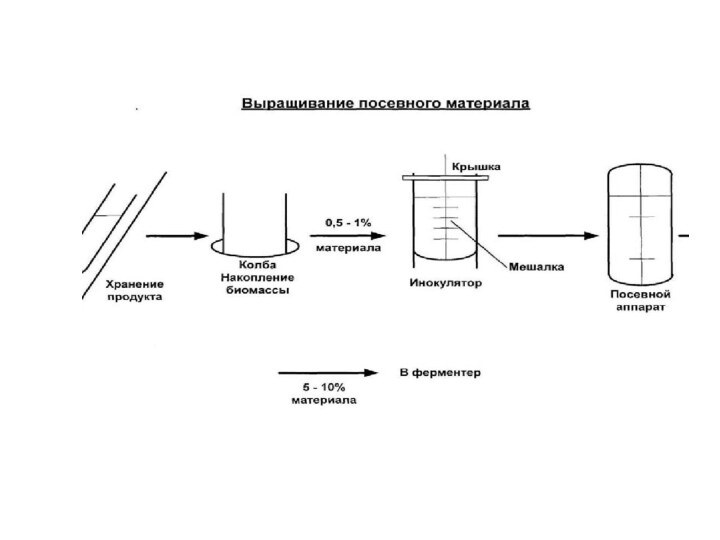
Слайд 27 Первым этапом биотехнологического процесса является получение посевного материала
в лабораторных условиях. Для этого смыв культуры продуцента со
скошенной агаризованной питательной среды (с косяка) стерильно переносят в качалочные колбы (колбы Эрленмейера, 750 мл), заполненные на 50-100 мл стерильной посевной питательной средой. Засеянные колбы устанавливают на микробиологическую качалку (180-220 об/мин) и культуру продуцента выращивают в течение 12-48 ч при оптимальной для нее температуре.Выросший в колбах жидкий стерильный посевной материал переносят в предварительно загруженные стерильной питательной средой посевные аппараты (инокуляторы) из расчета 1-10% от общего объема питательной среды.
Слайд 28 При необходимости получения больших количеств посевного материала, его
выращивают в несколько стадий на колбах и/или в нескольких
инокуляторах возрастающего объема. Количество стадий выращивания посевного материала зависит от объема ферментаторов и от расхода посевного материала. Как правило, используют инокуляторы объемом от 0,1 до 10 м3. На каждой стадии получения посевного материала его контролируют микроскопированием и на стерильность.Среда для выращивания посевного материала обычно не совпадает по составу с ферментационной средой, т.е. при выращивании посевного материала среда должна быть обогащена для быстрого роста биомассы.
Полученный на последней стадии вегетативный посевной материал стерильно передают в ферментатор, загруженный стерильной ферментационной средой.
Слайд 29 По своей конструкции и технологической оснащенности инокулятор (посевной
аппарат) для культивирования аэробных микроорганизмов аналогичен основному ферментеру.
Как и
в ходе основной ферментации, при выращивании посевного материала в инокуляторах осуществляют аэрацию и перемешивание среды, регулирование температуры и pH, пеногашение.В инокуляторах, как и в промышленных ферментерах, целесообразно поддерживать незначительное избыточное давление воздуха. Тогда случайные утечки будут происходить только в направлении из системы, а не наоборот, что значительно облегчает поддержание асептических условий.
Слайд 30
2. Стадия приготовления
питательных сред
В производственных условиях питательные
среды обычно готовят в отдельном цехе, обеспечивающем потребности всех
цехов предприятия.Питательные среды готовят в специальных емкостях (смесители), снабженных мешалками и теплообменными устройствами для подогрева и лучшего растворения компонентов среды.
Компоненты питательных сред загружают в смесители в определенной последовательности (согласно прописи).
При необходимости отдельные виды сырья подвергают предобработке: измельчению, экстрагированию и т. д.
Слайд 31 Растворы сахаров, нуждающиеся в более щадящих режимах стерилизации,
рекомендуют готовить и стерилизовать отдельно, смешивая с основной средой
только в ферментере.Качество воды, используемой для приготовления питательных сред, зависит от ее назначения. Чаще всего применяют артезианскую, реже - водопроводную воду. В крупнотоннажных производствах кормовых дрожжей и белково-витаминных концентратов (БВК) используют воду, полученную по замкнутому циклу этого производства, то есть прошедшую очистные сооружения. В производстве кровезаменителей и лекарственных препаратов используют только апирогенную воду (бидистиллят).
Слайд 32 Питательные среды обычно готовят в концентрированном виде. Особое
внимание уделяют тщательному измельчению твердых компонентов среды и полному
растворению остальных составляющих. Это необходимо для обеспечения надежности стерилизации и облегчения потребления культурами клеток компонентов питательных сред.Приготовленную питательную среду подвергают стерилизации. Под стерилизацией сред обычно понимают любой метод воздействия, обеспечивающий удаление из среды микробов - контаминантов или их разрушение (гибель).
Наиболее распространенным и универсальным методом стерилизации является метод, основанный на использовании высоких температур.
Слайд 33 Клетки микроорганизмов, а так же их споры более
чувствительны к тепловому воздействию, чем большинство химических веществ, используемых
в питательных средах.На практике главная цель стерилизации - достижение стерильности при сохранении качества питательной среды.
Длительность экспозиции, или время выдержки – это тот временной интервал, в пределах которого погибают микроорганизмы, но сохраняется качество питательной среды.
Слайд 34 Тепловую стерилизацию питательных сред (по способу ее проведения)
подразделяют на периодическую и непрерывную
При периодическом способе стерилизации
процессы - нагрев, выдержка и охлаждение среды - протекают последовательно во времени в одном аппарате. Это может быть ферментер, посевной аппарат или специальный стерилизатор. Весь объем среды нагревают в аппарате до заранее выбранной температуры, выдерживают при этой температуре строго определенное время и охлаждают водой, подаваемой в рубашку аппарата или змеевик. Сам процесс нагрева осуществляют либо путем прямого введения (инжекции) струи перегретого пара с температурой до 130-135 С в питательную среду («острый» пар), либо подачей пара в тепловую рубашку аппарата («глухой» пар).Слайд 35 При непрерывном способе стерилизации каждый элементарный процесс -
нагрев, выдержка и охлаждение - осуществляется в специально предназначенных
для этого апаратах: нагревателе, выдерживателе, теплообменнике, которые составляют систему аппаратов для непрерывной стерилизации – установку непрерывной стерилизации (УНС).На практике чаще используют непрерывный способ стерилизации питательных сред в УНС. Для этого приготовленную питательную среду передают в цех ферментации, где ее стерилизуют в УНС, после чего она поступает в предварительно простерилизованные ферментеры.
Слайд 36 Непрерывное нагревание среды может быть осуществлено без прямого
контакта с теплоносителем в трубчатом, пластинчатом или спиральном теплообменнике,
который встроен в стерилизатор или стоит перед ним. Но чаще всего среда нагревается до нужной температуры в течение нескольких секунд прямым введением (инжектированием) перегретого пара (130-135 С), полученного в паровых контактных нагревателях («острого» пара).Для стерилизации небольших объемов растворов используют фильтрование через специальные фильтры-мембраны, задерживающие бактериальные клетки, а иногда и вирусы. Обычно этот способ используют для стерилизации растворов веществ, неустойчивых к нагреванию, а так же готовых форм продуктов (например лекарственных веществ белковой природы).
Твердые сыпучие среды, используемые для поверхностного способа культивирования, стерилизуют паром, иногда инфракрасными или γ-лучами.
Слайд 37
3. Ферментация – основная стадия биотехнологического процесса
На стадии
ферментации осуществляется накопление целевого продукта - биомассы и продуктов
метаболизма.В настоящее время наиболее распространенным является периодическое культивирование клеток продуцентов в асептических аэробных условиях на жидких питательных средах (глубинная ферментация).
Ферментацию обычно проводят в биореакторах объемом от 0,01 до 100 м3.
Слайд 39
1 - смеситель питательной среды;
2 - колонка
для непрерывной стерилизации потока питательной среды;
3 - теплообменник-выдерживатель;
4 - теплообменник для охлаждения потока питательной среды (холодильник);
5 - инокуляторы (или посевные аппараты);
6 - индивидуальный фильтр для очистки воздуха;
7 - ферментер;
8,9 - насосы;
10 - фильтр для предварительной очистки воздуха;
11 - компрессор;
12 - головной фильтр для очистки воздуха (ФГО).
Слайд 40 Перед началом производственного процесса пустой ферментатор тщательно моют,
проверяют его герметичность и стерилизуют «острым» паром. Для обеспечения
стерильности часто используют предварительную обработку ферментера химическими дезинфицирующими веществами. Одновременно стерилизуют все прилегающие коммуникации. Датчики КИПиА подвергают «холодной» стерилизации.Затем в ферментер подают простерилизованную в УНС (или другим способом) охлажденную питательную среду, стерильно вносят посевной материал (1-10%) от общего объема питательной среды, подключают системы аэрации и перемешивания. Температура и pH питательной среды до подачи посевного материала должны быть доведены до оптимальных для данной культуры значений.
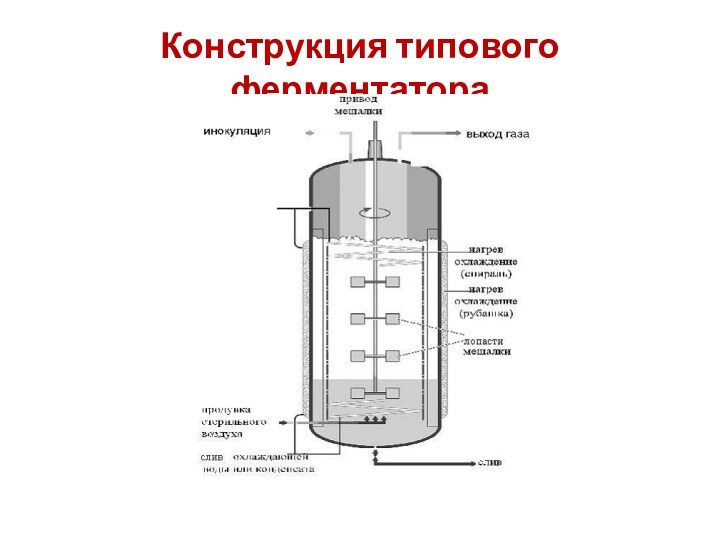
Слайд 42 Типовой ферментатор для глубинного стерильного выращивания культур продуцентов
оснащен:
- электродвигателем;
- торцевым уплотнением для
обеспечения герметичности при вводе вала мешалки в ферментер;- редуктором для вращения вала, на котором установлена трехъярусная мешалка;
- трехъярусной мешалкой;
- отбойниками (отражательные перегородки, предотвращающие вращательное движение перемешиваемой культуральной жидкости и улучшающие массообмен) ;
- теплообменными устройствами в виде секционной рубашки и змеевиков (для отвода тепла, выделяющегося при микробиологическом синтезе и механическом перемешивании) ;
- барботером для подачи аэрирующего воздуха (кольцевидный или радиальный).
Слайд 43 Ферментаторы для глубинного асептического культивирования клеток продуцентов обычно
представляют собой герметичные цилиндрические емкости из нержавеющей стали, высота
которых в 2,0-2,5 раза превышает диаметр. В ферментерах устанавливают мешалки турбинного, пропеллерного или другого типа. Диаметр мешалки должен составлять одну треть диаметра ферментера. Широко распространены конструкции ферментеров с мешалками, под которыми находятся радиальные (лучевые) или кольцевидные барботеры.Для поддержания оптимальной температуры роста продуцентов в ферментерах имеется двойной кожух (рубашка) и/или теплообменники типа змеевиков.
Слайд 44 Ферментеры оборудованы арматурой и трубопроводами для подачи питательной
среды, посевного материала, воды, пара, воздуха, растворов для регулирования
pH (титрантов), пеногасителей и других материальных потоков.Современные ферментеры укомплектованы измерительными приборами и регулирующими устройствами. Аппараты оборудованы смотровыми люками, устройствами для пеногашения и др.
Рабочий объем ферментеров обычно составляет Кз=0,6-0,7 от общего их объема, для аэрлифтных конструкций Кз=0,3-0,4. Свободное пространство над поверхностью культуральной жидкости (КЖ) используется как буферное, где накапливается пена и таким образом предотвращаются потери КЖ (унос КЖ с воздухом).
Слайд 45 Для предотвращения попадания нестерильного атмосферного воздуха в ферментер,
давление воздуха над поверхностью КЖ повышают на 20-30 кПа.
При необходимости вводят химические пеногасители.В периоды интенсивного вспенивания КЖ в ферментер вносят стерильный пеногаситель. Для пеногашения используют поверхностно-активные вещества (ПАВ), которые подразделяются на жировые (природные масла и др.) и синтетические (силиконы, пропинолы и др.).
Кроме химических пеногасителей для
уменьшения столба пены используют также
механические приспособления.
Слайд 46 Продолжительность культивирования микроорганизмов в ферментерах составляет в среднем
18-48 ч для большинства бактерий и 200-250 ч –
для актиномицетов и микроскопических грибов.Во время ферментации автоматически регулируются температура, pH среды и некоторые другие параметры.
По специальному графику из ферментера стерильно проводят отбор проб КЖ.
Завершение процесса ферментации определяют по морфологическим изменениям клеток продуцента, потреблению компонентов питательной среды и максимальному накоплению конечного полезного продукта.
Слайд 48 Лабораторные ферментаторы Minifors (Бактериальные/Культуральные) – 2,5 или 5
л.
Сосуд ферментера Minifors изготовлен из термостойкого боросиликатного стекла.
Minifors оборудован устройствами для измерения и регулирования температуры, pH среды, скорости вращения мешалки. Возможна комплектация дополнительным датчиком концентрации растворённого кислорода, сигнализатором уровня пены и приспособлением для химического пеногашения, а также устройством подачи О2 и СО2, резервуарами для хранения компонентов питательной среды и насосами для их непрерывной подачи в ферментер.
Слайд 49 Minifors для клеточных культур аналогичен ферментатору Minifors бактериальному
(для бактерий/дрожжей/грибов), но обеспечивает более мягкое перемешивание за счет
перемешивающего элемента типа «морской винт» (наклонный лопастной) и отсутствия отбойников на корпусе сосуда при скорости вращения мешалки в пределах 30-300 об/мин.
Слайд 50
Контроль и управление процессами культивирования
Основной задачей управляемого культивирования
является создание наиболее благоприятных условий для растущих культур продуцентов.
Однако непосредственно изучить состояние культуры клеток в промышленном аппарате не представляется возможным. Поэтому физиологическое состояние культуры продуцента во время ферментации оценивают косвенно по различным параметрам:
- скорости роста культуры продуцента,
- потреблению кислорода и различных субстратов,
- выделению углекислого газа и других продуктов метаболизма (в том числе целевых),
- скорости подкисления или защелачивания КЖ (по значению рН),
- тепловыделению и т.д.
Слайд 51 Основными управляющими воздействиями для поддержания и корректировки режима
культивирования являются режим аэрации и перемешивания, подача теплоносителя, регулировка
величины рН, поддержание уровня пены, скорость дозирования субстрата.Одной из проблем промышленной биотехнологии является отсутствие специализированных датчиков, поскольку общепромышленная номенклатура приборов и средств автоматизации, зачастую, не соответствует асептическим условиям процессов, не выдерживает многократной термической стерилизации, не может работать в сложных по составу ферментационных средах, включающих биомассу, пузырьки воздуха, жировые компоненты, жидкие эмульсии и твердые частицы.
Слайд 52
Дозирование субстратов
Как уже отмечалось насосы, трубопроводы и
запорная
арматура - “узкое” место биотехнологического производства.
В условиях асептических
производств лучшими дозирующими насосами являются перистальтические или мембранные, в которых рабочий орган взаимодействует с жидкостью через непроницаемую мембрану. Возможно дозирование и без насосов, с помощью дозировочных бачков. При этом давление в линиях должно на 1,5-2 атм превышать давление в ферментере.
Слайд 53 По окончании ферментации КЖ охлаждают до 10-15 С
и перекачивают в резервуары, из которых КЖ постепенно передают
на дальнейшую обработку.На всех последующих за ферментацией стадиях не происходит прироста целевого продукта, а проводится только его обработка.
Цель стадий выделения и очистки любого биотехнологического продукта – получение необходимой товарной формы препарата при минимальных потерях целевого продукта.
Слайд 54 Технология выделения и очистки целевого биотехнологического продукта зависит
от:
- вида продукта (биомасса или целевые метаболиты)
- локализации продукта (в клетках или в фильтрате КЖ)- физико-химических свойств целевого продукта
Слайд 55 Основная масса товарной продукции выпускается биотехнологической промышленностью в
двух формах (согласно типовой схеме):
- сухой продукт
(порошок, гранулы, мелкодисперсные частицы или др.)
- жидкий продукт (концентраты с
содержанием сухих веществ до 50%).
Слайд 56 Назначение вспомогательных стадий биотехнологического процесса (стерилизация оборудования и
коммуникаций, очистка и стерилизация воздуха, приготовление и стерилизация пеногасителей
и др.) – обеспечение асептических условий проведения ферментации.Все последующие за ферментацией стадии обычно проводят в нестерильных условиях (за исключением биофармацевтических производств).
Слайд 57 На вспомогательных стадиях, таких как стерилизация пеногасителей и
др. добавок, стерилизация оборудования и коммуникаций, используют термическую стерилизацию,
при которой погибают как вегетативные клетки, так и споры.Практическая реализация термической стерилизации зависит прежде всего от стерилизуемого объекта. Так, пустые аппараты и коммуникации обычно стерилизуют насыщенным водяным паром под давлением, различные жидкие среды – путем нагревания под давлением.
Коррозионно неустойчивое оборудование и приборы стерилизуют с использованием химических антисептических средств или обработкой газами (например, окисью этилена в смеси с СО2 или бромистым метилом), спиртом или др.
Наибольшим бактерицидным эффектом обладает насыщенный водяной пар под давлением!
Слайд 58 На вспомогательных стадиях, таких как очистка и стерилизация
воздуха используют метод фильтрации.
Одной из важных и отличительных особенностей
биотехнологического производства является получение большого количества стерильного воздуха. В наибольших масштабах стерильный воздух применяется в процессах культивирования для аэрации. Удельный расход воздуха при выращивании аэробных продуцентов в среднем составляет 1 м3/м3 КЖ в минуту.
Слайд 59 Сжатый стерильный воздух необходим не только для аэрации
и перемешивания выращиваемых культур, но и для передачи стерильных
жидкостей и чистых культур из одного реактора в другой, а также для продувки аппаратов и коммуникаций.Сжатый стерильный воздух используют также для вентиляции участков цехов так называемой стерильной зоны, где в асептических условиях проводят, например, последние стадии очистки и фасовки готового продукта.
Слайд 60 Очистку воздуха можно осуществить принципиально разными методами, основаными
либо на уничтожении микроорганизмов, либо на их удалении.
Одним
из самых эффективных способов стерилизации воздуха, является облучение ультрафиолетовыми лучами. Этот метод используется для обеззараживания воздуха в боксах и технологических помещениях .Отечественными и зарубежными исследователями доказано, что технически и экономически оправданным в промышленности является способ очистки больших количеств воздуха на фильтрах с помощью волокнистых и пористых материалов. Таким путем удается получить воздух со степенью чистоты 99,999%.
Взвешенные в воздухе частицы задерживаются волокнистыми материалам и благодаря инерционному и диффузионному механизмам осаждения.
Слайд 61
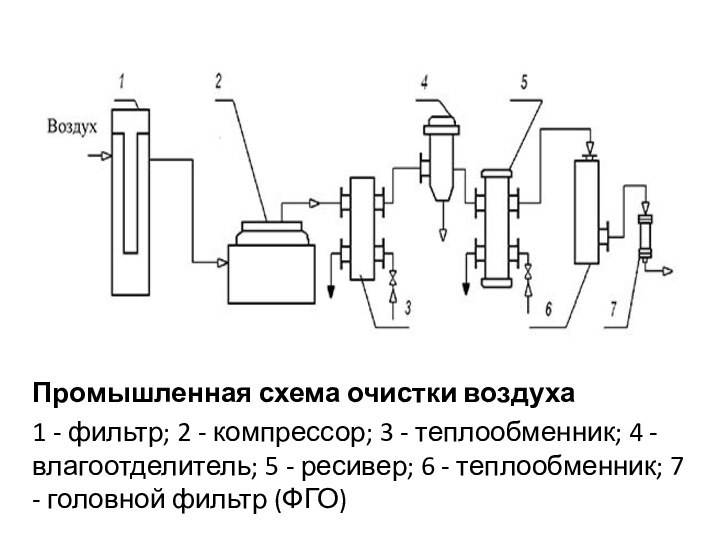
Промышленная схема очистки воздуха
1 - фильтр; 2
- компрессор; 3 - теплообменник; 4 - влагоотделитель; 5
- ресивер; 6 - теплообменник; 7 - головной фильтр (ФГО)
Слайд 62
1 предварительная ступень очистки воздуха
Атмосферный воздух через воздухозаборник,
расположенный в самом чистом месте завода (на высоте 15
м от конька крыши) поступает сначала в предварительный фильтр, где очищается от пыли и др. грубых взвесей (пыль: от 5 до 100 мг/мЗ твердых частиц размером 5-150 мкм; микроорганизмы: до 2000 клеток в 1 мЗ). В качестве предварительных фильтров обычно используют самоочищающиеся масляные фильтры или др).Предварительно очищенный воздух далее поступает в компрессор, где сжимается до необходимого давления (2,0-2,5 атм), нагреваясь при этосм до 120-220 С.
Сжатый нагретый воздух охлаждается в холодильнике и поступает во влагоотделитель (брызгоуловитель, циклон) для удаления капелек влаги.
Слайд 63 2 ступень очистки воздуха – очистка сжатого осушенного
воздуха на «головных» фильтрах
«Головные» фильтры – это фильтры глубинного
типа грубой очистки (ФГО), в которых фильтрация происходит хаотично по всему объему фильтрующего материала. В ФГО в качестве фильтрующего материала используют антимикробные целлюлозные волокна, стекловолокно, базальтовое волокно и др.
На 2 ступени фильтрации эффективность очистки воздуха составляет в среднем 60-80%.
Слайд 64
Недостатки ФГО:
невоспроизводимость укладки фильтрующего материала;
уплотнение фильтрующего
материала в процессе эксплуатации;
каналообразование;
неопределенная эффективность;
контакт работников,
обслуживающих фильтр, с минеральным волокном.
Слайд 65
3 ступень фильтрации воздуха – «стерилизующая» фильтрация
(эффективность очистки
воздуха составляет 99,999%)
После 2 ступени очистки воздух нагревается в
теплообменниках и поступает на 3 ступень фильтрации – индивидуальные фильтры «тонкой» очистки воздуха (ФТО).В ФТО используются в качестве фильтрующих материалов ацетилцеллюлоза (ФПА), перхлорвинил (ФПП /фильтры Петрянова/), полистирол (ФПС) и др. Материал ФПС обладает свойствами аналогичными ФПП, предельная температура его применения 80°, однако он обладает меньшей прочностью, чем ФПП, и выпускается промышленностью в ограниченном количестве.
Слайд 66 Разработаны индивидуальные ФП, стойкие к высоким температурам.
ФПАР (полиакрилатные) и ФПФС (полифторстироловые) выдерживают температуру до 250-270°С.
Фильтрующие материалы в ФТО патронного или кассетного типа обычно располагаются в виде упорядоченных слоев полимерных волокон, нанесенных на тканевую основу (подложку).
Слайд 67
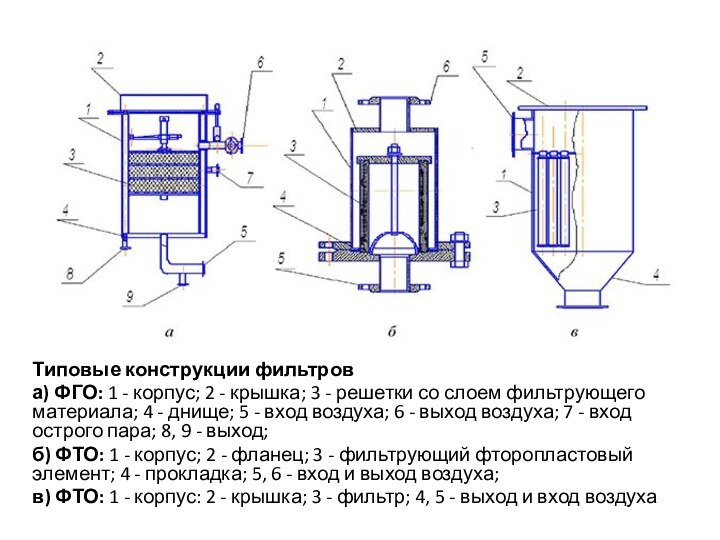
Типовые конструкции фильтров
а) ФГО: 1 - корпус;
2 - крышка; 3 - решетки со слоем фильтрующего
материала; 4 - днище; 5 - вход воздуха; 6 - выход воздуха; 7 - вход острого пара; 8, 9 - выход;б) ФТО: 1 - корпус; 2 - фланец; 3 - фильтрующий фторопластовый элемент; 4 - прокладка; 5, 6 - вход и выход воздуха;
в) ФТО: 1 - корпус: 2 - крышка; 3 - фильтр; 4, 5 - выход и вход воздуха





























