Слайд 2
Гидролитическое расщепление белков и полипептидов, поступающих вместе с
пищей, происходит под действием протеолитических специфических и неспецифических ферментов
(протеиназ и пептидаз):
Эндо- и экзопептидазы;
Амино- и карбоксипептидазы;
Сериновые, цистеиновые и др. пептидазы
Образующиеся аминокислоты поступают в кровь и переносятся к различным органам и тканям.
Слайд 3
Внутриклеточный протеолиз осуществляется различными лизосомальными протеазами, амино- и
карбоксипептидазами, дипептидазами.
Большинство внутриклеточных протеолитических ферментов заключено в протеасомы.
Слайд 4
⅔ аминокислот, поступающих в клетки и образующихся в
процессе внутриклеточного протеолиза, вовлекаются в биосинтез белка. Остальные подвергаются
катаболизму.
Основными катаболическими превращениями аминокислот являются:
дезаминирование;
трансаминирование;
декарбоксилирование.
Слайд 5
Продуктами декарбоксилирования аминокислот являются биогенные амины:
гистамин (продукт
декарбоксилирования гистидина),
тирамин (из тирозина),
кадаверин (из лизина),
-аминомасляная
кислота (из глутамата),
этаноламин (из серина),
дофамин (из тирозина),
серотонин (из окситрипрофана) и др.
Слайд 6
Декарбоксилирование аминокислот необратимый ферментативный процесс, катализируемый декарбоксилазами аминокислот.
Кофактор
декарбоксилаз аминокислот – пиридоксальфосфат.
Слайд 7
Дезаминирование аминокислот – отщепление α-аминогруппы – может происходить
различными путями:
восстановительное,
гидролитическое,
внутримолекулярное (элиминирующее),
окислительное.
Основным типом
является окислительное дезаминирование.
Слайд 8
Окислительное дезаминирование катализируется:
- НАД-зависимыми дегидрогеназами аминокислот;
- ФАД (ФМН)-зависимыми
оксидазами аминокислот.
Продукты окислительного дезаминирования –
α-кетокислоты.
Слайд 10
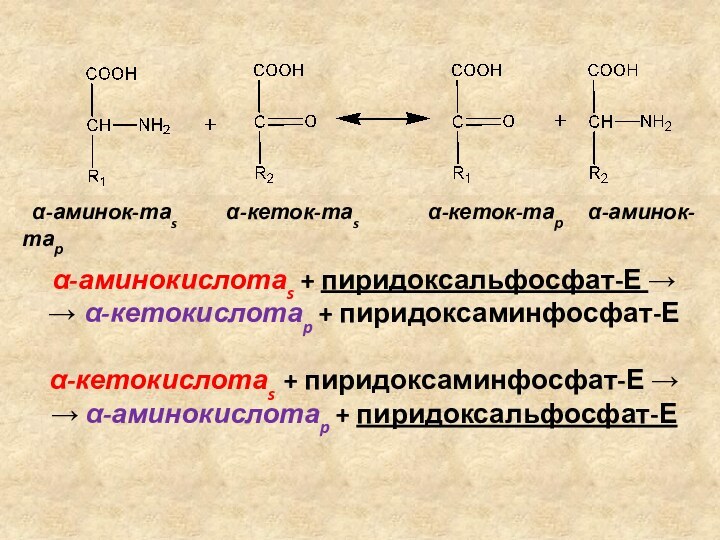
трансаминирование аминокислот
Трансаминирование (переаминирование) аминокислот – реакция межмолекулярного переноса
аминогруппы от -аминокислоты на -кетокислоту без промежуточного образования аммиака.
Ферменты:
аминотрансферазы (трансаминазы)
Кофермент: пиридоксальфосфат
Слайд 11
α-аминокислотаs + пиридоксальфосфат-Е →
→ α-кетокислотаp + пиридоксаминфосфат-Е
α-кетокислотаs + пиридоксаминфосфат-Е →
→ α-аминокислотаp + пиридоксальфосфат-Е
α-аминок-таs α-кеток-таs α-кеток-тар α-аминок-тар
Слайд 12
Аммиак, образующийся при дезаминировании, используется:
для синтеза заменимых аминокислот
– восстановительное аминирование;
для синтеза азотсодержащих соединений.
Избыточный аммиак –
продукт катаболизма – должен быть инактивирован и выведен
из организма.
Слайд 13
ТИПЫ АЗОТИСТОГО ОБМЕНА
в зависимости от формы выведения
аммиака
Аммониотелический тип у водных животных. Конечный продукт – аммиак,
выделяющийся непосредственно в воду.
Уреотелический тип у наземных позвоночных. Конечный продукт – мочевина.
Урикотелический тип у рептилий и птиц. Конечный продукт – мочевая кислота.
Слайд 14
биосинтез глутамина
Образование амидов (глутамина и аспарагина) – процесс
первичного связывания аммиака в клетках.
Биосинтез глутамина – наиболее распространенный
путь связывания и обезвреживания аммиака в организме.
Глутамин – нетоксичная форма транспортировки и хранения аммиака.
Фермент: глутаминсинтетаза
Слайд 16
ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВНИЯ
1. Синтез карбамоилфосфата
Фермент: карбамоилфосфат-синтетаза
Синтез карбамоилфосфата
происходит в митохондриях
клеток печени. Донор азота только аммиак
(а
не амины и другие азотсодержащие соединения).
Слайд 17
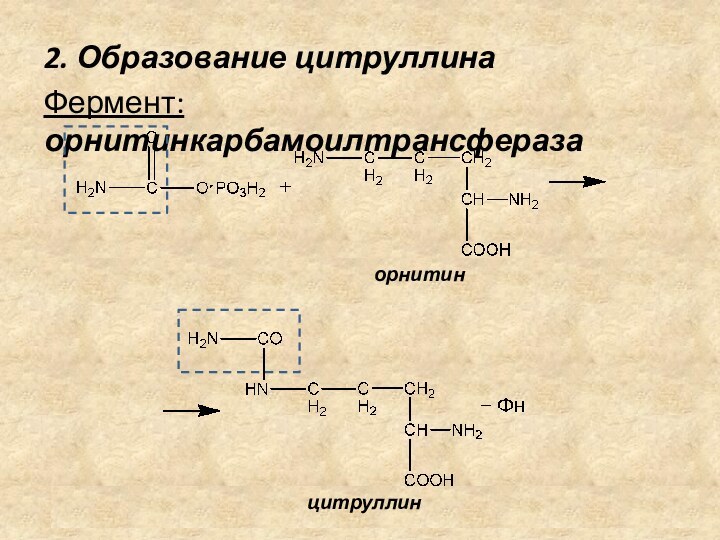
2. Образование цитруллина
Фермент: орнитинкарбамоилтрансфераза
орнитин
цитруллин
Слайд 18
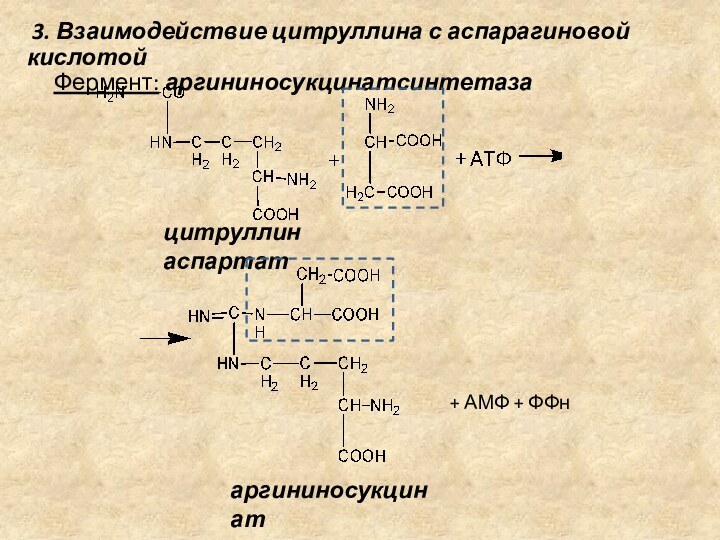
3. Взаимодействие цитруллина с аспарагиновой кислотой
Фермент: аргининосукцинатсинтетаза
цитруллин аспартат
+
АМФ + ФФн
аргининосукцинат
Слайд 19
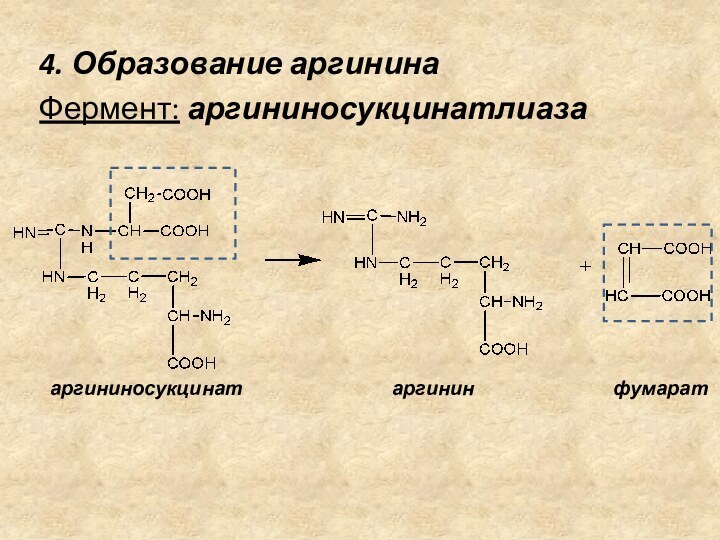
4. Образование аргинина
Фермент: аргининосукцинатлиаза
Слайд 20
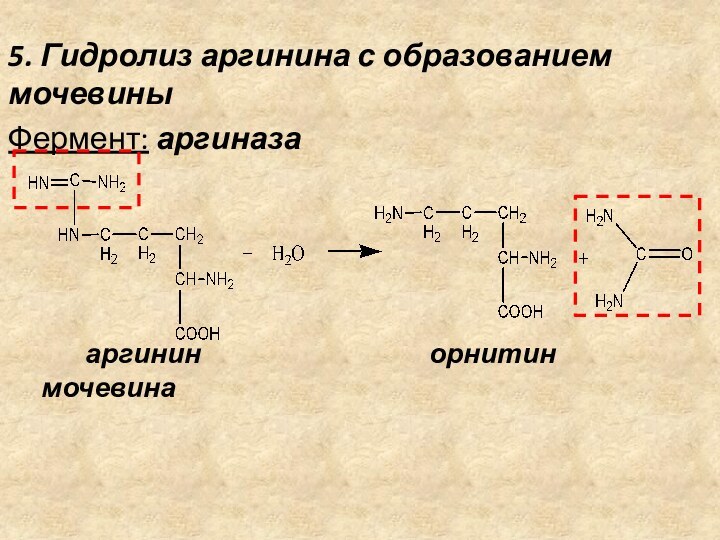
5. Гидролиз аргинина с образованием мочевины
Фермент: аргиназа
аргинин
орнитин мочевина
Слайд 21
Суммарное уравнение мочевинообразования
СО2 + NH3
+ аспартат + 3АТФ + 2Н2О
мочевина + фумарат + 2АДФ +АМФ + 2Фн + ФФн
Слайд 22
БИОСИНТЕЗ АМИНОКИСЛОТ
Аминокислоты, образующиеся при гидролизе белков:
2/3 расходуются на
синтез белка;
1/3 катаболизируются.
Т.е. 1/3 аминокислот должна синтезироваться вновь.
Слайд 23
БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Заменимые аминокислоты:
ала, асн, асп, гли, глн,
глу, про, сер, тир, цис
Незаменимые аминокислоты:
вал, иле, лей, лиз,
мет, тре, три, фен, арг, гис
Углеродный скелет образуется из промежуточных метаболитов:
гликолиза,
пентозомонофосфатного пути
цикла Кребса.