Слайд 2
План
Основные причины несостоявшегося выкидыша. Тромбофилические состояния в генезе
невынашивания
Современные диагностические возможности (измерения уровня ингибина А и
активина А в сыворотке крови), тактика ведения
АФС диагностика и тактика ведения
Антенатальная гибель плода. Клиника, тактика ведения, возможные осложнения
Слайд 3
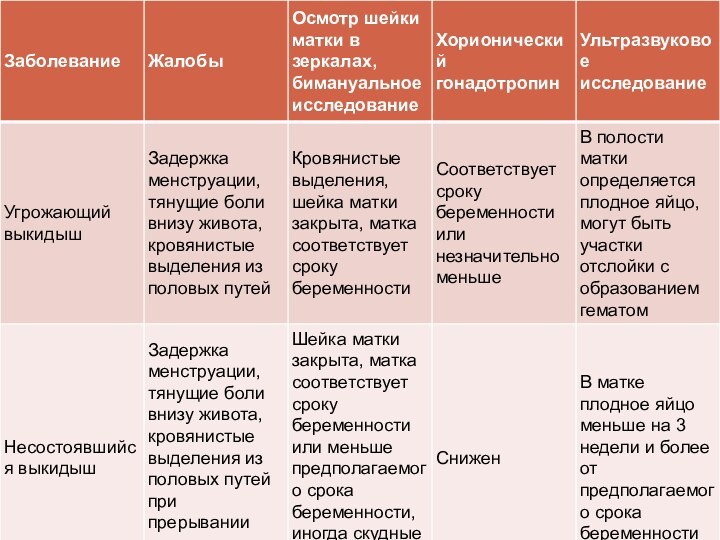
Название протокола: Самопроизвольный выкидыш
Код(ы) МКБ-10:
О03 – Самопроизвольный выкидыш
020.0 –
Угрожающий выкидыш
О02.1 – Несостоявшийся выкидыш
Дата разработки протокола: апрель 2013
года.
Слайд 4
Несостоявшийся выкидыш (неразвивающаяся беременность, missedabortion) - Термин "ранняя антенатальная
гибель плода" касается ситуаций, когда плод уже погиб, но
матка еще не начала его изгнание. Ранее для описания этого состояния применялось множество терминов, в том числе "пустое плодное яйцо", "несостоявшийся выкидыш" и "замершая беременность".
На практике в таких ситуациях плод мертв, но цервикальный канал остается закрытым. Диагноз ставится на основании УЗИ после выявления таких клинических симптомов как кровянистые выделения из влагалища, отсутствие сердцебиения плода (с 12 недель), отсутствие движений плода (с 16 недель) или если размер матки намного меньше ожидаемого.
Слайд 5
На любом сроке причинами прерывания беременности могут быть:
-
генетические;
- иммунологические (АФС, антигены HLA, гистосовместимость);
- инфекционные;
- анатомические (врожденные
аномалии, генитальный инфантилизм, внутриматочные синехии, истмико-цервикальная недостаточность);
- эндокринные (дефицит прогестерона).
ЭТИОЛОГИЯ
НБ — полиэтиологическое осложнение беременности, наиболее частой причиной является хронический эндометрит с персистенцией условно-патогенных микроорганизмов и/или вирусов.
Известно, что при первичном инфицировании на ранних сроках беременности возможны повреждения эмбриона, несовместимые с жизнью, приводящие к спорадическому самопроизвольному выкидышу.
В настоящее время наибольший интерес вызывают генетические, иммунные, тромбофилические факторы, являющиеся наименее изученными. Тромбофилические факторы генетически детерминированы.
Слайд 7
Плодное яйцо с материнским организмом — функционально единая
гормональная система. Доказана способность плода принимать активное участие в
синтезе и метаболизме прогестерона. При угрожающем невынашивании данные процессы нарушаются.
Дефицит прогестерона приводит к патологии децидуализации стромы эндометрия, слабой инвазии цитотрофобласта и, как следствие, к снижению маточно-плацентарного кровообращения.
При невынашивании по типу НБ происходит прекращение фетального метаболизма прогестерона.
К генетическим факторам относят хромосомные аномалии эмбриона или плода, образовавшиеся при слиянии двух родительских клеток с наличием точечных мутаций в хромосомном наборе. При исследовании материала выкидышей большинство обнаруженных хромосомных нарушений — количественные (95%).
Слайд 8
Клиника
При задержке мёртвого плода в матке свыше

3–4 нед 10% женщин отмечают общее недомогание, слабость, головокружение,
повышение температуры тела. Исчезновение тошноты, рвоты, слюнотечения — характерные субъективные признаки гибели плодного яйца в первые 12 нед беременности.
Во второй половине беременности женщина отмечает прекращение шевеления плода. Симптом размягчения молочных желёз возникает на 3–6-е сутки после гибели плода. В молочных железах вместо молозива появляется молоко. Нагрубание молочных желёз и выделение значительного количества молозива наблюдают у женщин при гибели плода, наступившей после 25 нед развития.
Клинические признаки НБ (боли, кровяные выделения из половых путей, отставание размеров матки от предполагаемого срока беременности) появляются через 2–6 нед после прекращения развития эмбриона.
Стадии прерывания НБ соответствуют стадиям самопроизвольного аборта:
· угрожающий выкидыш;
· начавшийся выкидыш;
· аборт в ходу;
· неполный аборт.
Полный аборт при НБ в силу патогенетических причин не выделяют.
Слайд 9
Диагностика
Физикальное исследование
Акушерское обследование
1. ВСДМ – соответствует сроку

беременности при угрожающем выкидыше, не соответствует при НБ.
2. Осмотр
шейки матки на зеркалах, вагинальный осмотр:
- кровотечение легкое;
- шейка матки закрыта;
- матка не соответствует предполагаемому сроку беременности при НБ.
Лабораторные исследования:
- определение концентрации ХГЧ в крови. Концентрация ХГЧ ниже - при НБ;
- обследование при подозрении на АФС: волчаночный антикоагулянт и наличии антифосфолипидных и антикардиолипидных антител,АчТВ, антитромбин 3, Д-димер, агрегация тромбоцитов;
- изучение показателей гемостаза при несостоявшемся выкидыше: время свертывания крови, концентрация фибриногена, АчТВ, МНО, протромбиновое время.
Инструментальные исследования
Ультразвуковое исследование:
- отсутствие эмбриона в полости плодного яйца после 7 недель беременности или отсутствие сердцебиения при неразвивающейся беременности.
Показания для консультации специалистов:
- при подозрении на АФС консультация терапевта/гематолога с результатами лабораторного исследования;
- при несостоявшемся выкидыще при выраженных отклонениях гемостаза – консультация гемостазиолога.
Слайд 10
АНАМНЕЗ
Ранняя диагностика НБ имеет важное практическое значение, поскольку
она способствует сокращению сроков обследования пациенток и уменьшению риска
возникновения осложнений, связанных с длительным пребыванием погибшего плодного яйца в полости матки. Диагноз НБ устанавливают на основании данных эхографического исследования, выявляя отсутствие эмбриона в полости плодного яйца после 7 нед беременности или отсутствие сердцебиения эмбриона.
Выявляют факторы риска хронического эндометрита: наличие двух и более медицинских абортов в анамнезе; сексуально-трансмиссивные заболевания, воспалительные заболевания половых органов. Необходимо проведение УЗИ, анализ белков АФП, ХГЧ в наиболее информативные сроки.
Слайд 11
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ

Уменьшение цианоза слизистой оболочки влагалища и шейки матки происходит через 4–5 нед после гибели плода при сроке до 16 нед беременности и спустя 6–8 нед при гибели плода в более поздние сроки.
Уменьшение или отставание матки от должных размеров выявляют при гибели плода до 20 нед и особенно до 12 нед. В ранние сроки беременности это происходит в результате рассасывания плодного яйца.
При больших сроках — за счёт всасывания ОВ, мацерации и сморщивания плода. Изменение консистенции матки, её уплотнение или размягчение не считают надежным симптомом НБ.
Раскрытие цервикального канала у нерожавших на 1–1,5 см, а у рожавших — на 3 см и более наблюдают при задержке мёртвого плода в полости матки от 12 до 20 нед. В случае гибели плода при сроке более 14 нед и нахождении его в полости матки более 4 нед при осмотре матки с помощью зеркал обнаруживают выделение из цервикального канала густой слизи коричневого цвета.
При вскрытии плодного пузыря изливаются ОВ коричневого цвета. Если гибель плода наступила после 30 нед и он находился в матке более 2 нед, при использовании третьего приёма наружного акушерского исследования определяют крепитацию, возникающую вследствие трения костей черепа между собой.
Слайд 12
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Наиболее информативным методом диагностики НБ считают УЗИ, позволяющее выявить НБ задолго до появления клинических симптомов.
Изменение головки плода.
Черепицеобразное захождение краёв костей черепа.
Расхождение краёв костей черепа.
Уплощение сводов черепа.
Асимметрия контуров черепа.
Исчезновение контуров головки.
Отвисание нижней челюсти.
На 4–5-й день после гибели плода отмечают исчезновение срединных
структур мозга.
Важный признак длительности пребывания мёртвого плода в
матке — характерные для данной патологии цифры черепного индекса (Y):
отношение бипариетального размера (БПР) головки плода к
лобнозатылочному размеру (ЛЗР) х 100. В норме он превышает 83. При
задержке мёртвого плода в матке до 3 нед черепной индекс равен 74–64, при
задержке более 3 нед — 64.
Слайд 13
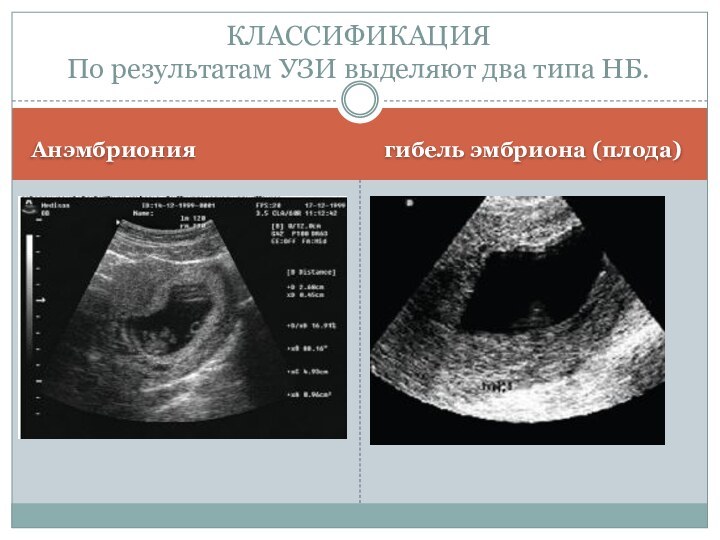
Анэмбриония
гибель эмбриона (плода)
КЛАССИФИКАЦИЯ
По результатам
УЗИ выделяют два типа НБ.
Слайд 14
Эхографически различают анэмбрионию
I и II типа.
При I типе анэмбрионии зародыш не визуализируется, величина среднего
диаметра плодного яйца не превышает 2,0–2,5 см, размеры матки соответствуют 5–7-й неделе беременности.
Решающее диагностическое значение имеет отставание размеров матки и плодного яйца от срока беременности, прекращение их роста при динамическом наблюдении.
При II типе анэмбрионии, несмотря на отсутствие эмбриона или визуализацию его остатков (обычно в виде позвоночного сгиба), плодное яйцо растёт с нормальной скоростью.
К 10–11-й неделе беременности диаметр плодного яйца достигает 4,5–5,5 см. При II типе анэмбрионии чётко не выявляется закладка ворсинчатого хориона, в норме определяемая уже с 8-й недели беременности.
Слайд 15
· Изменение позвоночника.
Отклонение головки плода под углом.
Ненормальная
ротация и сгибание головки.
Чрезмерное искривление позвоночника в виде кифоза.
Патологическое
искривление отдельных участков позвоночника в форме дуги или угла.
Стреловидное выпрямление позвоночника и исчезновение физиологического искривления.
Изменение костей скелета и конечностей плода.
Изменение формы грудной клетки плода.
«Разбрасывание» конечностей.
Неотчетливые и расплывчатые контуры скелета плода.
Нетипичное положение плода по отношению к центру матки.
· Другие симптомы.
Несоответствие величины плода предполагаемому сроку беременности.
«Венец» вокруг черепных костей.
Тени от свободного газа в крупных сосудах, полостях сердца и черепной коробке плода.
Слайд 16
Установлено, чем меньше срок беременности (рассматривают вторую половину
беременности) к моменту гибели плода и срок пребывания его
в полости матки, тем сильнее изменены отдельные части скелета.
Диагностическое и прогностическое значение при НБ имеет ультразвуковая плацентография, позволяющая определить расположение плаценты, её размеры, преждевременную отслойку отдельных участков, изменения в виде кист, инфарктов, некрозов, кальциноза и др.
При замершей беременности плацента имеет выраженное дольчатое строение за счёт повышения кальциноза наружной поверхности материнской части.
Слайд 17
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
В комплексной диагностике в качестве
дополнительных тестов используют определение в сыворотке крови уровней АФП, ХГЧ и трофобластического b-1-гликопротеина.
При гибели плода отмечают высокое содержание АФП (в 2–4 раза выше нормативных показателей) и снижение уровня трофобластического b-1-гликопротеина (в 6–18 раз) и ХГЧ (в 3– 9 раз).
До прерывания беременности необходимо провести тщательный контроль системы гемостаза для коррекции возможных нарушений
Слайд 18
Иммуноферментное определение гравидарных белков

в сыворотке крови
Трофобластический b-1-гликопротеин.
G Трофобластический b-1-гликопротеин считают специфическим маркёром плодовой части плаценты, его синтезируют клетки цитотрофобласта и синцитиотрофобласта. Трофобластический b-1-гликопротеин обладает функцией транспортного белка и выраженными иммуносупрессивными свойствами. Обнаружение трофобластического b-1- гликопротеина в сыворотке беременных возможно на 7–14-й день после овуляции. При неосложнённой беременности концентрация трофобластического b-1-гликопротеина в сыворотке крови возрастает с 10,4±1,1 мкг/мл в 6–12 нед до 281,1±4,8 мкг/мл в 33–40 нед. Снижение уровня трофобластического b-1-гликопротеина происходит сразу после гибели плодного яйца. Резкое снижение (в 4,3–8,6 раза) отмечают у беременных после 3 нед пребывания погибшего плода в матке.
Плацентоспецифический a-1-микроглобулин.
G Плацентоспецифический a-1-микроглобулин секретирует децидуальная оболочка, его считают специфическим маркёром материнской части плаценты. При увеличении срока беременности концентрация a-1-микроглобулина постепенно возрастает с 21–25 нед беременности (81,35±14,31 нг/мл), к 31–35 нед снижается (60,13±9,91 нг/мл) и в последующем достигает максимальных значений к 40 нед беременности (111,19±6,13 нг/мл). У женщин с замершей беременностью концентрация белка в сыворотке крови в 2,5 раза превышает норму. Появление высокого уровня сывороточного a-1-микроглобулина связано с деструктивным процессом в материнской (децидуальной) части плаценты, это объясняет увеличение уровня белка в плазме крови.

АФП.
G Определение АФП играет незначительную роль в диагностике НБ. Высокая концентрация белка в сыворотке крови указывает на внутриутробную гибель плода (эмбриона). Самый высокий сывороточный уровень эмбрионального белка отмечают через 3–4 дня после гибели плода (эмбриона). Высокое содержание АФП в крови матери (в 1,5–3 раза выше, чем во время физиологической беременности) связано с его диффузией в ОВ и кровотоком матери из погибшего эмбриона или плода
ХГЧ.
G ХГЧ — специфический гормон беременности, отражающий её развитие. Продукция гормона служит показателем нормальной деятельности трофобласта, критерием его функциональной активности. При физиологической беременности примитивный трофобласт начинает продуцировать ХГЧ уже через 1 день после имплантации. Концентрация гормона достигает максимума уже в 6–10 нед нормально протекающей беременности (116,01±16,12 МЕ/мл), затем снижается и вновь увеличивается в 31–35 нед (34,91±7,36 МЕ/мл).
G Концентрация ХГЧ в сыворотке крови у больных с НБ, по сравнению с физиологической беременностью, в 6– 12 нед ниже в 8,6 раз, в 13–26 нед — в 3,3 раза, в 28–30 нед — в 2,7 раза.
G Отмечают снижение уровня ПЛ (в 1,8–2,7 раза), но в целом он остается высоким. У пациенток с НБ концентрация прогестерона в крови сохраняется на относительно высоком уровне, а содержание эстрадиола резко снижается. Диагностическая ценность исследования повышается при повторных определениях. При цитохимическом исследовании особенность лейкоцитарной формулы у женщин с НБ — увеличение моноцитов, уменьшение базофилов и эозинофилов, увеличение СОЭ.
Слайд 20
Основными источниками ингибина служат гранулезные клетки яичников и
клетки Сертоли яичек. Ингибин также продуцируется во время беременности
плодом, плацентой, децидуальной оболочкой и плодными оболочками. Важнейшей функцией ингибина является селективное угнетение продукции ФСГ гипофизом. Оно достигается модуляцией биосинтеза ФСГ за счет двух механизмов: уменьшения количества стабильной мРНК для ФСГ в гонадотрофах гипофиза и снижения стабильности мРНК для ФСГ.
Ингибин А состоит из а- и р-А субъединиц. Во время беременности основным продуцирующим органом ингибина А является плацента. Нормальные величины содержания ингибина А приведены в табл.
Слайд 21
Содержание ингибина А в сыворотке в норме [Aitken
D.A. et al., 1995]
Репродуктивный период
Концентрация, пг/мл
Фолликулиновая фаза < 2—52
Лютеиновая фаза 12-150
Менопауза 0-5
Нормальная беременность:
7 нед 175-707
8 нед 156-1208
9 нед 284-1246
10 нед 204-1071
11 нед 335-947
12 нед 128-832
13 нед 193-612
14 нед 172-543
15 нед 67-642
16 нед 82-424
17 нед 96-391
18 нед 50-324
Слайд 22
Однако нарушение беременности приводит и к быстрому падению
концентрации ингибина А в крови, что затрудняет оценку результата
анализа.
Кроме того, при беременности, начиная с 10-й недели, отмечается физиологическое падение концентрации ингибина А в крови, что также затрудняет оценку результатов и использование этого показателя для диагностики и мониторинга эктопической беременности.
Слайд 24
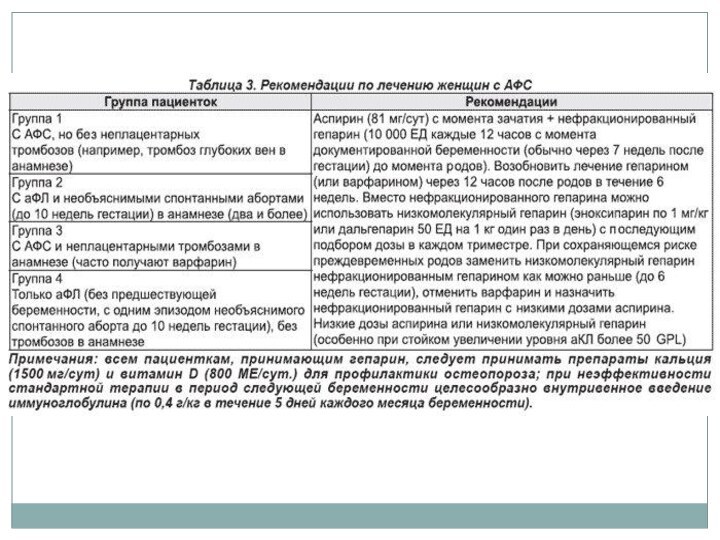
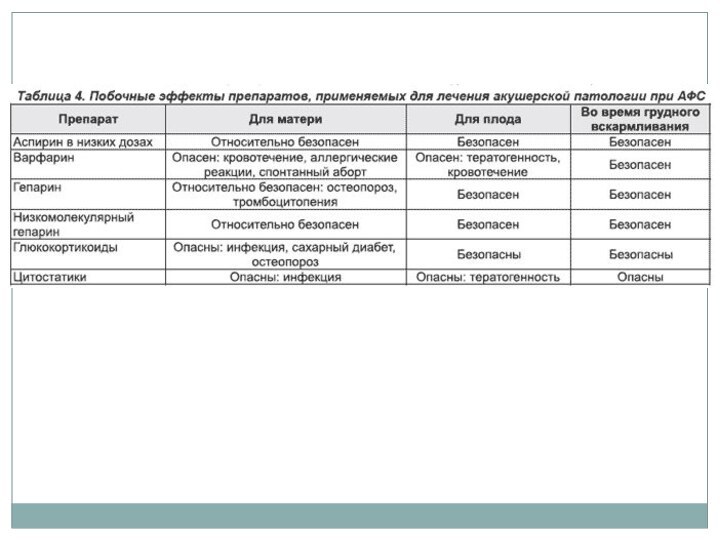
ЛЕЧЕНИе
Немедикаментозное лечение: нет.
Медикаментозное лечение
Внутривлагалищное применение мизопростола является эффективным
методом для прерывания замершей беременности в сроке до 24
недель гестации. Хотя оптимальная дозировка для первого триместра еще четко не установлена, по данным исследования Gilles (15) внутривлагалищное применение в дозе 800 мкг с повторением через три дня достигало эффекта у 79% женщин к седьмому дню (или у 87% - к 30-му дню). Во втором триместре (10-24 недель) рекомендуется более низкая дозировка - 200 мкг внутривлагалищно с повтором через 12 часов (исследование Jain (16)).
Слайд 25
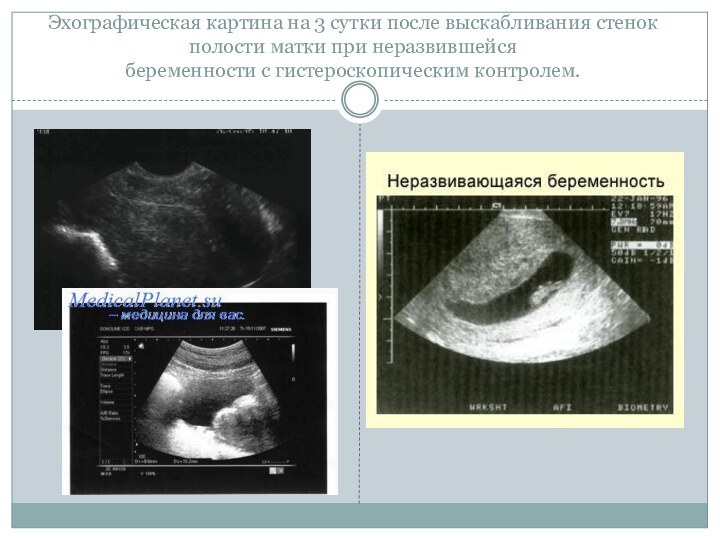
Эхографическая картина на 3 сутки после выскабливания стенок
полости матки при неразвившейся
беременности с гистероскопическим контролем.
Слайд 26
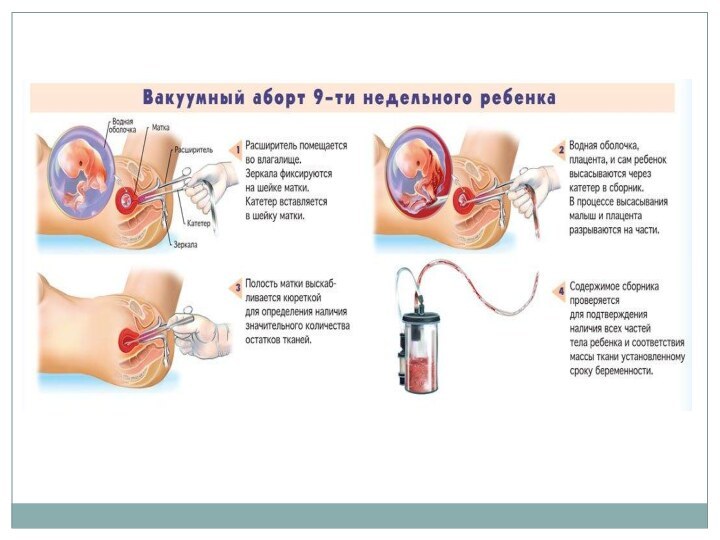
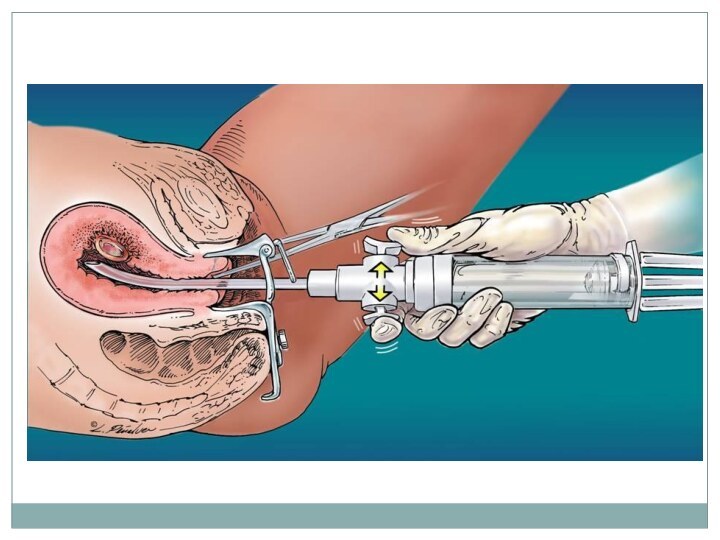
Хирургическое вмешательство: эвакуация плодного яйца до 14-16 недель

предпочтительно мануальная вакуум-аспирация.
Профилактические мероприятия
Профилактика инфекции во время эвакуации плодного
яйца – соблюдение асептики, назначение профилактической антибактериальной терапии.
Профилактика выкидыша в группах женщин с привычной потерей беременности или верифицированной недостаточностью функции желтого тела, включая индуцированные беременности и беременности после ЭКО проводится путем использования:
- прогестерона натурального микронизированного (см выше рекомендации FDA) по 200-400 мг интравагинально в 1-II триместрах беременности для профилактики привычного и угрожающего выкидыша.
- крайнона (прогестерон) – рекомендации FDA категория D, для поддержания лютеиновой фазы в процессе применения вспомогательных репродуктивных технологий (ВРТ) 1 аппликатор (90 мг прогестерона) интравагинально ежедневно, начиная со дня переноса эмбриона, в течение 30 дней с момента клинически подтвержденной беременности.
- дидрогестерона(см выше рекомендации FDA) по 10 мг 2 раза в сутки до 16-20 недели беременности при привычном выкидыше.
Слайд 29
Дальнейшее ведение
- Назначение микродоз комбинированных оральных контрацептивов с
первого дня прерывания беременности.
- Обследование на ИППП
- Медико-генетическое консультирование
рекомендуется парам с повтором НБ.
- Лечение хронического воспаления – хронического эндометрита, хронического сальпингита, вагинита, вагиноза при их наличии.
- Обследование на АФС при наличии диагностических критериев (Sapporo, 1999) c дополнениями (MiyakisS.Etal.,2006): Анамнестические: цефалгия, ИБС, артериальные и венозные тромбозы, преходящие нарушения мозговое кровообращения, синдром потери плода, преэклампсия, эклампсия.
- Определение волчаночного антикоагулянта и наличие антифосфолипидных и антикардиолипидных антител, АчТВ, антитромбин 3, Д-димер, агрегация тромбоцитов.
Слайд 30
Антифосфолипидный синдром — термин, объединяющий патогенетические основы нарушения
репродуктивной функции (в первую очередь, невынашивание беременности) и наличие
антифосфолипидных АТ.
ЭПИДЕМИОЛОГИЯ
АФС обнаруживают в 12–15% случаев, причём у женщин в 2–5 раз чаще, чем у мужчин. Во время беременности антифосфолипидные АТ выявляют у 2–4% женщин. Среди пациенток с привычным невынашиванием беременности АФС диагностируют в 27–42% случаев.
Слайд 31
КЛАССИФИКАЦИЯ
Выделяют следующие формы АФС:
• первичный АФС;
• вторичный АФС;
•
АФС у больных с волчаночно-подобными проявлениями;
• катастрофический АФС;
• другие
микроангиопатические синдромы (тромбоцитопеническая пурпура, ДВС-синдром, HELLP-синдром, гипопротромбический синдром);
• серонегативный АФС.
Слайд 32
ЭТИОЛОГИЯ
Причины АФС до конца не изучены. Повышение концентрации
антифосфолипидных АТ в крови, как правило, бывает транзиторным, и
его отмечают на фоне многих инфекционных заболеваний бактериальной и особенно вирусной этиологии. Наличие латентной инфекции может способствовать развитию тромботических осложнений при АФС, несмотря на различия в иммунологических свойствах антифосфолипидных АТ, при истинных аутоиммунных процессах и воспалительных заболеваниях.
Проявления АФС могут быть генетически детермированными. Например, у больных с АФС чаще, чем в популяции, регистрируют Аг системы HLA DR4, DR7, DRw53, что свидетельствует о генетической предрасположенности к данному заболеванию.
Слайд 33
ПАТОГЕНЕЗ
При взаимодействии антифосфолипидных АТ с фосфолипидами на мембранах

эпителиальных клеток развивается системная эндотелиальная дисфункция и дисрегуляция в
системе гемостаза. Проявлениями эндотелиальной дисфункции считают усиленную адгезию и агрегацию тромбоцитов, нарушение баланса между синтезом простациклина и тромбоксана и внутрисосудистый тромбоз в фетоплацентарном комплексе, который становится интегральным этиопатогенетическим фактором невынашивания беременности, тяжёлого гестоза, ЗРП и антенатальной гибели плода, ПОНРП.
Влияние антифосфолипидных АТ на систему гемостаза может проявляться также снижением активности естественных антикоагулянтов (протеина C, S и АТ III) и развитием тромботической и иммунной тромбоцитопении. Из- за этих нарушений возникают вазоконстрикция, усиленная агрегация тромбоцитов и внутрисосудистый тромбоз. Возможны и другие коагуляционные нарушения, однако их конечным результатом при беременности бывает сосудистая недостаточность в плаценте.
Ранние преэмбрионические выкидыши при АФС обусловлены нарушением процесса имплантации. Под воздействием антифосфолипидных АТ изменяются предимплантационные характеристики морулы (заряд, конфигурация), нарушается слияние синцития, происходит подавление продукция ХГЧ, что приводит к снижению глубины инвазии трофобласта и прерыванию беременности.
Слайд 34
Патологические состояния, в развитии которых играет роль АФС:
•
привычное невынашивание беременности (включая НБ);
• ЗРП;
• плацентарная недостаточность;
• гестоз;
•
HELLP-синдром;
• антенатальная гибель плода;
• ПОНРП.
Слайд 35
ДИАГНОСТИКА
АНАМНЕЗ
При АФС в анамнезе у пациентки отмечают следующие
нарушения:
• Один или более самопроизвольных выкидышей на сроке 10
нед и более (включая НБ).
• Три и более самопроизвольных выкидыша на преэмбрионической или ранней эмбрионической стадии (при исключении других причин невынашивания).
• Мертворождения.
• Неонатальная гибель плода как осложнение преждевременных родов, тяжёлого гестоза или плацентарной недостаточности.
• Случаи артериального или венозного тромбоза в возрасте до 45 лет (преходящие нарушения мозгового кровообращения, тромбоз сосудов сетчатки, инфаркт, инсульт и др.).
• Патология ЦНС, сердечно-сосудистой системы, ЖКТ, эндокринных органов (болезни клапанов сердца, кардиомиопатия, лёгочная гипертензия, почечная и надпочечниковая недостаточность, гипопитуитаризм и др.).
Слайд 37
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
• Определяют наличие волчаночного антикоагулянта в крови

с помощью скрининговых тестов (АЧТВ, протромбинового времени, времени свертывания
с использованием яда гадюки Рассела), коррекционной пробы, подтверждающих тестов.
• Выявляют высокие титры антикардиолипиновых АТ класса IgМ.
• Исследуют наличие АТ класса IgМ к подгруппе фосфолипидов (фосфадитилсерин, фосфадитилхолин, фосфадитилэтаноламин, фосфатидиловая кислота) и к кофакторам (β9-GPI, протромбин, аннексин V, протеин C, протеин S, тромбомодулин). Предварительным диагностическим критерием АФС считают обнаружение антикардиолипиновых АТ и/или волчаночного антикоагулянта два и более раза при проведении исследований с интервалом 6–8 нед. При подозрении на АФС (в случае наличия тромботических нарушений, тромбоцитопении, акушерской патологии, а также при удлинении АЧТВ) лабораторные исследования следует проводить перед планируемой беременностью, во время беременности — на любом сроке и в послеродовом периоде. Течение АФС, тяжесть и распространённость тромботических осложнений, как правило, не коррелируют с изменением титров антифосфолипидных АТ и активностью аутоиммунного процесса.
Слайд 38
Показания к лабораторному и генетическому скринингу АФС:
• случаи
тромбоза в семейном анамнезе или в раннем возрасте;
• самопроизвольное
прерывание беременности;
• НБ;
• осложнённое течение беременности (гестоз, плацентарная недостаточность, преждевременная отслойка плаценты);
• длительный приём гормональных или цитостатических лекарственных средств.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика АФС включает следующие нозологии:
• аутоиммунные заболевания соединительной ткани, прежде всего системные васкулиты;
• наследственные тромбофилии (мутации фактора V Лейден, гена протромбина G20210А, метилентетрагидрофолат редуктазы C 6777 Т, полиморфизм гена активатора плазминогена, тромбоцитарных рецпторов);
• аутоиммунная тромбоцитопеническая пурпура.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Наблюдать и вести пациенток с АФС следует совместно с врачами других специальностей (кардиолог, гематолог, сосудистый хирург и терапевт).
Слайд 39
ЛЕЧЕНИЕ
Общие принципы терапии АФС:
• По возможности следует устранить

причину АФС.
• Лечение рекомендовано начинать до наступления беременности или
в ранние сроки гестации на фоне тщательного мониторинга содержания антифосфолипидных АТ в крови.
• Проводят индивидуально подобранную противотромботическую терапию.
• Лечение АФС должно быть длительным и его необходимо проводить под контролем показателей гемостазиограммы.
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения АФС заключается в уменьшении количества циркулирующих аутоантител, активности аутоиммунного процесса, в предотвращении развития гемостазиологических нарушений и обеспечении пролонгирования беременности и рождения здорового ребенка.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Выделяют следующие показания к госпитализации в специализированный родильный дом:
• обследование и подбор противотромботической терапии;
• нарастание гемостазиологических нарушений на фоне проводимой терапии;
• осложнённое течение беременности (гестоз средней и тяжёлой степени тяжести, субкомпенсированная форма ПН);
• подозрение на катастрофическую форму АФС.
Слайд 42
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
• Показанием для назначения глюкокортикоидной терапии считают

наличие в анамнезе аутоиммунных заболеваний.
Лечение начинают во 2-й
фазе предполагаемого фертильного цикла (со 2-го дня овуляции) и продолжают на протяжении всей беременности вплоть до 10–15 сут послеродового периода с последующей постепенной отменой препарата. Используют преднизолон в дозе 5 мг/сут (максимальная суточная доза составляет 10–15 мг) или метилпреднизолон в дозе 4 мг/сут.
• Иммуностимуляторы необходимы для профилактики реактивации вирусной инфекции на фоне иммуносупрессивной терапии: иммуноглобулин человеческий нормальный в дозе 25 мл через день (три дозы) в I триместре беременности, на сроке 24 недели и перед родами, вагинально (ректально) интерферон альфа-2 в дозе 1000 МЕ/сут. • Антиагреганты показаны для коррекции гемостазиологических нарушений (гиперактивация тромбоцитов): дипиридамол по 75–150 мг/сут за 1 ч до еды, пентоксифиллин по 10–20 мг/сут во время еды, ацетисалициловая кислота по 80–100 мг/сут (до 34 недель).
• Антикоагулянты назначают при выявлении гиперкоагуляции, обусловленной нарушениями плазменного звена гемостаза, при появлении в крови продуктов деградации фибрина, мономеров фибрина. Дозу препарата подбирают индивидуально, и её можно изменять.
G Нефракционированный гепарин по 15 000 ЕД/сут подкожно или по 10 000 ЕД/сут внутривенно капельно в 400 мл раствора декстрана с молекулярной массой 30 000–40 000.
G Надропарин кальций подкожно в лечебной дозе 0,01 мл (95 МЕ)/кг массы тела 2 раза в сутки.
G Далтепарин натрий 1–2 раза в сутки подкожно в дозе 100–200 анти-Ха/кг массы тела.
G Эноксапарин натрия по 4000–10 000 МЕ/сут (40–100 мг/сут) подкожно.
• Для профилактики осложнённого течения беременности при АФС можно назначать также следующие лекарственные средства: препараты железа, фолиевую кислоту в дозе до 1–6 мг/сут, полинасыщенные жирные кислоты, поливитамины для беременных.
Слайд 43
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
При нормальном течении беременности родоразрешение
проводят на сроке 40 недель гестации. Роды ведут через
естественные родовые пути, при наличии соответствующих показаний со стороны матери или плода — путём КС.
Слайд 44
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценку эффективности лечения проводят на основании

лабораторных методов исследования, а также по выраженности клинических симптомов
заболевания. В течение первых четырёх недель еженедельно определяют количество и агрегационную способность тромбоцитов, содержание D-димера, молекулярных маркёров тромбофилии в крови. На основании результатов этих исследований можно выбрать препараты и определить их необходимую дозу для проведения противотромботической терапии в каждом конкретном случае. Далее исследования делают ежемесячно. При нарастании выраженности гемостазиологических нарушений увеличивают дозу назначенных препаратов или производят их замену.
Благодаря ультразвуковой допплерометрии, которую осуществляют со срока гестации 24 недели ежемесячно вплоть до родоразрешения, можно своевременно диагностировать снижение фетоплацентарного и маточноплацентарного кровотока и начать патогенетическую терапию ПН, а также оценить эффективность этого лечения. На основании результатов КТГ, проводимой со срока беременности 34 недели, оценивают состояние плода и выбрают оптимальный срок и метод родоразрешения.
ПРОФИЛАКТИКА
• Необходимо назначать адекватную антибактериальную терапию при лечении любого инфекционного заболевания.
• Не следует длительно применять гормональные препараты (контрацептивы, заместительную гормональную терапию).
Слайд 45
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
• Пациенткам с АФС рекомендовано проходить

скрининг на волчаночный антикоагулянт и антикардиолипиновые АТ по крайней
мере 2 раза перед каждой планируемой беременностью.
• На основании полученных результатов обследования следует обсудить с врачом прогноз беременности и возможное лечение с учётом его влияния на плод, которые могут и не быть напрямую связаны с клинической стадией заболевания у матери. Пациентки должны быть осведомлены о риске, сопряженном с назначением иммуносупрессивной терапии, а также о высоком риске развития тромботических осложнений у матери.
• При наличии АФС показана длительная антиагрегантная и антикоагулянтная терапия на протяжении всей беременности и в послеродовом периоде.
ПРОГНОЗ
Прогноз АФС неблагоприятный. Без проведения лечения гибель эмбриона или плода при наличии АФС отмечают в 95–98% случаев. Частота рождения живого ребенка у матерей, имевших активность волчаночного антикоагулянта или высокую концентрацию АТ класса IgG в крови к кардиолипину, не превышает 10%. Летальность пациенток при катастрофической форме АФС достигает 60%.



















![Неразвивающаяся беременность и антенатальная гибель плода Содержание ингибина А в сыворотке в норме [Aitken D.A. et al., 1995]Репродуктивный](/img/tmb/14/1329603/f98a9e671def81b12fd0bd14f1de87ca-720x.jpg)