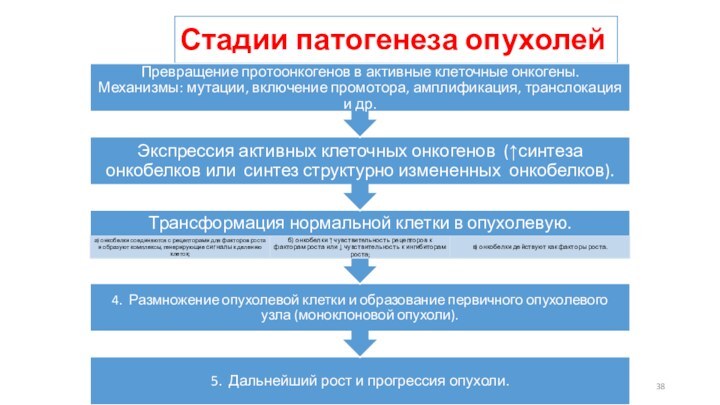
патологический процесс, характеризующийся безудержным размножением клеточных элементов без явлений
их созревания.
Клетки опухолей имеют не прекращающийся рост, в процессе роста они не созревают, сохраняя характер эмбриональных элементов.
«Формула» опухоли выглядит так: «плюс рост, минус дифференцировка».
Термин «доброкачественные опухоли» несколько условен, поскольку по существу они представляют собой очаговую гиперплазию ткани.
Слайд 3
Проблема опухолевого роста
Ежегодно в мире опухолями болеет свыше
5 млн. человек, а 2 млн. из них ежегодно
умирают;
Опухолевый рост — это одно из самых загадочных явлений биологии и медицины;
Пока не существует достаточно эффективных радикальных методов лечения опухолей;
В последние десятилетия произошло значительное увеличение частоты заболеваний опухолями.
В нашей стране «показатель запущенности» (выявление опухолей на 4 стадии развития) составляет 25%!
Слайд 4
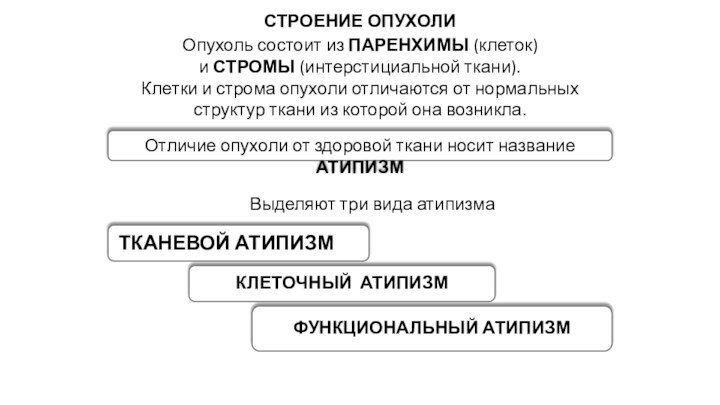
функциональный атипизм
Строение опухоли
тканевой атипизм
клеточный атипизм
Отличие опухоли от
здоровой ткани носит название атипизм
Выделяют три вида атипизма
Опухоль состоит
из паренхимы (клеток)
и стромы (интерстициальной ткани).
Клетки и строма опухоли отличаются от нормальных структур ткани из которой она возникла.
Слайд 5
Клетки опухоли не достигают зрелости,
не способны к
дифференцировке
Клеточный атипизм называется анаплазия
морфологическая анаплазия
биохимическая анаплазия
иммунологическая анаплазия
клеточный атипизм
Слайд 6
Клетки опухоли имеют свойства антигенов, они чужеродны собственному
организму и в нормальных условиях атипичные клетки уничтожаются иммунными
лимфоцитами. Опухоль образуется при снижении активности иммунной системы организма.
Клетки опухоли отличаются большим размером, неправильной формой, имеют различные включения; их ядра значительно увеличены, гиперхромны, с множеством ядрышек; митохондрии, рибосомы и эндоплазматическая сеть также увеличены.
В клетках опухоли изменён обмен веществ: усилен анаэробный гликолиз, развивается ацидоз. Клетки опухоли активно синтезируют липиды, поглощают аминокислоты (опухоль - «ловушка азота») и воду; накапливают калий и не задерживают кальций, в результате ткань опухоли непрочная, что способствует метастазированию.
морфологическая анаплазия
иммунологическая анаплазия
биохимическая анаплазия
Слайд 7
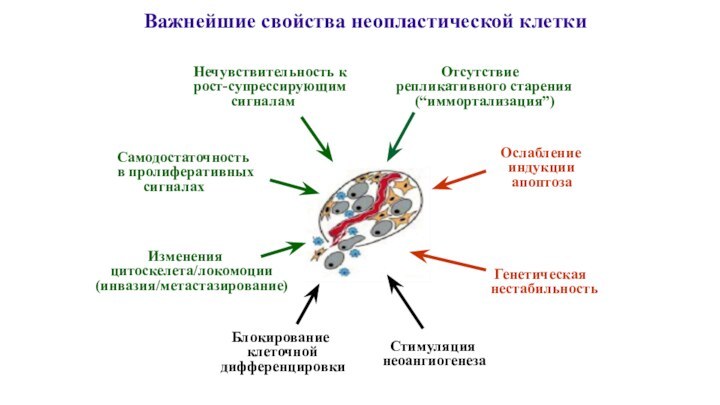
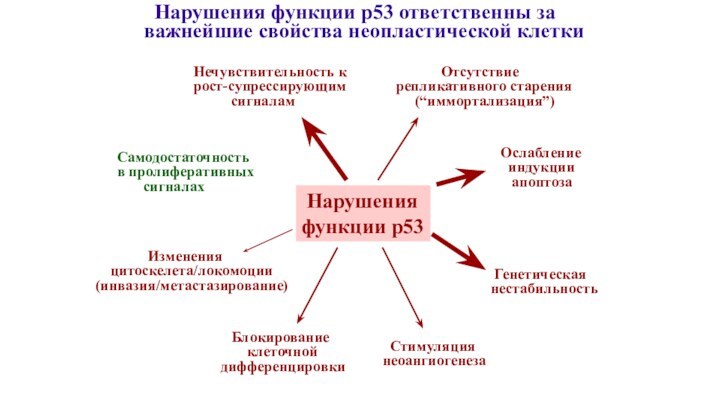
Нечувствительность к
рост-супрессирующим
сигналам
Отсутствие
репликативного старения
(“иммортализация”)
Стимуляция
неоангиогенеза
Самодостаточность
в пролиферативных
сигналах
Блокирование
клеточной
дифференцировки
Ослабление
индукции
апоптоза
Генетическая
нестабильность
Важнейшие свойства неопластической клетки
Изменения
цитоскелета/локомоции
(инвазия/метастазирование)
Слайд 8
Апоптоз - важнейший физиологический механизм
элиминации из организма
нежелательных клеток.
Ослабление индукции апоптоза в какой-либо из
клеток:
а) увеливает
вероятность образования из нее
неопластического клона;
б) понижает ее чувствительность к цитотоксическому
действию терапевтических средств.
Слайд 9
Нечувствительность к
рост-супрессирующим
сигналам
Отсутствие
репликативного старения
(“иммортализация”)
Стимуляция
неоангиогенеза
Самодостаточность
в пролиферативных
сигналах
Блокирование
клеточной
дифференцировки
Ослабление
индукции
апоптоза
Генетическая
нестабильность
Нарушения функции р53 ответственны за
важнейшие свойства неопластической клетки
Изменения
цитоскелета/локомоции
(инвазия/метастазирование)
Нарушения
функции p53
Слайд 10
S
G2
M
G1
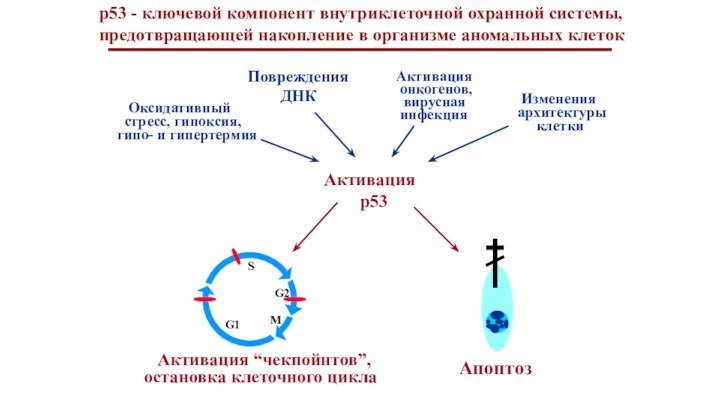
Активация
р53
Повреждения
ДНК
Активация
онкогенов,
вирусная
инфекция
Оксидативный
стресс, гипоксия,
гипо- и гипертермия
Изменения
архитектуры
клетки
Активация “чекпойнтов”,
остановка клеточного цикла
Апоптоз
р53 - ключевой компонент внутриклеточной охранной системы,
предотвращающей накопление в организме аномальных клеток
Слайд 11
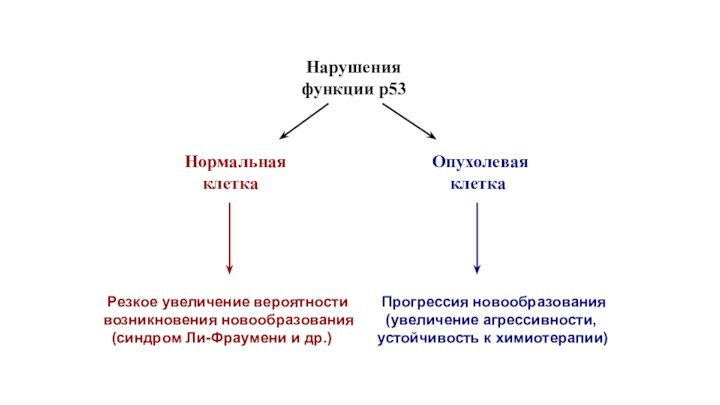
Нарушения
функции р53
Нормальная
клетка
Опухолевая
клетка
Резкое
увеличение вероятности
возникновения новообразования
(синдром Ли-Фраумени и др.)
Прогрессия новообразования
(увеличение агрессивности,
устойчивость к химиотерапии)
Слайд 12
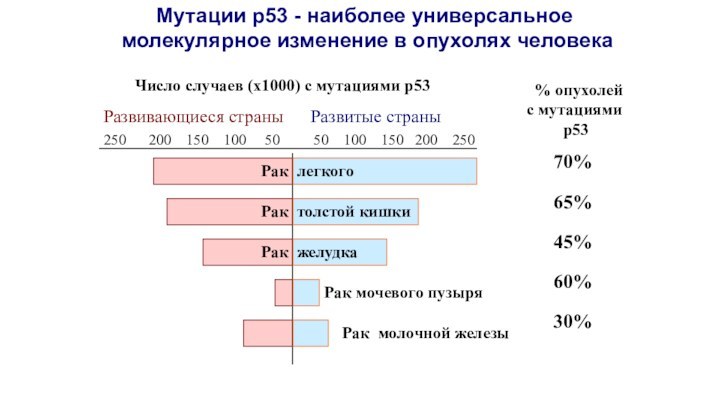
% опухолей
с мутациями
р53
250 200 150 100
50 50 100 150 200 250
Число случаев (х1000) с мутациями р53
Развивающиеся страны Развитые страны
Рак легкого
Рак толстой кишки
Рак молочной железы
Мутации р53 - наиболее универсальное
молекулярное изменение в опухолях человека
Рак желудка
70%
65%
45%
60%
30%
Рак мочевого пузыря
Слайд 13
Иммунология опухолей
Типы опухолевых
антигенов:
Антигены опухолей, которые индуцированы канцерогенными факторами. Эти антигены строго
индивидуальны.
Антигены вирусных опухолей. Эти антигены идентичны как для нескольких опухолей у одного объекта, так и для опухолей у разных особей, если они индуцированы одним и тем же вирусом.
Опухолеассоциированные трансплантационные антигены. Для этих антигенов характерны особенности, свойственные антигенам пересаженных органов.
Эмбриональные антигены. У ряда опухолей обнаружены антигены, характерные для эмбриональной ткани (карциноэмбриональные антигены, КЭА).
Гетероорганные антигены. В некоторых опухолях встречаются антигены, свойственные другим органам (например, в гепатоме — органоспецифический почечный антиген; в аденокарциноме почки — антигены, типичные для печени, легких и др.).
В иммунной защите организма против развивающейся опухоли решающая роль принадлежит не гуморальным факторам (антителам), а клеточным (лимфоцитам).
Слайд 14
Причины неэффективного иммунного ответа при опухолях
Иммунная реактивность организма
подавляется какими-то неспецифическими (не онкогенными) факторами (хр. заболевания,
СПИД, радиационное воздействие и т.д.).
Циркулирующие в крови противоопухолевые антитела вызывают «феномен усиления» опухоли.
«Противоопухолевые» рецепторы Т-лимфоцитов блокируются опухолевыми антигенами, циркулирующими в крови.
Если опухолевые клетки образовывались еще в организме плода и даже если они не стали инициаторами канцерогенеза, то к их антигенам возникает иммунологическая толерантность → в постнатальном периоде при их новом возникновении эти антигены воспринимаются не как «чужие», а как «свои».
Опухоли выделяют субстанции, обладающие выраженным иммуннодепрессивным действием (это дискутабельно).
Скорость роста опухоли опережает скорость развития иммунного ответа.
Баланс взаимодействия иммунной системы и опухоли определяется генетическими факторами.
Слайд 15
Биологические особенности, характерные
для доброкачественных и злокачественных опухолей
1. АТИПИЯ РАЗМНОЖЕНИЯ
Нерегулируемый,
беспредельный рост (первичный признак опухолей), утрата верхнего “лимита” числа делений клетки (лимит Хейфлика).
Патогенез:
Активация онкогенов и синтез онкобелков
Изменение структуры и функции мембран опухолевых клеток
Потеря антионкогенов
изменение функции генов, регулирующих апоптоз
активация теломеразы - фермента, восстанавливающего теломеры на концах ДНК.
Слайд 16
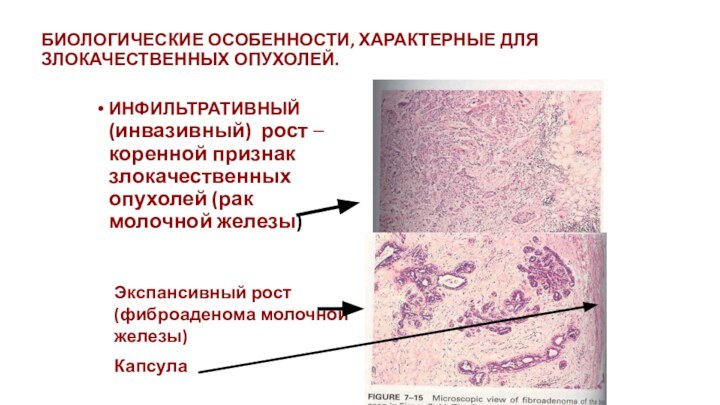
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ, ХАРАКТЕРНЫЕ ДЛЯ
ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ.
ИНФИЛЬТРАТИВНЫЙ (инвазивный) рост –
коренной признак злокачественных опухолей (рак молочной железы)
Экспансивный рост (фиброаденома
молочной железы)
Капсула
Слайд 17
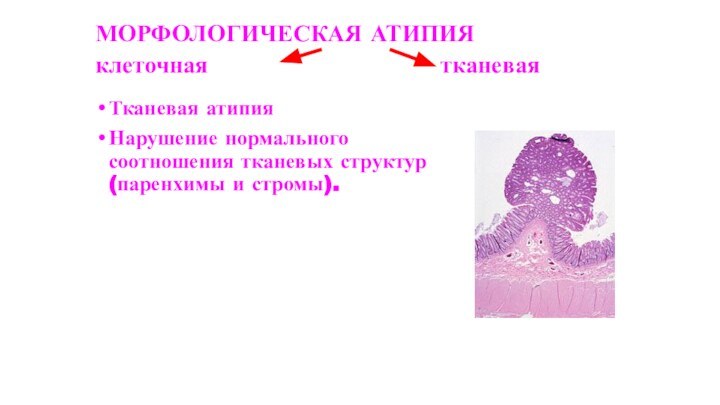
МОРФОЛОГИЧЕСКАЯ АТИПИЯ клеточная
тканевая
Тканевая атипия
Нарушение нормального соотношения тканевых структур (паренхимы и стромы).
Слайд 18
Клеточная атипия
Опухолевые клетки имеют разную форму и размеры,
ядра клеток увеличены, содержат большое количество хроматина, гиперхромны, увеличено
количество ядрышек, изменено число, форма и размеры хромосом.
Изменяется структура внутриклеточных органелл
Изменяется структура наружной мембраны – на ней появляется множество микроворсинок и выростов.
Слайд 19
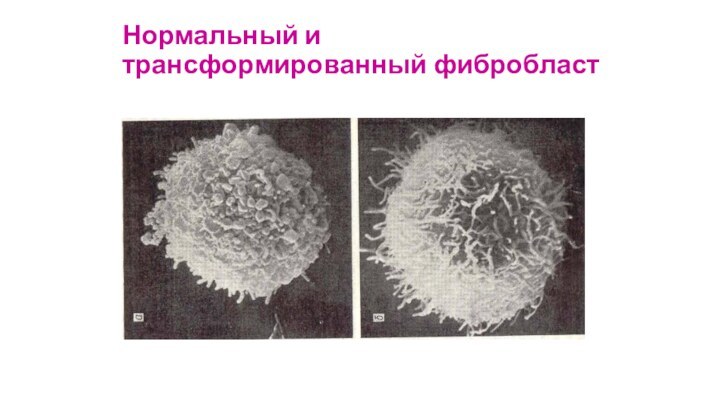
Нормальный и трансформированный фибробласт
Слайд 20
ФУНКЦИОНАЛЬНАЯ АТИПИЯ
Снижение функции ткани (при раке желудка снижается
секреция желудочного сока; при лейкозах незрелые лейкоциты не способны
фагоцитировать)
2) Повышение функции ткани (аденомы эндокринных желез усиливают синтез гормонов)
3) Выполнение функции, не характерной для ткани, из которой происходит опухоль (клетки опухоли легких, бронхов могут синтезировать гормоны гипофиза).
Слайд 21
Опухолевые клетки не способны адекватно функционировать, они
либо
чрезмерно активны
(гормональные опухоли эндокринных желёз)
либо не
справляются с функцией данной ткани
(опухоли кроветворной ткани при лейкозах)
либо продуцируют несвойственные для данной
ткани вещества (при миеломной болезни
образуются ненужные белки – парапротеины).
функциональный атипизм
Слайд 22
БИОХИМИЧЕСКАЯ АТИПИЯ (особенности обмена веществ в опухолевой ткани)
1) Особенности углеводного обмена.
а) опухоль –“ловушка” глюкозы крови
б) усиление
анаэробного гликолиза –эффект Варбурга
в) ослабление эффекта Пастера
Распад углеводов до пирувата и его превращение в лактат в опухолевых клетках может происходить в присутствии кислорода
г) активация пентозофосфатного пути окисления глюкозы
Слайд 23
Особенности жирового обмена
а) опухолевые клетки захватывают
из крови ЛПНП (липопротеиды низкой плотности) и антиоксиданты
(-токоферол)
б) ослаблен синтез жирных кислот, усилен синтез измененных фосфолипидов мембран
Слайд 24
ФИЗИКО-ХИМИЧЕСКАЯ АТИПИЯ
а) содержание калия и воды,
содержание кальция и магния;
б) ацидоз (анаэробный гликолиз содержание
молочной кислоты);
в) величина отрицательного заряда поверхности клеток взаимоотталкивание клеток
Слайд 25
АНТИГЕННАЯ АТИПИЯ
антигенное упрощение
антигенное усложнение
число органоспецифи-ческих белков-антигенов
(на поверхности многих клеток
исчезают антигены главного комплекса гистосовместимости.)
антигенная дивергенция- синтез антигенов, свойственных другим тканям
антигенная реверсия- синтез эмбриональных антигенов (фетопротеин, раково-эмбриональный антиген)
Слайд 26
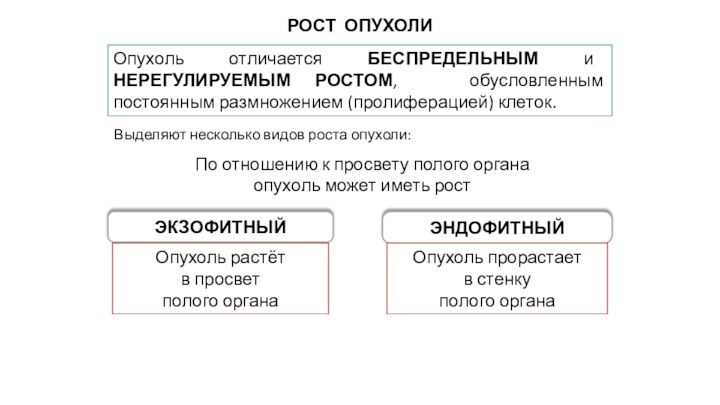
Рост Опухоли
Выделяют несколько видов роста опухоли:
По отношению к
просвету полого органа
опухоль может иметь рост
Эндофитный
Экзофитный
Опухоль растёт
в
просвет
полого органа
Опухоль отличается беспредельным и нерегулируемым ростом, обусловленным постоянным размножением (пролиферацией) клеток.
Опухоль прорастает
в стенку
полого органа
Слайд 27
Границы опухоли не видны. Клетки опухоли выходят за
её пределы, врастают в окружающие ткани и разрушают их.
Клетки опухоли также разрушают кровеносные и лимфатические сосуды, проникают в кровоток и переносятся в другие участки тела.
Опухоль растёт в своих пределах, хорошо видны её границы. Увеличиваясь в размерах она сдавливает окружающие ткани, которые атрофируются, превращаются в капсулу опухоли. Опухоль легко вылущивается из капсулы.
экспансивный
Инвазивный (Инфильтрирующий)
По отношению к окружающим тканям
опухоль может иметь рост
Слайд 28
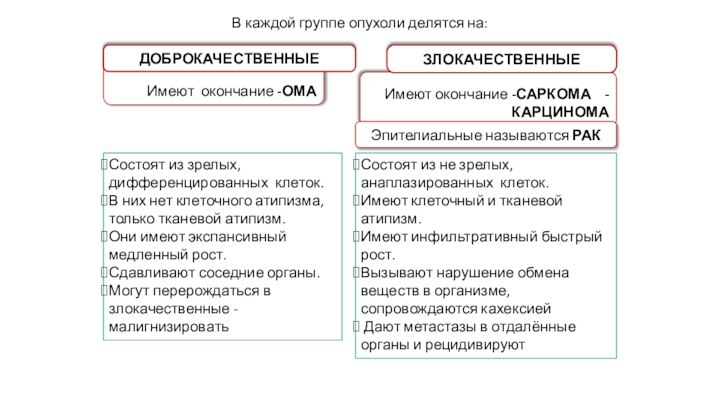
Имеют окончание -саркома -карцинома
Имеют окончание -ома
В
каждой группе опухоли делятся на:
злокачественные
доброкачественные
Состоят из зрелых, дифференцированных клеток.
В них нет клеточного атипизма, только тканевой атипизм.
Они имеют экспансивный медленный рост.
Сдавливают соседние органы.
Могут перерождаться в злокачественные - малигнизировать
Состоят из не зрелых, анаплазированных клеток.
Имеют клеточный и тканевой атипизм.
Имеют инфильтративный быстрый рост.
Вызывают нарушение обмена веществ в организме, сопровождаются кахексией
Дают метастазы в отдалённые органы и рецидивируют
Эпителиальные называются рак
Слайд 30
Нейрогуморальные влияния на развитие опухолей
Опухоли, обладая
значительной автономией в организме, все же подчиняются как гуморальным, так и нервным влияниям и находятся в тесной связи с деятельностью эндокринной и нервной систем. Введением больших доз мужских половых гормонов можно затормозить развитие опухолей женской половой сферы (и наоборот).
Установлено наличие в опухолевой ткани нервных окончаний, что делает неизбежными и процессы рецепции.
Сильные воздействия на те или иные участки нервной системы могут привести к развитию опухолей. Показано, что повреждение соответствующих симпатических нервов у устойчивых по отношению к опухолям животных (морские свинки), нередко вызывает у них опухоли слюнных желез.
Развитие опухоли во многом зависит от функционального состояния коры головного мозга. При невротизации животных у них возникают опухоли.
Слайд 31
Предраковые состояния
Предрак — это
патологическое состояние, характеризующееся длительным сосуществованием атрофических, дистрофических и пролиферативных
процессов, которое предшествует развитию злокачественной опухоли и в большом числе случаев с нарастающей вероятностью в нее переходит.
Облигатные (обязательные) предраки всегда переходят в злокачественные опухоли, например, пигментная ксеродерма. Прекарциноматозные состояния, которые не всегда озлокачествляются, являются факультативными (необязательными) предраками.
Л.М. Шабад «Всякий рак имеет свой предрак, но не всякий предрак переходит в рак».
Слайд 32
Наиболее типичные предраковые состояния
Слайд 33
Этиология злокачественных опухолей
Наиболее ранней является воспалительная теория опухолевого

генеза (Вирхов). Принимается в той части, которая касается значения
хронических пролиферативных воспалительных процессов как предраковых состояний.
Теория эмбриональных зачатков (Конгейм). Суть → в процессе эмбриогенеза некоторые клетки или группы клеток могут «заблудиться» и попасть в совершенно другой орган. Иногда эти клетки могут начать бурно размножаться и дать основу возникновения злокачественной опухоли. Гипотеза Конгейма вполне применима к опухолям-уродствам (тератомам).
Теория химического канцерогенеза. Наиболее мощным канцерогенным действием обладают производные циклических углеводородов (метилхонантрен, дибензопирен и др.). Канцерогенным действием обладают и некоторые физические факторы (проникающая радиация, ультрафиолетовое излучение, озон и др.).
Вирусная теория (Роуз,1911). Сейчас обнаружено только 3 вируса, связанные с опухолями человека: вирус Эпштеин–Барр, вирус цитомегалии, вирус папилломы.
Слайд 34
Канцерогены
Канцерогенными называют
факторы, способные при воздействии на организм превращать нормальную соматическую
клетку в опухолевую.
Когда у определенного химического вещества выявляют свойство вступать в реакцию с ДНК, меняя ее структуру и вызывать мутации генов как причину озлокачествления различных клеток, то его относят к ДНК-реактивным или генотоксическим канцерогенам (их большинство).
Канцерогены, чье действие не затрагивает генетический материал клетки (выступают исключительно в роли промоторов), называют эпигенетическими канцерогенами. Они вызывают злокачественные новообразования и клоны малигнизированных клеток через свои цитотоксические эффекты, хроническое травмирование тканей, при эндокринопатиях, приводя к иммунодефициту и другим расстройствам функциональных систем.
Слайд 35
Патогенез злокачественных опухолей
Мутационная теория
. Химический или физический фактор является канцерогенным если он
приводит к деполимеризации молекулы ДНК. ► образуются отдельные группы нуклеотидов, которые затем, в силу способности ДНК к самосборке, рекомбинируются в новую молекулу ДНК, в которой могут быть закодированы и новые наследственные свойства, в том числе и способность к безудержному росту и размножению клетки без явлений ее созревания.
При вирусном канцерогенезе также происходит мутация. Вирус либо «встраивается» в молекулу ДНК, либо «переписывает» на нее свою информацию, после чего данная клетка начинает воспроизводить себе подобные согласно уже не своему генетическому коду, а в соответствии с генетическим кодом данного вируса.
Слайд 36
Молекулярные механизмы канцерогенеза
Канцерогенез — ряд изменений генетического материала

клетки, которые окончательно придают ей фенотипические признаки злокачественной (малигнизированной).
Протоонкоген
— это нормальный ген, который приобретает свойства онкогена в результате изменения нуклеотидной последовательности ДНК.
Изменение структуры ДНК служит причиной мутации определенных генов (протоонкогенов) и генов-супрессоров опухолей. Экспрессия измененного генома клетки, содержащего онкогены и инактивированные гены-супрессоры опухолей, патологически меняет клеточный фенотип. В результате клетка приобретает свойства, характеризующие ее как злокачественную.
Протоонкогены кодируют белки (протоонкопротеины), необходимые для нормальной регуляции клеточного роста (влияют на экспрессию генов или участвуют в передаче сигнала геному от цитокинов — факторов клеточного роста). Мутация протоонкогенов ведет к их активации, т. е. к приобретению продуктами их экспрессии свойств онкопротеинов. Онкопротеины — это белки, чье действие на клетку на уровне наружной мембраны, цитоплазматических рецепторов и ядра может вызвать канцерогенез.
Слайд 37
Молекулярные механизмы канцерогенеза
Кроме
точечных мутаций, механизмом активации протоонкогенов могут быть цитогенетические аномалии:
транслокация, амплификация генов, а также потеря хромосомами своих частей (делеция).
Процесс возникновения выявляемых при обследовании больного раковых опухолей или клона злокачественных клеток из одной малигнизированной или группы озлокачествленных клеток называют промоцией (от англ. — содействие).
Экзогенное вещество или эндогенный агент эндокринной природы, пара- или аутокринной регуляции, чье действие на клетки обусловливает промоцию, называют промотором.
Промотор не может вызывать рак без предшествующего многоэтапного и комплексного изменения генетического материала клетки. !!
Слайд 39
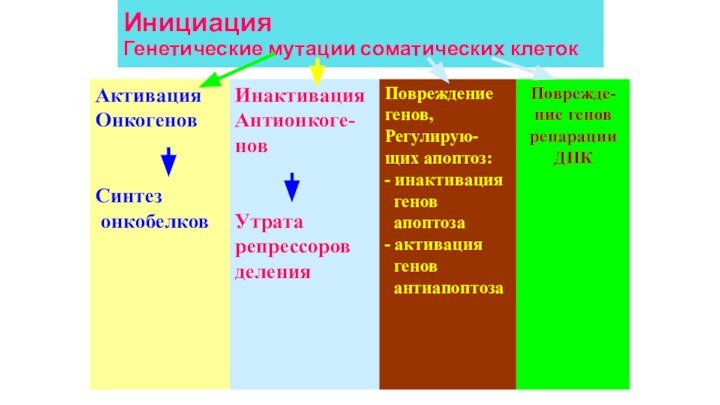
Инициация
Генетические мутации соматических клеток
Слайд 40
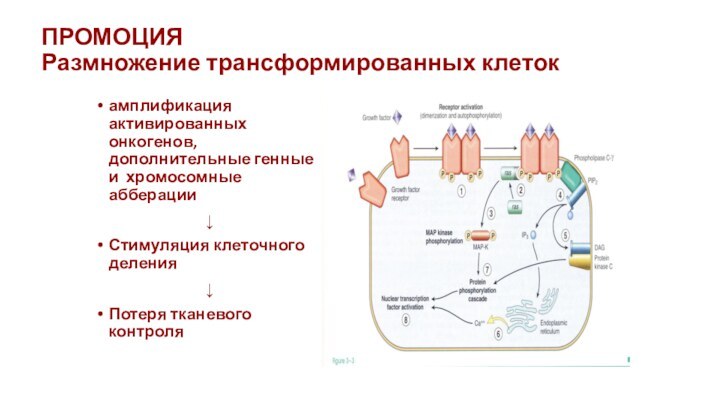
ПРОМОЦИЯ
Размножение трансформированных клеток
амплификация активированных онкогенов, дополнительные генные и
хромосомные абберации
Стимуляция клеточного деления
Потеря тканевого контроля
Слайд 41
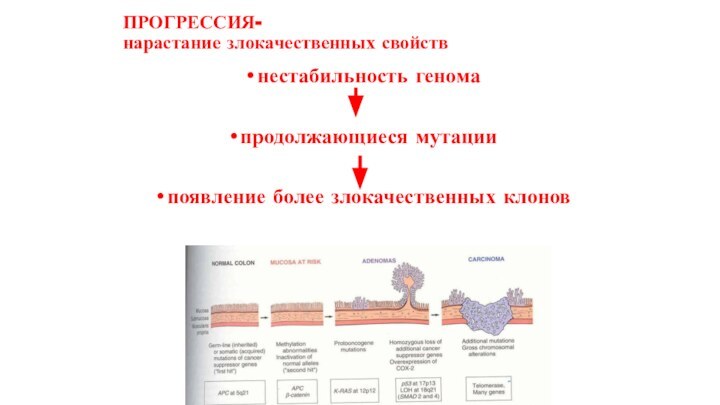
ПРОГРЕССИЯ-
нарастание злокачественных свойств
нестабильность генома
продолжающиеся мутации
появление более злокачественных
клонов
Слайд 42
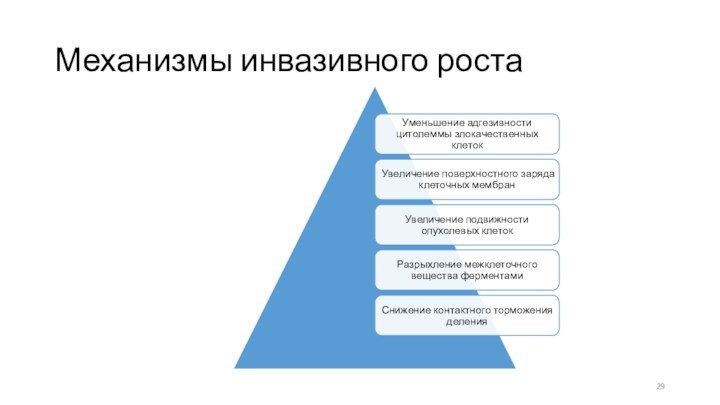
ПАТОГЕНЕЗ ИНФИЛЬТРАТИВНОГО РОСТА
а) Снижение сил сцепления между опухолевыми
клетками: уменьшение количества адгезивных молекул – кадхеринов (E-cadherin), интегринов
на поверхности опухолевых клеток, обеспечивающих сцепление клеток друг с другом.
Изменение расположения рецепторов к белкам соединительной ткани.
Слайд 43
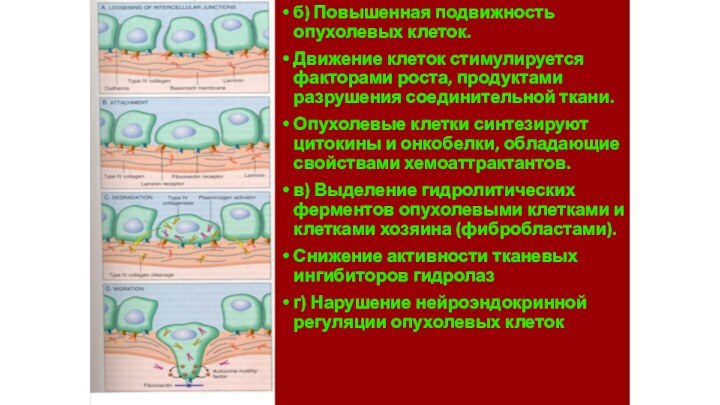
б) Повышенная подвижность опухолевых клеток.
Движение клеток стимулируется факторами
роста, продуктами разрушения соединительной ткани.
Опухолевые клетки синтезируют цитокины и
онкобелки, обладающие свойствами хемоаттрактантов.
в) Выделение гидролитических ферментов опухолевыми клетками и клетками хозяина (фибробластами).
Снижение активности тканевых ингибиторов гидролаз
г) Нарушение нейроэндокринной регуляции опухолевых клеток
Слайд 45
МЕТАСТАЗИРОВАНИЕ
(от греч. metastasis перемещение, перенос) – процесс
переноса отдельных клеток опухоли в другие органы и развитие
в них вторичных опухолевых узлов той же гистологической структуры.
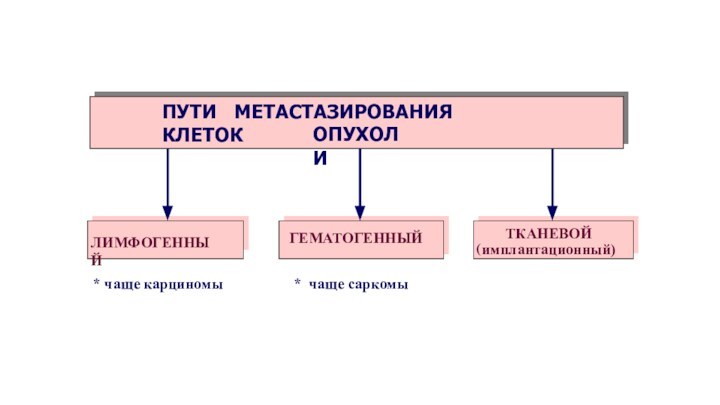
Пути метастазирования опухолевых клеток:
лимфогенный (перенос клеток лимфой по лимфатическим сосудам)- характерен для карцином
гематогенный (по кровеносным сосудам) – характерен для сарком
гематолимфогенный
«полостной» (перенос клеток опухоли жидкостями в полостях тела, например цереброспинальной жидкостью)
имплантационный – прямой переход опухолевых клеток с поверхности опухоли на поверхность органа или ткани, с которым она контактирует.
Слайд 46
Метастазирование
Метастазирование – перемещение опухолевых клеток
из первичной опухоли на расстояние с образованием вторичных опухолевых
узлов (метастазов).
Пути метастазирования:
гематогенный → по кровеносным сосудам;
лимфогенный → по лимфатическим сосудам (наиболее частый);
тканевой → от одной ткани к другой или по межтканевым пространствам.
Слайд 47
Причины метастазирования
В стенку кровеносных и лимфатических сосудов, проходящих
через опухоль, входят клетки опухолевой ткани, вследствие чего эти
клетки легко попадают в крово- и лимфоток.
Вследствие ослабления сцепления между опухолевыми клетками они легко отрываются от опухоли.
Опухоли имеют довольно рыхлую строму, что облегчает отрыв клеток.
Метастазирование — не просто пассивный процесс переноса опухолевых клеток, а активный
Для превращения метастаза в опухолевый очаг необходим определенный латентный период между попаданием опухолевой клетки в орган и развитием новообразования.
Метастаз превращается в опухоль далеко не в каждом органе, в который он попадает, а только в некоторых.
Слайд 48
Раковая кахексия
Быстрорастущие опухоли

«перехватывают» у других тканей предшественников пиримидиновых нуклеотидов, стремительно вовлекая
их в образование собственных нуклеиновых кислот. Ослабляется синтез белков в тканях и масса последних ⇓.
Опухоли являются «ловушками» аминокислот, в том числе и незаменимых, что сказывается на биосинтезе белков в тканях.
Опухоли успешно конкурируют с нормальными тканями за витамины, поглощая их значительно интенсивнее.
Глюкоза в опухоли с аномально высокой скоростью метаболизируется до молочной кислоты. Концентрация глюкозы в опухолевой ткани ↓ практически до нулевого уровня, и глюкоза начинает из организма насасываться в опухоль, а другие ткани лишаются главного энергетического субстрата.
Организм включает все возможные механизмы для предотвращения возникновения гипогликемии, резко активируется глюконеогенез, в процессе которого глюкоза синтезируется из аминокислот. Защитный в отношении синтеза глюкозы глюконеогенез приводит к ↓ количества аминокислот и ↑ нарушений процессов белкового синтеза.
Слайд 50
* Виды метастазирования (на примере опухоли тонкого кишечника)
пищевод
желудок
печень
тонкий
кишечник
толстый
кишечник
МЕТАСТАЗИРОВАНИЕ – это способность клеток злокачест-венных опухолей к
отрыву от опухоли, переносу их в другие органы с последующим развити-ем на месте их имплантации аналогичного новообразования.
регионарные
лимфоузлы
лёгкие
воротная
вена
Существуют три пути метаста-зирования:
1. Тканевой – непосредственно от одной ткани к другой или – по межтканевым пространствам.
2. Лимфогенный – по лимфати-ческим сосудам.
3. Гематогенный – по кровенос-ным сосудам.
опухоль
18
Слайд 51
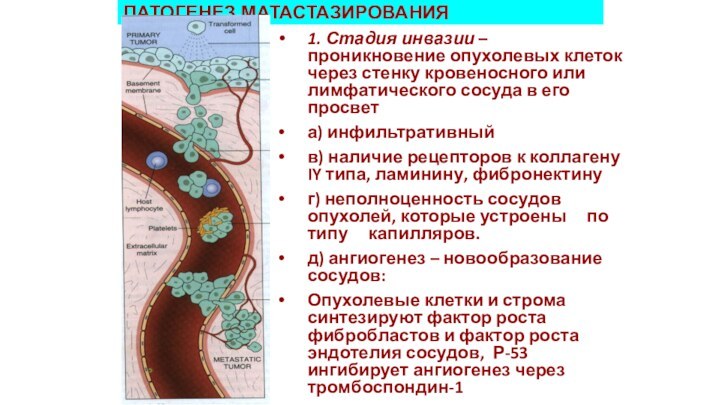
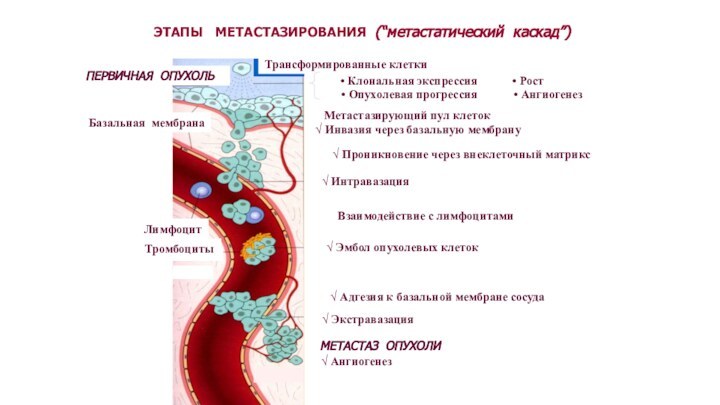
ПАТОГЕНЕЗ МАТАСТАЗИРОВАНИЯ
1. Стадия инвазии – проникновение опухолевых клеток
через стенку кровеносного или лимфатического сосуда в его просвет
а)
инфильтративный
в) наличие рецепторов к коллагену IY типа, ламинину, фибронектину
г) неполноценность сосудов опухолей, которые устроены по типу капилляров.
д) ангиогенез – новообразование сосудов:
Опухолевые клетки и строма синтезируют фактор роста фибробластов и фактор роста эндотелия сосудов, Р-53 ингибирует ангиогенез через тромбоспондин-1
Слайд 52
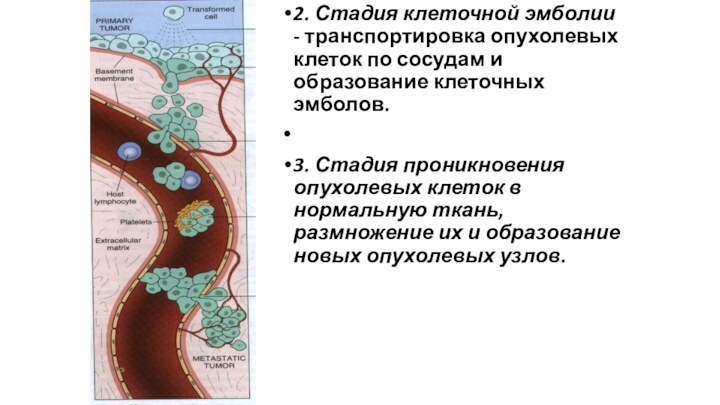
2. Стадия клеточной эмболии - транспортировка опухолевых клеток
по сосудам и образование клеточных эмболов.
3. Стадия проникновения
опухолевых клеток в нормальную ткань, размножение их и образование новых опухолевых узлов.
Слайд 53
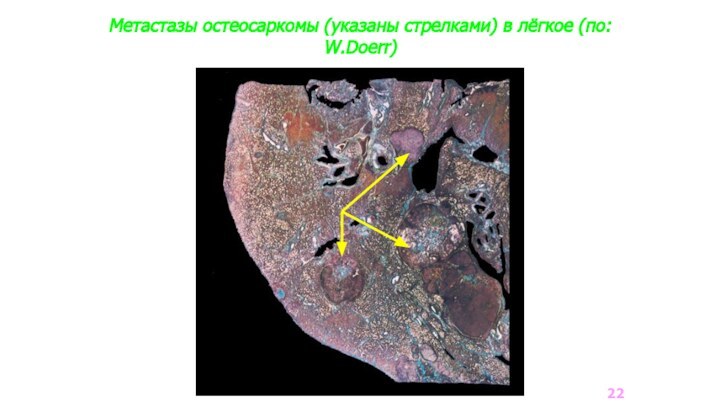
Метастазы остеосаркомы (указаны стрелками) в лёгкое (по: W.Doerr)
22
Слайд 54
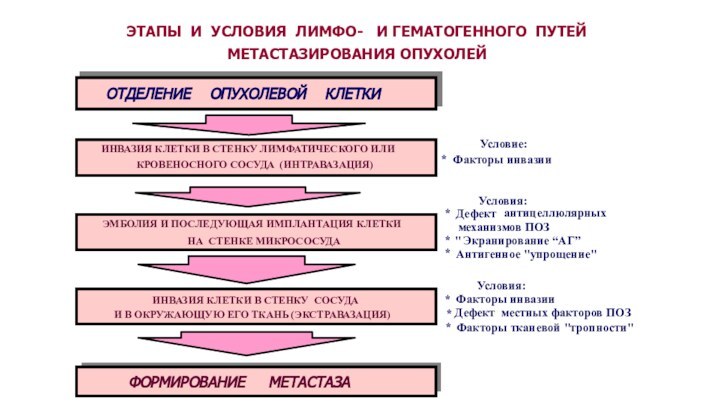
ЭТАПЫ И УСЛОВИЯ ЛИМФО- И ГЕМАТОГЕННОГО ПУТЕЙ
МЕТАСТАЗИРОВАНИЯ
ОПУХОЛЕЙ
ОТДЕЛЕНИЕ ОПУХОЛЕВОЙ КЛЕТКИ
ИНВАЗИЯ КЛЕТКИ В СТЕНКУ ЛИМФАТИЧЕСКОГО ИЛИ
КРОВЕНОСНОГО СОСУДА (ИНТРАВАЗАЦИЯ)
ЭМБОЛИЯ И ПОСЛЕДУЮЩАЯ ИМПЛАНТАЦИЯ КЛЕТКИ
НА СТЕНКЕ МИКРОСОСУДА
ИНВАЗИЯ КЛЕТКИ В СТЕНКУ СОСУДА
И В ОКРУЖАЮЩУЮ ЕГО ТКАНЬ (ЭКСТРАВАЗАЦИЯ)
ФОРМИРОВАНИЕ МЕТАСТАЗА
Слайд 58
РЕЦИДИВИРОВАНИЕ
(от лат. recidivas- возврат, повторное развитие болезни) –
повторное развитие опухоли на месте удаления.
Причины рецидивов:
а) неполное удаление
опухолевых клеток.
б) имплантация клеток опухоли в нормальную ткань при грубых массивных хирургических вмешательствах.
в) иммунодепрессия.
г) продолжающееся действие канцерогенов или сохранение причинных факторов опухолевого роста.
Слайд 59
КАХЕКСИЯ (от греч. kakos– плохой, дурной + hexis-состояние)
синдром истощения и общей слабости организма
Патогенез:
а) Феномен «субстратных
ловушек».
б) Образование опухолевыми клетками и макрофагами интерлейкина-1 и фактора некроза опухолей, которые оказывают системное действие на организм (снижение аппетита, распад мышечных белков, лихорадку)
в) Нарушение нейро-эндокринной регуляции обмена веществ организма-носителя опухоли.
г) Интоксикация продуктами распада опухоли
Слайд 60
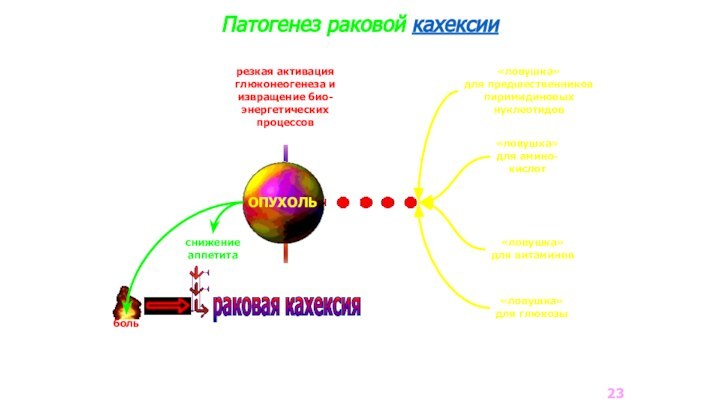
Патогенез раковой кахексии
ОПУХОЛЬ
боль
снижение
аппетита
«ловушка»
для предшественников
пиримидиновых
нуклеотидов
«ловушка»
для амино-
кислот
«ловушка»
для витаминов
«ловушка»
для глюкозы
резкая активация
глюконеогенеза
и
извращение био-
энергетических
процессов
раковая кахексия
23
Слайд 63
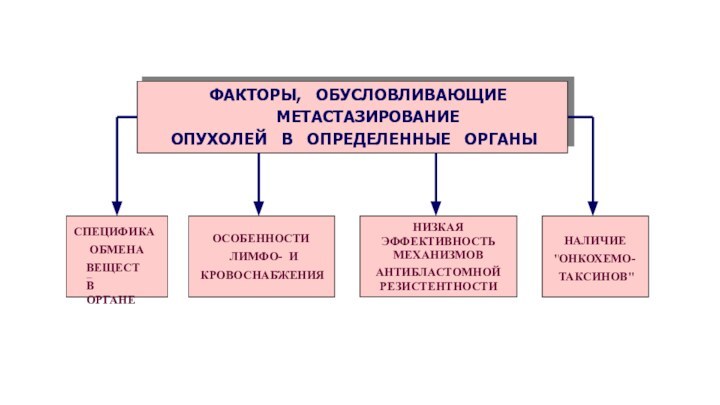
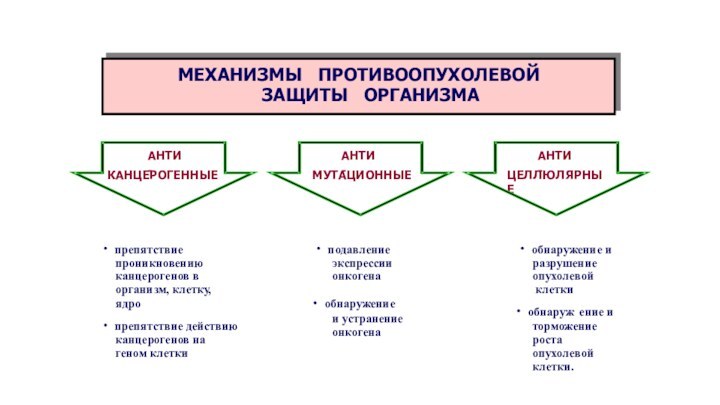
МЕХАНИЗМЫ АНТИБЛАСТОМНОЙ РЕЗИСТЕНТНОСТИ
АНТИКАНЦЕРОГЕННЫЕ
действуют против канцерогенов
реакции инактивации канцерогенов (окисление,
восстановление, метилирование, ацетилирование, конъюгация с глюкуроновой кислотой);
элиминация канцерогенов
в составе желчи, мочи, кала;
образование антител против канцерогенов
активация антиоксидантной системы и торможение образования свободных радикалов.
уничтожение онкогенных вирусов;
Слайд 64
АНТИТРАНСФОРМАЦИОННЫЕ
предотвращают превращение нормальной клетки в опухолевую
(функция ферментов
репарации ДНК, антионкогенов, генов апоптоза)
Слайд 65
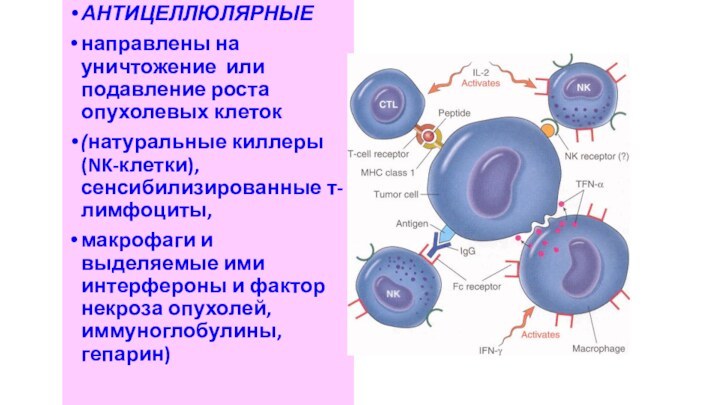
АНТИЦЕЛЛЮЛЯРНЫЕ
направлены на уничтожение или подавление роста опухолевых клеток
(натуральные
киллеры (NK-клетки), сенсибилизированные т-лимфоциты,
макрофаги и выделяемые ими интерфероны
и фактор некроза опухолей, иммуноглобулины, гепарин)
Слайд 66
МЕТОДЫ ЛЕЧЕНИЯ И ПОИСК НОВЫХ СПОСОБОВ ЛЕЧЕНИЯ
РАКА
Классическая триада используемая для лечения онкологических заболеваний.
Основным радикальным
методом лечения рака является хирургическое вмешательство.
Широко используется лучевая терапия, которая основана на различной радиочувствительности нормальных и опухолевых клеток, т.к. у опухолевых клеток повышены процессы синтеза ДНК.
Третьим, методом является лекарственная терапия (гормоно- и химиотерапия). Однако при этом раковые клетки быстро приобретают устойчивость к лекарствам.
Слайд 67
Эффективные способы лечения некоторых видов рака
Различные типы рака
являются по сути различными заболеваниями. Успехи, достигнутые в последние
годы в изучении механизмов развития заболевания позволили разработать эффективные способы лечения некоторых видов рака.
Среди них:
лимфома Ходжкина,
рак яичек,
хорионкарцинома,
некоторые виды лейкозов.
Слайд 68
Новые методы лечения онкологических заболеваний
В последнее время в
связи с успехами достигнутыми в молекулярной биологии для лечения
опухолей стали использовать такие современные методы лечения как:
иммунотерапия,
трансплантационная терапия,
терапия связанная с ингибированием ангиогенеза,
фотодинамическая терапия,
генная терапия,
сопряжённую с генной, терапия, направленная на активацию в опухолевых клетках генов-супрессоров и проапоптотических генов.
Слайд 69
Иммунотерапия
Интерлейкин –2 стал успешно использоватся для лечения больных
с метастатической меланомой или раком почки вместе со специфическими
для данного больного антигенами (онкобелками)
Выявление и использование специфических для больного раковых антигенов, открывает новые возможности для иммунотерапии рака.
Антираковые лимфоциты могут быть наработаны путем клонирования in vitro и затем введены в кровь.
Использование низких доз химиотерапии и наиболее эффективной иммунотерапии значительно снижают немедленный и отдаленный токсических эффект и смертность.
Показана возможность использования новой вакцины к опухолевым клеткам, повышающих и стимулирующих иммунную систему пациента.
Слайд 70
Ингибирование онкобелка РТР1В
В феврале 2011 года канадские учёные,
изучая фермент тормозящий работу иммунной системы (РТР1В), показали, что
если этот фермент активен, то иммунная система больного не в состоянии противостоять росту раковых клеток.
РТР1В синтезируется онкогеом НЕR -2 и если этот ген в эксперименте в результате мутации активируется, то практически все исследованные животные становятся склонными к развитию рака молочной железы и легких.
После того как из организма был удалён РТР1В (онкобелок) уровень роста и развития опухолей заметно снизилось.
Необходимо искать химические ингибиторы этого онкобелка.
Слайд 71
Фотодинамическая терапия
Эта терапия применяется при лечении поверхностных раков,
например меланом и рака предстательной железы.
В организм вводят
фотосенсибилизаторы, например гематопорфирины и эти вещества избирательно накапливаются в опухолевых клетках.
Затем поражённую поверхность обрабатывают лазером с определённой длиной волны, в зависимости от использованного фотосенсибилизатора и опухолевые клетки разрушаются.
Эта терапия широко используется в странах Средней Азии и в Москве
Слайд 72
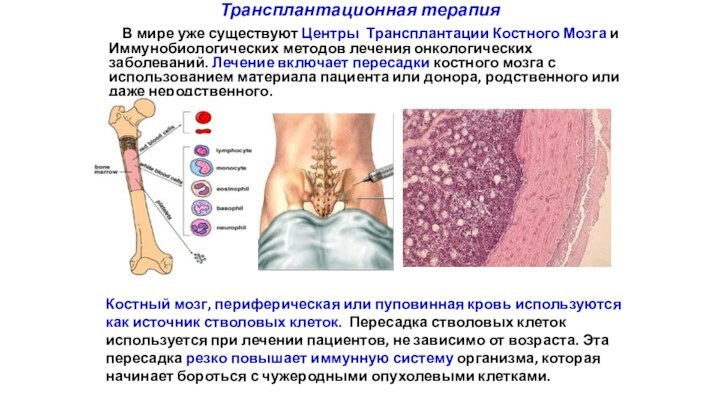
Трансплантационная терапия
В мире уже существуют Центры Трансплантации Костного
Мозга и Иммунобиологических методов лечения онкологических заболеваний. Лечение включает
пересадки костного мозга с использованием материала пациента или донора, родственного или даже неродственного.
Костный мозг, периферическая или пуповинная кровь используются как источник стволовых клеток. Пересадка стволовых клеток используется при лечении пациентов, не зависимо от возраста. Эта пересадка резко повышает иммунную систему организма, которая начинает бороться с чужеродными опухолевыми клетками.
Слайд 73
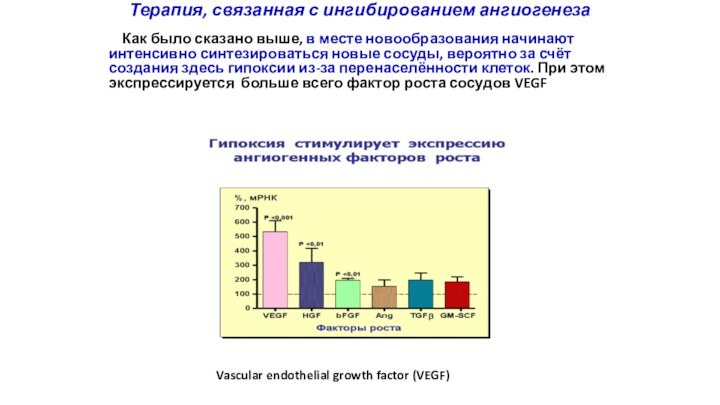
Терапия, связанная с ингибированием ангиогенеза
Как было сказано выше,
в месте новообразования начинают интенсивно синтезироваться новые сосуды, вероятно
за счёт создания здесь гипоксии из-за перенаселённости клеток. При этом экспрессируется больше всего фактор роста сосудов VEGF
Vascular endothelial growth factor (VEGF)
Слайд 74
How cancer becomes dangerous
YEARS…
Harmless
Слайд 75
VEGF - мощный регулятор сосудистой проницаемости, механизм его
действия
При экспрессии VEGF наблюдается подтекание белков плазмы через
стенку сосуда и формирование экстравазального фибринового геля. Этот гель представляет собой подходящую среду для роста клеток эндотелия.
Кровеносные сосуды опухоли в функциональном отношении незрелы, и по многим важным аспектам отличаются от обычных кровеносных сосудов.
Для выживания эндотелиальных клеток незрелых опухолевых кровеносных сосудов необходимы внешние сигналы, такие как VEGF; в отсутствие таких сигналов эндотелий подвергается апоптозу.
В отличие от этого, эндотелиальные клетки здоровых сосудов окружены перицитами, которые поддерживают их и избавляют от необходимости в VEGF
Слайд 76
Кровеносные сосуды опухоли по многим важным аспектам отличаются
от обычных кровеносных сосудов
Блокада VEGF вызывает обратное развитие
этих незрелых сосудов, не влияя при этом на зрелые, полноценные сосуды.
Сосудистая сеть опухоли имеет аномальное строение, характеризуется дезорганизацией, неравномерным распределением и чрезмерной извитостью
VEGF стимулирует образование лимфатических сосудов
Установлено, что VEGF индуцирует как лимфоангиогенез, так и распространение опухолевых клеток в регионарные лимфатические узлы.
Экспрессия ростовых факторов типа VEGF может определять способность опухоли к метастазированию.
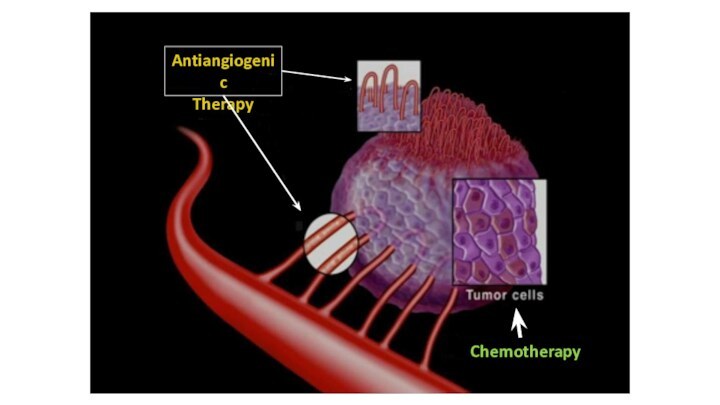
Слайд 77
Antiangiogenic
Therapy
Chemotherapy
Слайд 78
Блокада VEGF - обоснованный метод противоопухолевой терапии
Ингибирование VEGF
представляет собой новаторский подход к противоопухолевой терапии и может:
привести к обратному развитию незрелых кровеносных сосудов, типичных для опухолей
снизить проницаемость сосудов и, тем самым, внутриопухолевое давление
Уменьшить вероятность метастазирования опухоли.
Было установлено, что анти-ангиогенезные препараты останавливают рост сосудов опухолей и, тем самым, лишая её питания и развития.
Один из наиболее перспективных подходов к блокаде VEGF -создание моноклональных антител к VEGF. Одной из разновидностей таких антител - препарат бевацизумаб.
.
Слайд 79
Генетическая терапия опухолей
Выделение специфичных для определённых тканей онкобелков
Ведутся
работы по выделению онкобелков- ростовых факторов (РФ) из разных
тканей и поиску агентов, блокирующих работу онкогенов.
Обнаружение ферментов участвующих в копировании генетической структуры
Активация онкогенов часто связана с мутацией генов, кодирующих ферменты, участвующие в копировании генетической структуры. Были найдены киназы, ингибирующие эти ферменты
.
Использование анти- смысловых олигануклеотидов
Для ингибирования онкогена стали использоваться антисмысловые олигонуклеотиды. Они встраиваются в определённые участки ДНК. При этом генетическая структура не подвергается изменению, а подавляется только активность онкогенов.
Слайд 80
При лечении заболеваний, характеризующихся иммунодефицитом, проводится работа по
применению обработанных стволовых клеток и Т-лимфоцитов.
Примером подобного рода
работ, описанная в августовском номере журнала New England J Medicine 2011; 365:725.
В Университете Пенсильвания (США ) было прооперировано 3 больных, у которых была миэлоидная лейкемия, в стадии не поддающейся лечению. Эти больные уже не могли самостоятельно двигаться. У них, с помощью специальных магнитных шариков удалили из крови все Т-лимфоциты (биллион!) (Т-киллеры), которые обычно борются с опухолями. Этим клеткам in vitro ввели новый ген, который способствует связыванию этих Т-лимфоцитам с патологически изменёнными В- лимфоцитами, имеющими СД19 рецептор, чтобы разрушить эти больные клетки.
Слайд 81
Результаты генно-иммунной терапии:
через 10 дней у больных резко

повышалась температура
через 2-3 недели у больных температура снизилась, а
у двух их них при анализе было обнаружено, что все патологически изменённые В- лимфоциты исчезли из крови, из костного мозга и лимфатических желёз;
при этом у каждого больного было разрушено 2 фунта раковых клеток. Однако, этим больным пока требуется периодически вводить гамаглобулины для поднятия иммунитета.
Самочувствие больных после генной терапии значительно улучшилось, они стали физически подвижными и могли продолжать заниматься теннисом и выполнять другие физические нагрузки.
До настоящего времени двое больных чувствуют себя хорошо. У третьего больного ремиссия была частичной. Учитывая плохой прогноз у всех исследуемых больных до лечения, использование этого метода генной инженерии, по мнению многих учёных, должно быть продолжено, хотя пока только на безнадёжных больных.
Эта работа показывает, что достигнутые к настоящему времени успехи в области нано- и молекулярной биологии, уже начали давать свои плоды.