- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде.
Содержание
- 2. Задание 37 № 1627. Нитрат калия нагрели с порошкообразным свинцом
- 3. Пояснение.
- 4. Задание 37 № 1630.Смесь порошков нитрита калия и хлорида
- 5. Пояснение.
- 6. Задание 37 № 1632. Хлор прореагировал с горячим раствором гидроксида
- 7. Пояснение.
- 8. Задание 37 № 1635. Кристаллы хлорида калия обработали концентрированной серной
- 9. Пояснение.
- 10. Задание 37 № 1640. Две соли окрашивают пламя в фиолетовый
- 11. Пояснение.В фиолетовый цвет окрашивают пламя соли калия.
- 12. Задание 37 № 1641. Вещество, выделяющееся на катоде при электролизе
- 13. Пояснение.При электролизе расплава соли на катоде выделяется
- 14. Задание 37 № 1642. Продукт взаимодействия азота и лития обработали
- 15. Пояснение.При взаимодействии азота и лития образуется нитрид
- 16. Задание 37 № 1624. Раствор иодида калия обработали избытком хлорной
- 17. Пояснение.
- 18. Расставьте коэффициенты методом электронного баланса в следующих
- 19. Задание 37 № 1629. Магний растворили в разбавленной азотной кислоте,
- 20. Пояснение.
- 21. Задание 37 № 1643. Продукт взаимодействия фосфида магния с водой
- 22. Пояснение.Фосфид магния гидролизутся водой (уравнение 1) с
- 23. Задание 37 № 1644. Магниевый порошок смешали с кремнием и
- 24. Пояснение.При сплавлении магния и кремния образуется силицид
- 25. Задание 37 № 1647. Кальций нагрели в атмосфере водорода. Продукт
- 26. Пояснение.При взаимодействии очень активного металла кальция с
- 27. Задание 37 № 3991. Газ, полученный при обработке нитрида кальция
- 28. Скачать презентацию
- 29. Похожие презентации
Задание 37 № 1627. Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов отработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В
















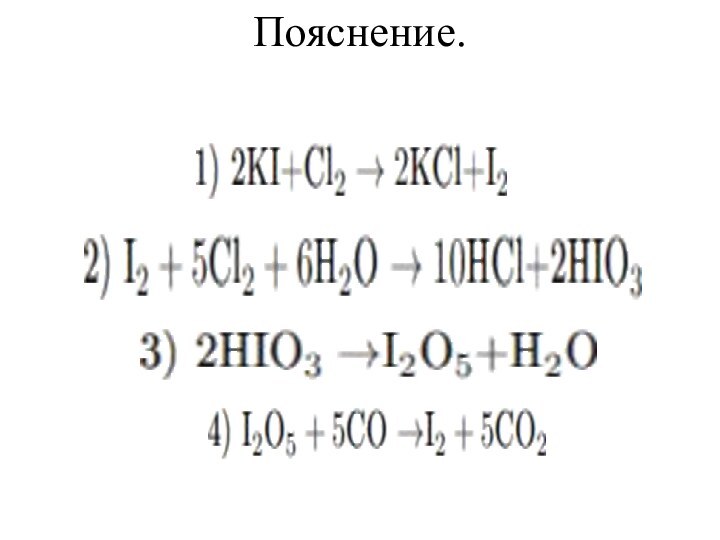











Слайд 4
Задание 37 № 1630.
Смесь порошков нитрита калия и хлорида аммония
растворили в воде и раствор осторожно нагрели. Выделившийся газ
прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Запишите уравнения описанных реакций.
Слайд 6
Задание 37 № 1632.
Хлор прореагировал с горячим раствором гидроксида калия.
При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы
внесли в раствор соляной кислоты. Образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Запишите уравнения описанных реакций.
Слайд 8
Задание 37 № 1635.
Кристаллы хлорида калия обработали концентрированной серной кислотой.
К получившейся соли добавили гидроксид калия. К полученному продукту
прилили раствор хлорида бария. Выпавший осадок отфильтровали, после чего прокалили с избытком угля. Запишите уравнения описанных реакций.
Слайд 10
Задание 37 № 1640.
Две соли окрашивают пламя в фиолетовый цвет.
Одна из них бесцветна, и при лёгком нагревании её
с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты жёлтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щёлочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
Слайд 11
Пояснение.
В фиолетовый цвет окрашивают пламя соли калия. Медь
с выделением бурого газа растворяется в концентрированной азотной кислоте
(уравнение 2), следовательно, одна из солей — KNО3, взаимодействие её с концентрированной серной кислотой используется для получения концентрированной HNО3 — жидкости с температурой кипения 82,6 °С (уравнение 1). Вторая соль — К2СrО4; для хроматов характерно изменение окраски на оранжевую в растворах кислот (уравнение 3) и приобретение прежней окраски при нейтрализации (уравнение 4).
Слайд 12
Задание 37 № 1641.
Вещество, выделяющееся на катоде при электролизе расплава
хлорида натрия, сожгли в кислороде. Полученный продукт поместили в
газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
Слайд 13
Пояснение.
При электролизе расплава соли на катоде выделяется металл
(уравнение 1). При горении натрия преимущественно образуется пероксид натрия
(уравнение 2), который реагирует с углекислым газом с выделением кислорода (уравнение 3). При нагревании раствора, содержащего NH4Cl (соль, образованная слабым основанием и сильной кислотой) и Na2CО3 (соль, образованная сильным основанием и слабой кислотой), будет происходить гидролиз (уравнение 4).
Слайд 14
Задание 37 № 1642.
Продукт взаимодействия азота и лития обработали водой.
Выделившийся в результате реакции газ смешали с избытком кислорода
и при нагревании пропустили над платиновым катализатором; образовавшаяся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
Слайд 15
Пояснение.
При взаимодействии азота и лития образуется нитрид лития
(уравнение 1), который легко разлагается водой с выделением аммиака
(уравнение 2). Аммиак окисляется кислородом в присутствии платинового катализатора до оксида азота (II), не имеющего цвета (уравнение 3). Образование бурого газа NO2 из NO происходит легко и самопроизвольно (уравнение 4).
Слайд 16
Задание 37 № 1624.
Раствор иодида калия обработали избытком хлорной воды,
при этом наблюдали сначала образование осадка, а затем -
его полное растворение. Образовавшуюся при этом иодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.Слайд 18 Расставьте коэффициенты методом электронного баланса в следующих схемах
реакций:
1) KNO3→KNO2+O2↑
2) KClO3→KClO4+KCl
3) H2O2+KI→I2+KOH
4) NO2+KOH→KNO2+KNO3+H2O
5) Na + HNO3 →
NaNO3 + N2O + H2O6) K2FeO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + H2O + O2
7) H2O2 + KMnO4 + HNO3 → Mn(NO3)2 + KNO3 + H2O + O2
8) Ti2(SO4)3 + KClO3 + H2O → TiOSO4 + KCl + H2SO4





























