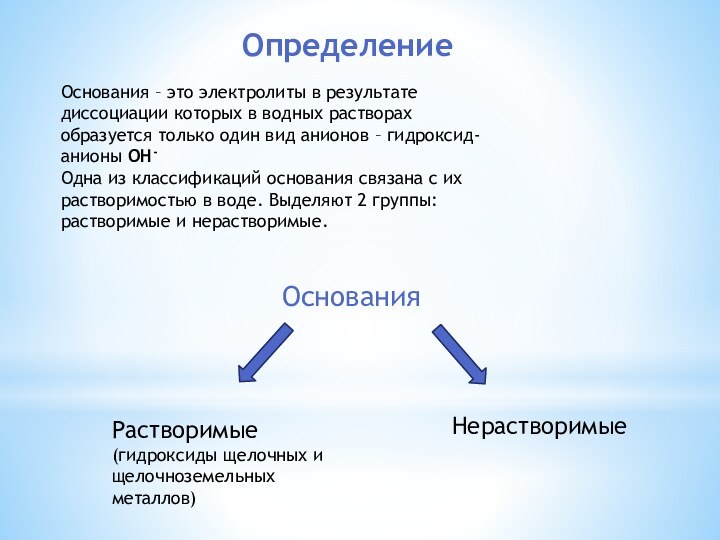
в водных растворах образуется только один вид анионов –
гидроксид-анионы OH-Одна из классификаций основания связана с их растворимостью в воде. Выделяют 2 группы: растворимые и нерастворимые.
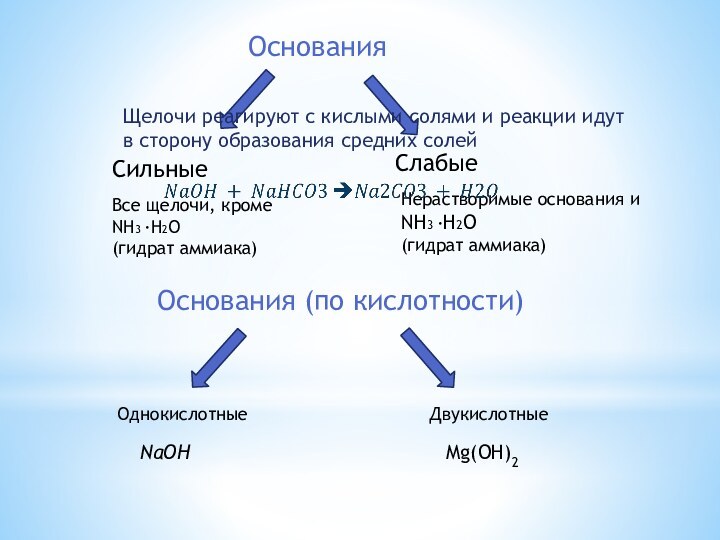
Основания
Растворимые
(гидроксиды щелочных и щелочноземельных металлов)
Нерастворимые