- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основы органической химии
Содержание
- 2. Взаимное влияние атомовВзаимное влияние атомов в молекуле,
- 3. Заместители - любой атом (кроме водорода), который
- 4. Электронные эффектыСмещение электронной плотности в молекуле, ионе, радикале под влияние заместителей, подразделяются на:- электронодонорные;- электроноакцепторные.
- 5. Электронодонорные заместителиатомная группировка (или атом), повышающая электронную плотность на остальной части молекулы
- 6. Электроноакцепторные заместителиатомная группировка (или атом), понижающая электронную плотность на связанном с ним углеводородном фрагменте
- 7. Электроноакцепторные заместителиДва вида влияний заместителей:индуктивный эффект (±I);мезомерный
- 8. Индуктивный эффектПередача по цепи сигма-связей электронного влияния заместителей, которое обусловлено различиями в электроотрицательности атомов
- 9. Индуктивный эффектНаправление смещения электронной плотности σ-связей обозначается стрелками и символами частичных зарядов (δ+ или δ-)
- 10. Индуктивный эффектИз-за слабой поляризуемости σ-связей I-эффект быстро
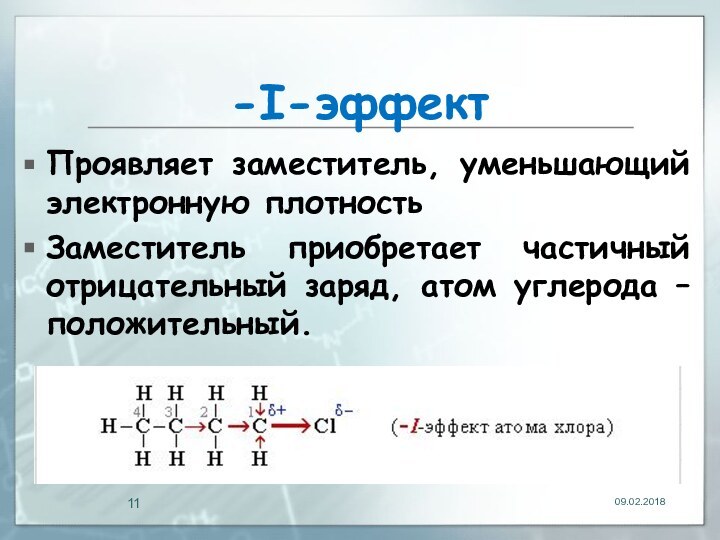
- 11. -I-эффектПроявляет заместитель, уменьшающий электронную плотностьЗаместитель приобретает частичный отрицательный заряд, атом углерода – положительный.
- 12. Определение -I-эффекта
- 13. +I-эффектПроявляет заместитель, увеличива-ющий электронную плотностьЗаместитель приобретает частичный положительный заряд, атом углерода – отрицательный.
- 14. Определение +I-эффекта
- 15. Мезомерный эффектПередача электронного влияния заместителей по сопряжённой π-системе.Благодаря подвижности π-электронов передаётся по цепи без затухания
- 16. Мезомерный эффектГрафически изображают изогнутыми стрелками.В зависимости от
- 17. Правила определения величины и знака М-эффекта
- 18. Правило 1.Величина М-эффекта растет с увеличением заряда заместителя. Ионы проявляют наиболее сильный М-эффект:
- 19. Правило 2-М-эффект заместителей тем сильнее, чем больше электроотрицательность имеющихся в заместителе элементов:
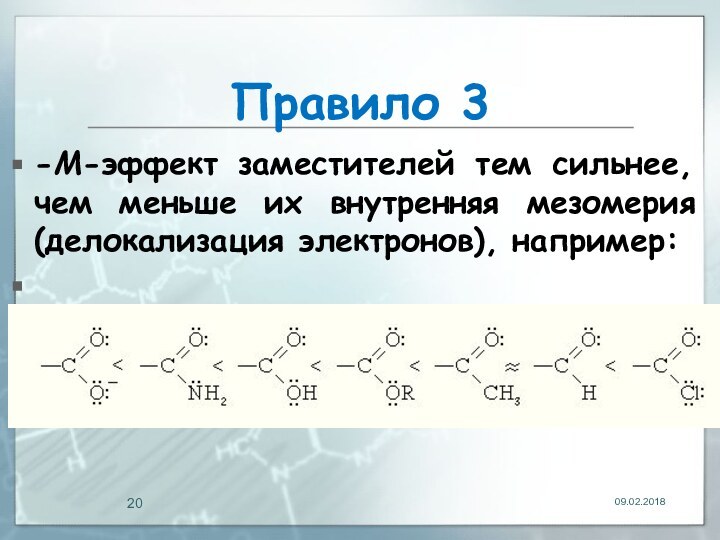
- 20. Правило 3-М-эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия (делокализация электронов), например:
- 21. Правило 3Группа С=О в этом случае связана
- 22. Правило 3В хлорацильной группе -С(О)Cl атом хлора
- 23. Правило 4+М-эффект заместителя тем сильнее, чем меньше электроотрицательность гетероатома, входящего в его состав:
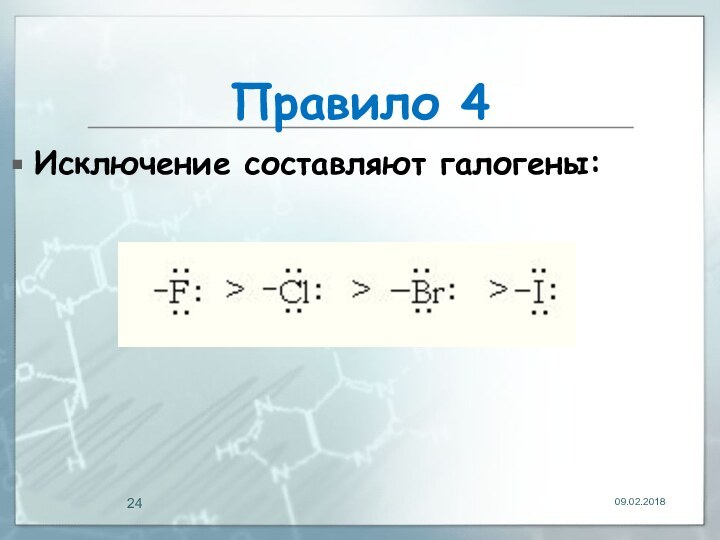
- 24. Правило 4Исключение составляют галогены:
- 25. Правило 4Причина этого явления заключается в том,
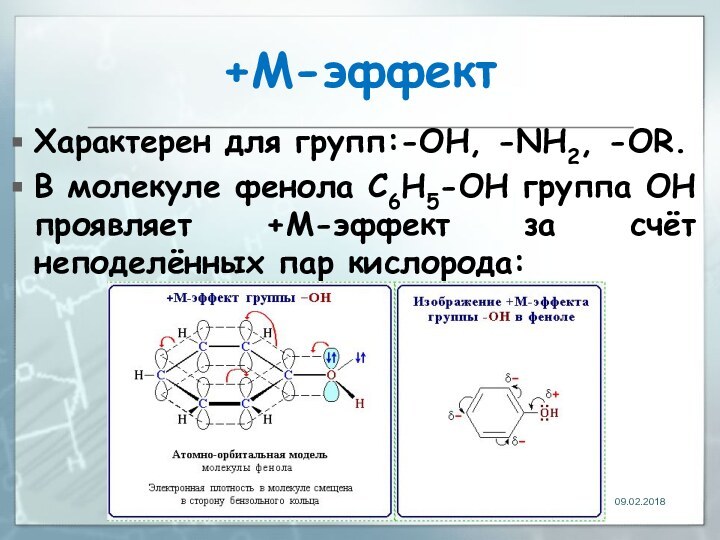
- 26. +М-эффектХарактерен для групп:-OH, -NH2, -OR.В молекуле фенола
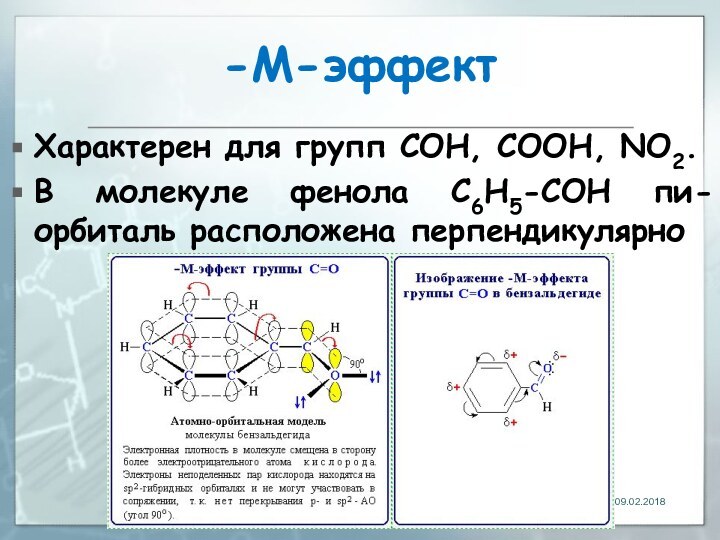
- 27. -М-эффектХарактерен для групп СOH, СООН, NО2.В молекуле фенола C6H5-СOH пи-орбиталь расположена перпендикулярно
- 28. Суммарный электронный эффектВ случае противоположной направленности индуктивного
- 29. Суммарный электронный эффектв молекуле анилина аминогруппа NH2
- 30. Суммарный электронный эффектаминогруппа является электроно-донорным заместителем, т.к. преобладает более сильный +М-эффект. отрицательный I-эффект относительно слаб:
- 31. Суммарный электронный эффектАналогичная ситуация (+М > -I)
- 32. Суммарный электронный эффектВ случае галогенов, напротив, преобладает
- 33. Суммарный электронный эффект
- 34. Пространственные эффекты(стерические) эффекты определяют доступность реакционных центров
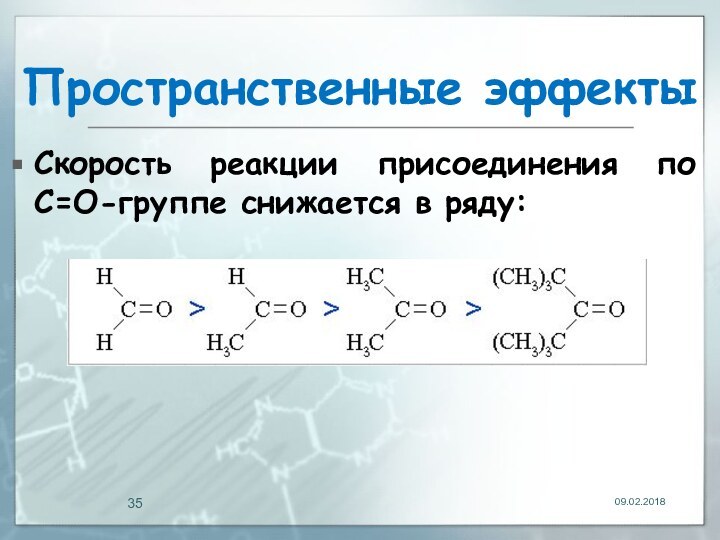
- 35. Пространственные эффектыСкорость реакции присоединения по С=О-группе снижается в ряду:
- 36. Эффект сверхсопряженияГруппа метил CH3 (в меньшей степени,
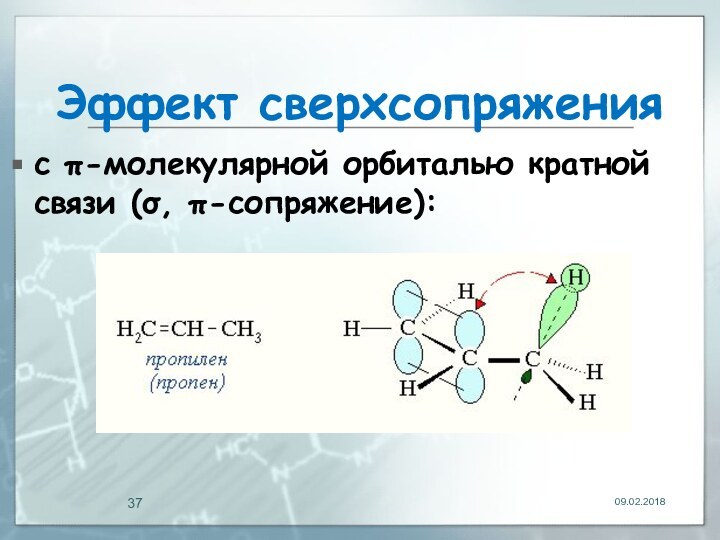
- 37. Эффект сверхсопряженияс π-молекулярной орбиталью кратной связи (σ, π-сопряжение):
- 38. Эффект сверхсопряженияс р-атомной орбиталью (σ, р-сопряжение):
- 39. Эффект сверхсопряженияГрафически эффект сверхсопряжения обозначается изогнутой стрелкой,
- 40. Эффект сверхсопряженияНаправление стрелки показывает смещение σ-электронов связи
- 41. Эффект сверхсопряжениясверхсопряжение является слабым эффектом, но его
- 42. Эффект сверхсопряженияИменно этим фактором, в частности, объясняется увеличение устойчивости свободных радикалов в ряду:
- 43. Эффект сверхсопряженияВ той же последовательности возрастает устойчивость
- 44. Эффект сверхсопряженияНаибольшая стабильность трет-бутил-катиона +C(CH3)3 объясняется не
- 45. 1.Контрольная работа
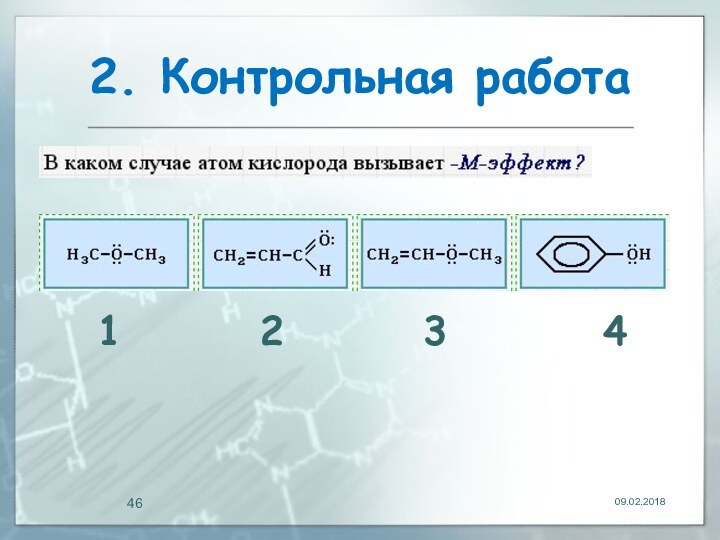
- 46. 2. Контрольная работа1 2 3 4
- 47. 3.Контрольная работа
- 48. 4. Контрольная работа
- 49. 5. Контрольная работаК какому типу органических соединений
- 50. 6. Контрольная работаФункциональной группой фенолов является .
- 51. Скачать презентацию
- 52. Похожие презентации
Взаимное влияние атомовВзаимное влияние атомов в молекуле, ионе, радикале осуществляется под влиянием электронных и пространственных эффектов.Это позволяет определить реакционную способность органических соединений.











































Слайд 2
Взаимное влияние атомов
Взаимное влияние атомов в молекуле, ионе,
радикале осуществляется под влиянием электронных и пространственных эффектов.
определить реакционную способность органических соединений.
Слайд 3
Заместители -
любой атом (кроме водорода), который непосредственно
не участвует в реакции, но оказывает влияние на реагирующую
часть молекулы: на положение и активность реагирующего центра.
Слайд 4
Электронные эффекты
Смещение электронной плотности в молекуле, ионе, радикале
под влияние заместителей, подразделяются на:
- электронодонорные;
- электроноакцепторные.
Слайд 5
Электронодонорные заместители
атомная группировка (или атом), повышающая электронную плотность
на остальной части молекулы
Слайд 6
Электроноакцепторные заместители
атомная группировка (или атом), понижающая электронную плотность
на связанном с ним углеводородном фрагменте
Слайд 7
Электроноакцепторные заместители
Два вида влияний заместителей:
индуктивный эффект (±I);
мезомерный эффект
(±M).
В зависимости от смещения плотности различают положительные и отрицательные
эффекты.
Слайд 8
Индуктивный эффект
Передача по цепи сигма-связей электронного влияния заместителей,
которое обусловлено различиями в электроотрицательности атомов
Слайд 9
Индуктивный эффект
Направление смещения электронной плотности σ-связей обозначается стрелками
и символами частичных зарядов (δ+ или δ-)
Слайд 10
Индуктивный эффект
Из-за слабой поляризуемости σ-связей I-эффект быстро ослабевает
с удалением заместителя и через 3-4 связи практически равен
нулю.В зависимости от смещения наблюдают положительные +I-эффекты и отрицательные -I-эффекты.
I-эффект водорода равен нулю.
Слайд 11
-I-эффект
Проявляет заместитель, уменьшающий электронную плотность
Заместитель приобретает частичный отрицательный
заряд, атом углерода – положительный.
Слайд 13
+I-эффект
Проявляет заместитель, увеличива-ющий электронную плотность
Заместитель приобретает частичный положительный
заряд, атом углерода – отрицательный.
Слайд 15
Мезомерный эффект
Передача электронного влияния заместителей по сопряжённой π-системе.
Благодаря
подвижности π-электронов передаётся по цепи без затухания
Слайд 16
Мезомерный эффект
Графически изображают изогнутыми стрелками.
В зависимости от направления
смещения электронной плотности различают отрицательный (-М) и положительный (+М)
мезомерный эффект.Величина эффекта определяется рядом правил.
Слайд 18
Правило 1.
Величина М-эффекта растет с увеличением заряда заместителя.
Ионы проявляют наиболее сильный М-эффект:
Слайд 19
Правило 2
-М-эффект заместителей тем сильнее, чем больше электроотрицательность
имеющихся в заместителе элементов:
Слайд 20
Правило 3
-М-эффект заместителей тем сильнее, чем меньше их
внутренняя мезомерия (делокализация электронов), например:
Слайд 21
Правило 3
Группа С=О в этом случае связана с
группировками, +М-эффект которых в ряду O-, NH2, OH, OR
уменьшается и, наконец, для CH3 и Н – равен нулю.
Слайд 22
Правило 3
В хлорацильной группе -С(О)Cl атом хлора проявляет
+М-эффект, однако он значительно слабее -I-эффекта
мезомерное взаимодействие невелико
вследствие относительно малой степени перекрывания существенно различаю-щихся орбиталей – 2р-АО sp2-гибридизованного атома углерода и 3р-АО хлора
Слайд 23
Правило 4
+М-эффект заместителя тем сильнее, чем меньше электроотрицательность
гетероатома, входящего в его состав:
Слайд 25
Правило 4
Причина этого явления заключается в том, что
эффективность перекрывания 2р-АО sp2-гибридизованного атома углерода с р-орбиталями галогенов
уменьшается с увеличением их различий в энергетических уровнях:
Слайд 26
+М-эффект
Характерен для групп:-OH, -NH2, -OR.
В молекуле фенола C6H5-OH
группа ОН проявляет +М-эффект за счёт неподелённых пар кислорода:
Слайд 27
-М-эффект
Характерен для групп СOH, СООН, NО2.
В молекуле фенола
C6H5-СOH пи-орбиталь расположена перпендикулярно
Слайд 28
Суммарный электронный эффект
В случае противоположной направленности индуктивного и
мезомерного эффектов общее действие заместителя определяется более сильным эффектом.
Слайд 29
Суммарный электронный эффект
в молекуле анилина аминогруппа NH2 одновременно
проявляет -I-эффект (за счет большей электроотрицательности атома азота по
сравнению с углеродом) и +М-эффект (за счет участия неподеленной пары электронов в системе p-сопряжения):
Слайд 30
Суммарный электронный эффект
аминогруппа является электроно-донорным заместителем, т.к. преобладает
более сильный +М-эффект.
отрицательный I-эффект относительно слаб:
Слайд 31
Суммарный электронный эффект
Аналогичная ситуация (+М > -I) характерна
для групп:
-NHR, -NR2, -OH, -OR, связанных с sp2-
или sp-атомом сопряженной системы.
Слайд 32
Суммарный электронный эффект
В случае галогенов, напротив, преобладает -I-эффект,
поскольку, кроме максимально электроотрицательного фтора (очень сильный -I-эффект), р-АО
других атомов этой группы не способны к эффективному взаимодействию с р-АО углерода.
Слайд 34
Пространственные эффекты
(стерические) эффекты определяют доступность реакционных центров в
молекуле.
Объёмные группы могут блокировать центры в молекуле и снижать
её реакционную способность.
Слайд 36
Эффект сверхсопряжения
Группа метил CH3 (в меньшей степени, CH2R
и СHR2), связанная с sp2 или sp-атомом, проявляет слабый
эффект электронной делокализации, называемый эффектом сверхсопряжения (или гиперконъюгации).Этот эффект обусловлен перекрыванием s-молекулярной орбитали связи С-Н .





























