- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ПОНЯТИЕ КОРРОЗИИ
Содержание
- 3. Потери от коррозииПрямые - безвозвратные потери металла,
- 4. Примеры косвенных потерьПростои Потеря готовой продукцииПотери мощности.
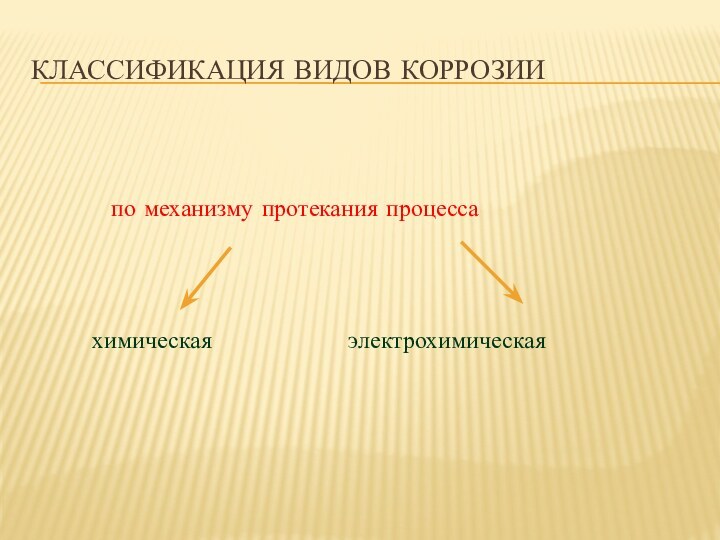
- 5. Классификация видов коррозииПо типу агрессивных сред, в
- 6. Классификация видов коррозииПо условиям протекания коррозионного процесса
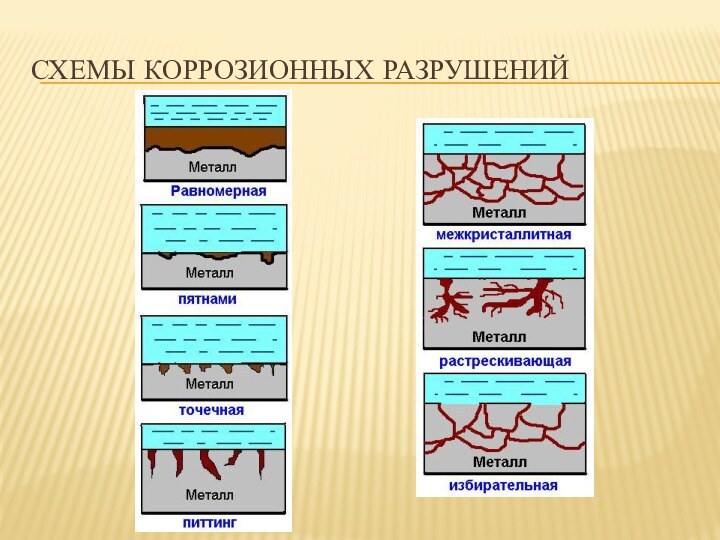
- 7. Классификация видов коррозииПо характеру разрушения:сплошная коррозия, охватывающая
- 8. СХЕМЫ КОРРОЗИОННЫХ РАЗРУШЕНИЙ
- 9. Классификация видов коррозии
- 10. ХИМИЧЕСКАЯ КОРРОЗИЯХимическая коррозия — взаимодействие поверхности металла
- 11. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯЭлектрохимическая коррозия - взаимодействие металла с
- 12. Условия, способствующие электрохимической коррозии Положение металла в
- 13. Схема электрохимического коррозионного процесса
- 14. Механизм электрохимической коррозии (образование ржавчины)
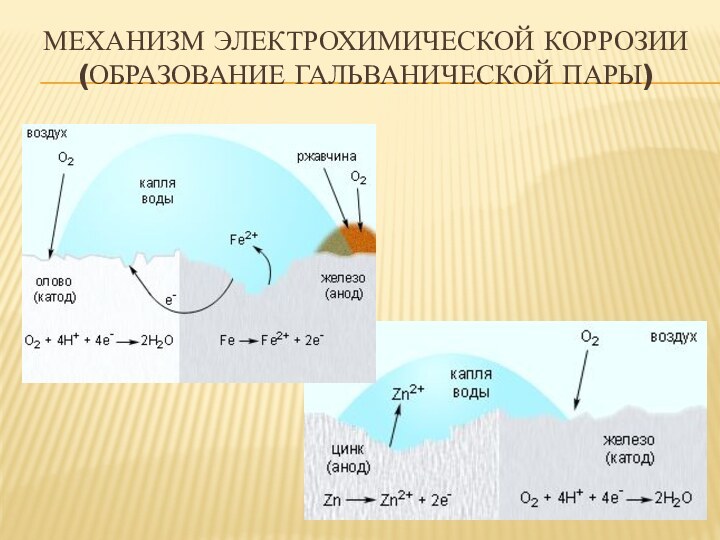
- 15. Механизм электрохимической коррозии (образование гальванической пары)
- 16. СКОРОСТЬ КОРРОЗИИистинная скорость коррозии металлического материала определяется
- 17. Глубинный показатель коррозии:
- 18. Показатель изменения массы
- 19. Механический показатель коррозии
- 20. Скачать презентацию
- 21. Похожие презентации
Потери от коррозииПрямые - безвозвратные потери металла, стоимость замены оборудования, металлоконструкций, расходы на противокоррозионную защиту.Косвенные - простой оборудования, снижение мощности, снижение качества продукции, расход металла на утолщение стенок и т.п.

















Слайд 3
Потери от коррозии
Прямые - безвозвратные потери металла, стоимость
замены оборудования, металлоконструкций, расходы на противокоррозионную защиту.
оборудования, снижение мощности, снижение качества продукции, расход металла на утолщение стенок и т.п.
Слайд 4
Примеры косвенных потерь
Простои
Потеря готовой продукции
Потери мощности. Из-за
отложения продуктов коррозии ухудшается теплопроводность поверхностей теплообмена. Уменьшение проходных
сечений трубопроводов из-за отложений ржавчины требует повышения мощности насосов.Загрязнение продукции. Небольшое количество меди, поступившее в систему в результате коррозии медного трубопровода, может испортить целую партию мыла.
Допуски на коррозию. Этот фактор является обычным при проектировании реакторов, паровых котлов, конденсаторов, насосов, подземных трубопроводов.
Слайд 5
Классификация видов коррозии
По типу агрессивных сред, в которых
протекает процесс разрушения, коррозия может быть следующих видов:
газовая коррозия;
атмосферная
коррозия;коррозия в неэлектролитах;
коррозия в электролитах;
подземная коррозия;
биокоррозия;
коррозия под воздействием блуждающих токов.
Слайд 6
Классификация видов коррозии
По условиям протекания коррозионного процесса различаются
следующие виды:
контактная коррозия;
щелевая коррозия;
коррозия при неполном погружении;
коррозия при полном
погружении;коррозия при переменном погружении;
коррозия при трении;
межкристаллитная коррозия;
коррозия под напряжением.
Слайд 7
Классификация видов коррозии
По характеру разрушения:
сплошная коррозия, охватывающая всю
поверхность:
равномерная;
неравномерная;
избирательная (селективная);
локальная (местная) коррозия, охватывающая отдельные участки:
пятнами;
язвенная;
точечная
(или питтинг);сквозная;
межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
Слайд 10
ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия — взаимодействие поверхности металла с
(коррозионно-активной) средой, не сопровождающееся возникновением электрохимических процессов на границе
фаз.В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте.
К этому виду коррозии относятся такие процессы окисления металла и восстановления коррозионного агента, при которых передача электронов металла осуществляется непосредственно атомам или ионам окислителя (коррозионного агента), которым наиболее часто является кислород воздуха.
2Ме + О2 → 2МеО
Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
4Fe + 3O2 → 2Fe2O3
Слайд 11
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимическая коррозия - взаимодействие металла с коррозионной
средой (раствором электролита), при котором ионизация атомов металла и
восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциалаПроцесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций:
анодной (окисление) Ме → Ме z+ + ze-,
и катодной (восстановление) D + ze- → (Dze- ),
где D – деполяризатор (окислитель), присоединяющий к себе электроны металла (кислород, растворенный в электролите, ионы водорода (Н+) и некоторых металлов).
Пример: ржавление железа
2Fe + 2H2O + O2 → 2Fe2+ + 4 OH-
Слайд 12
Условия, способствующие электрохимической коррозии
Положение металла в ряду
активности металлов: чем они дальше расположены друг от друга,
тем быстрее происходит коррозия.Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Слайд 16
СКОРОСТЬ КОРРОЗИИ
истинная скорость коррозии металлического материала определяется из
выражения:
V = dy/dt,
y - изменяющаяся в процессе коррозии характеристика
свойства материала;
t - время коррозии.
Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением средней скорости коррозионного разрушения материала:
Vср=Dy/Dt.
Слайд 17
Глубинный показатель коррозии:
Kn=DП/Dt
DП - глубина (средняя или максимальная ) коррозионного
разрушения
t - время коррозии
Показатель изменения толщины образующейся на металле пленки продуктов коррозии:
Kn=Dh/Dt,
Dh - изменение толщины образующейся на металле
пленки продуктов коррозии
Dt - время коррозии
Слайд 18
Показатель изменения массы
Km=Dm/S•Dt
Dm
- изменение массы корродирующего металлаS - поверхность коррозии
Dt - время коррозии
Объемный показатель коррозии
Kv=DV/S•Dt
DV - объем газа, выделившегося или поглощенного в
процессе коррозии и приведенный к нормальным
условиям
Dt - время коррозии
S - поверхность коррозии.
Слайд 19
Механический показатель коррозии
Ks=(Ds/Dt)*100%
Ds - относительное изменение характеристикимеханического свойства
Dt - время коррозии
Показатель изменения электрического сопротивления
KR=(DR/Dt)*100%
DR - относительное изменение
электросопротивления образца
Dt - время коррозии