- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Щелочны́емета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы i группы): литий li, натрий na, калий k, рубидий rb, цезий cs, францийfr.
Содержание
- 2. Щелочны́е мета́ллы — это элементы 1-й группы периодической
- 3. Общая характеристика щелочных металлов В Периодической системе они следуют
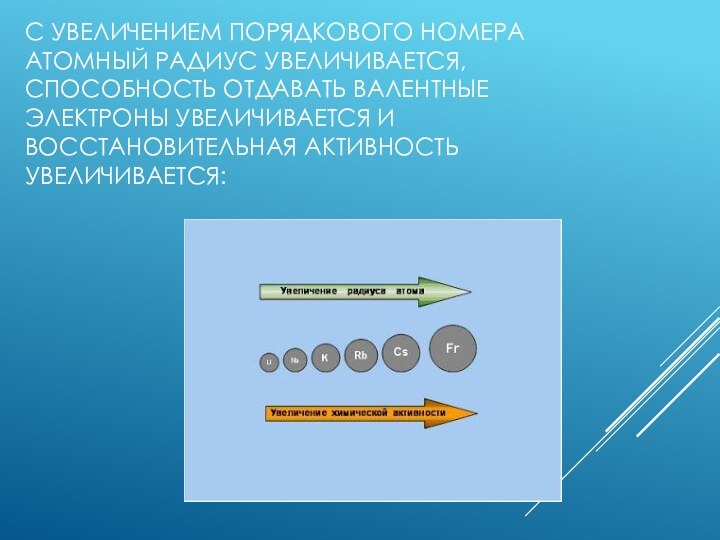
- 4. С увеличением порядкового номера атомный радиус увеличивается, способность отдавать валентные электроны увеличивается и восстановительная активность увеличивается:
- 5. Физические свойства Низкие температуры плавления, малые значения плотностей, мягкие, режутся ножом.
- 6. Химические свойства Типичные металлы, очень сильные восстановители.
- 7. 4. В реакциях с другими неметаллами образуются бинарные
- 8. Качественная реакция на катионы щелочных металлов -
- 9. Скачать презентацию
- 10. Похожие презентации
Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.








Слайд 3
Общая характеристика щелочных металлов
В Периодической системе они следуют сразу за инертными
газами, поэтому особенность строения атомов щелочных металлов заключается в том, что
они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — самый низкий) и электроотрицательности (ЭО). Как следствие, в большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.Слайд 4 С увеличением порядкового номера атомный радиус увеличивается, способность
отдавать валентные электроны увеличивается и восстановительная активность увеличивается:
Слайд 5 Физические свойства Низкие температуры плавления, малые значения плотностей, мягкие,
режутся ножом.
Слайд 6 Химические свойства Типичные металлы, очень сильные восстановители. В соединениях
проявляют единственную степень окисления +1. Восстановительная способность увеличивается с
ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла. Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды.Слайд 7 4. В реакциях с другими неметаллами образуются бинарные соединения: 2Li
+ Cl2 → 2LiCl (галогениды) 2Na + S → Na2S (сульфиды) 2Na
+ H2 → 2NaH (гидриды) 6Li + N2 → 2Li3N (нитриды) 2Li + 2C → Li2C2 (карбиды)1. Активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2 ОПЫТ
2Li + 2H2O → 2LiOH + H2
2. Реакция с кислотами:
2Na + 2HCl → 2NaCl + H2
3. Реакция с кислородом:
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (надпероксид калия)