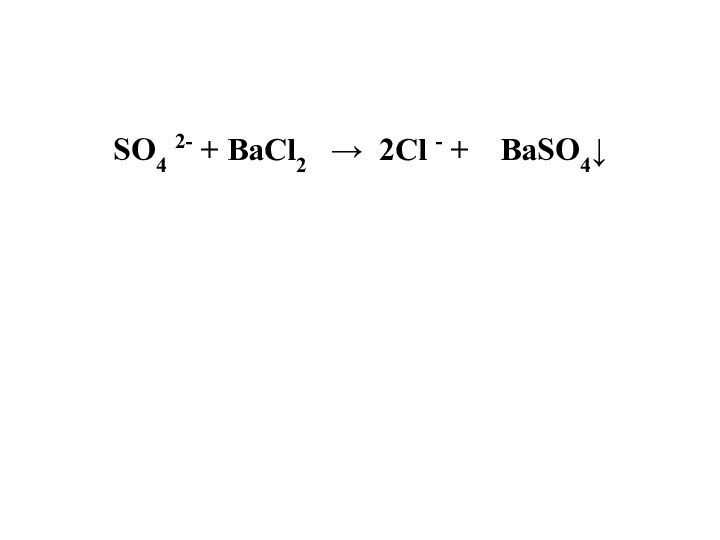Слайд 2
В природе
борная кислота (сассолин) – Н3ВО3
бура
– Na2B4O7 · 10 H2O
кернит - Na2B4O7· 4 H2O
борокальцит – CaB4O7· 4 H2O
ашарит – B2O3 · 2 MgO · H2O
Кислота борная Acidum boricum (ЛH)
H3BO3 Boric acid (MHH)
Получение
Na2B4O7 • 10 H2O+2НС1 → 4Н3В03 + 2NaCl + 5Н2O
CaB4O7 • 4Н2O + 2НС1 + H2O → 4Н3В03 + 2СаС12
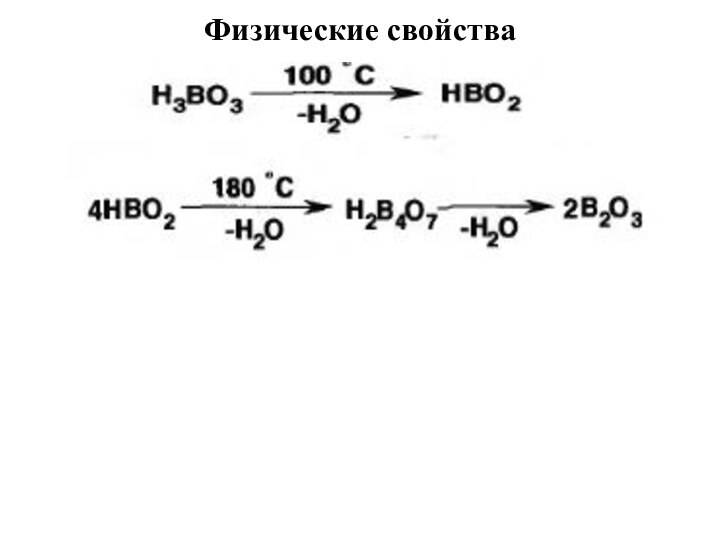
Слайд 4
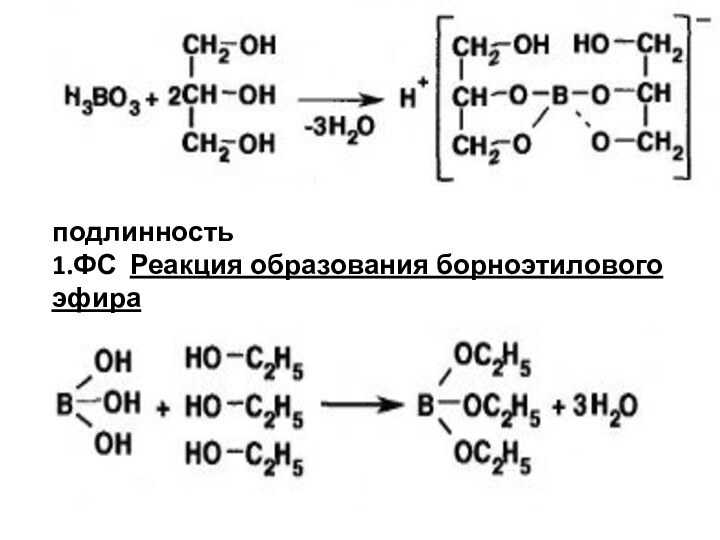
подлинность
1.ФС Реакция образования борноэтилового эфира
.
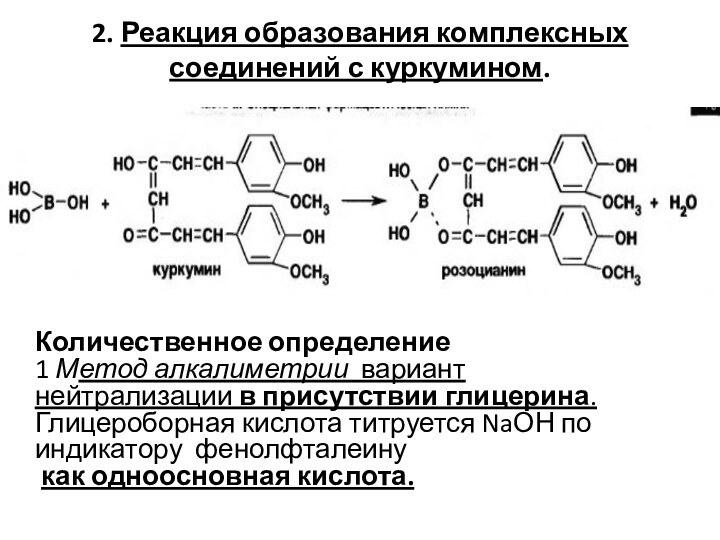
Слайд 5
2. Реакция образования комплексных соединений с куркумином.
Количественное определение
1
Метод алкалиметрии вариант нейтрализации в присутствии глицерина. Глицероборная кислота
титруется NaОН по индикатору фенолфталеину
как одноосновная кислота.
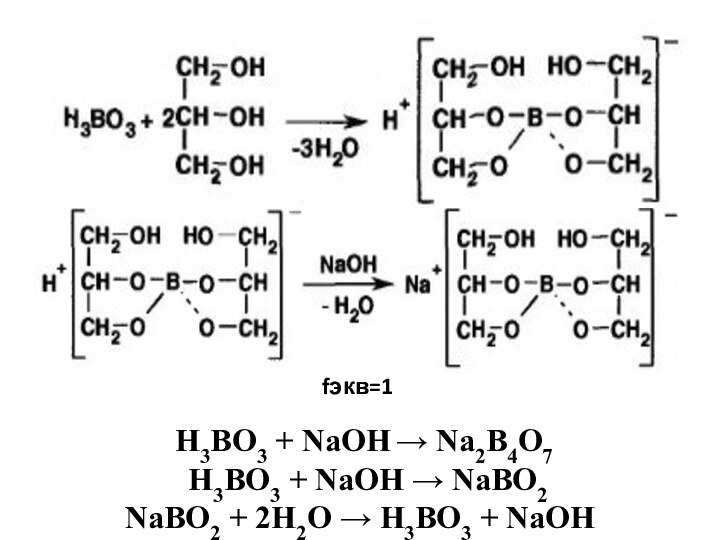
Слайд 6
fэкв=1
Н3ВО3 + NaОН → Na2B4O7
Н3ВО3 +
NaОН → NaBO2
NaBO2 + 2H2O → Н3ВО3 +
NaОН
Слайд 7
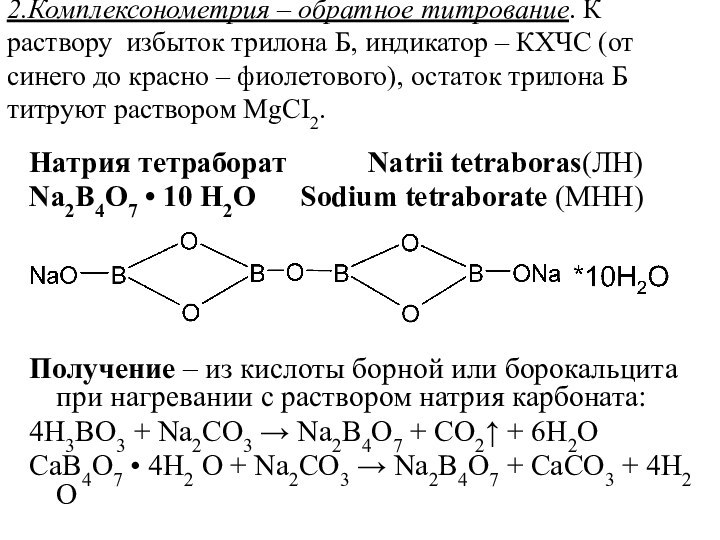
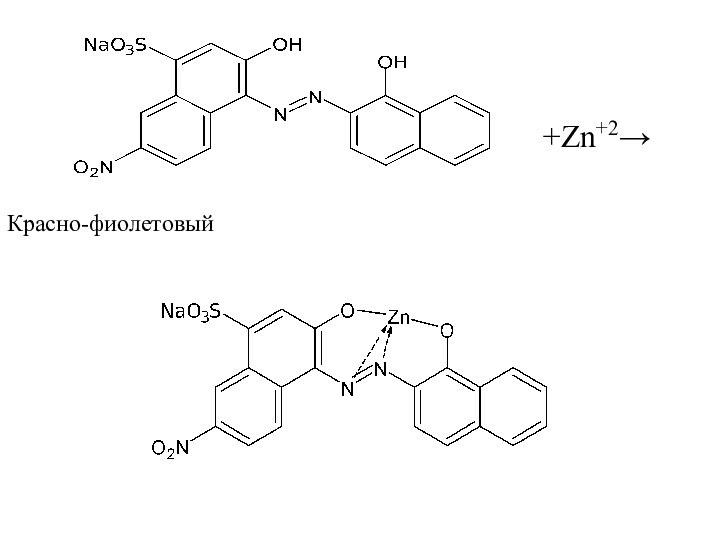
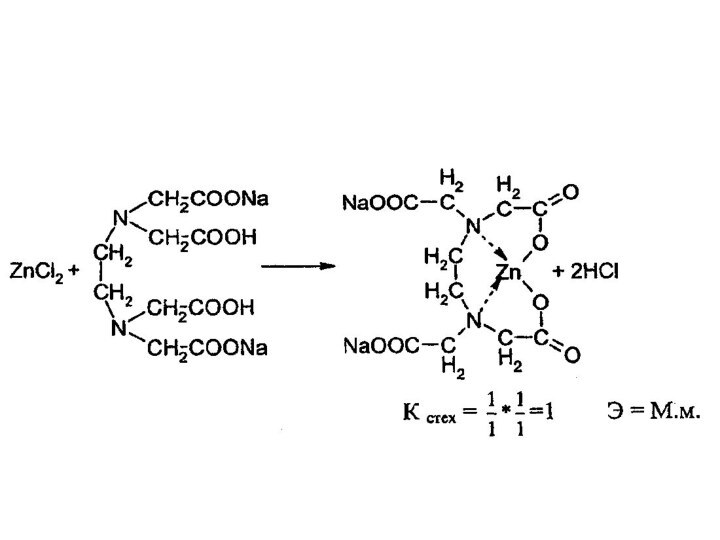
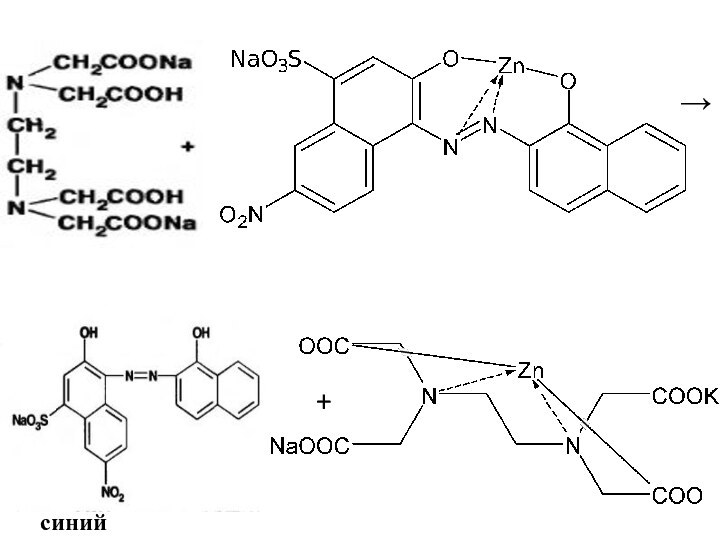
2.Комплексонометрия – обратное титрование. К раствору избыток трилона
Б, индикатор – КХЧС (от синего до красно –
фиолетового), остаток трилона Б титруют раствором MgCI2.
Натрия тетраборат Natrii tetraboras(ЛH)
Na2B4O7 • 10 H2O Sodium tetraborate (MHH)
Получение – из кислоты борной или борокальцита при нагревании с раствором натрия карбоната:
4Н3ВО3 + Na2CO3 → Na2B4O7 + CO2↑ + 6Н2O
CaB4O7 • 4Н2 O + Na2CO3 → Na2B4O7 + CaCO3 + 4Н2 O
Слайд 8
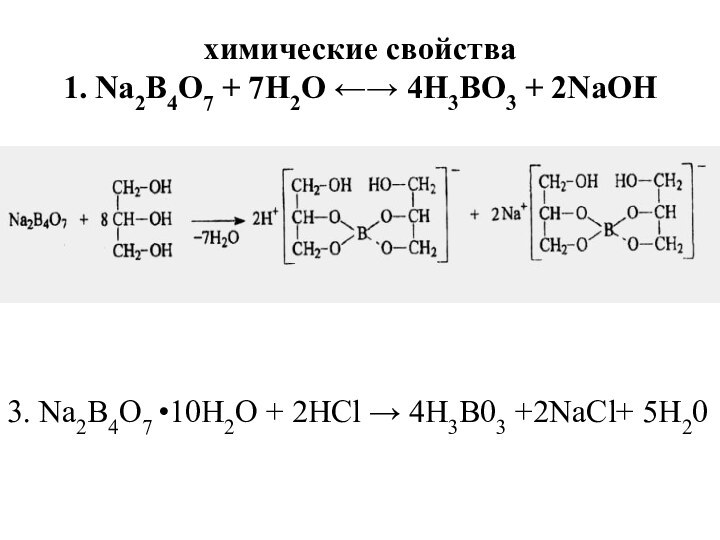
химические свойства
1. Na2B4O7 + 7Н2O ←→ 4Н3BO3 +
2NaOH
3. Na2B4O7 •10H2O + 2НСl → 4Н3В03 +2NaCl+ 5Н20
Слайд 9
Количественное определение
ацидиметрическим методом вариант вытеснения слабой кислоты. Титрант
НСl. индикатор - метиловый оранжевый. От желтого до розового
Na2B4O7 • 10H2O + 2НСl → 4Н3В03 +2NaCl +5Н20
fэкв=1/2
Д.б. не менее 99,5% и не более 103%.
Слайд 10
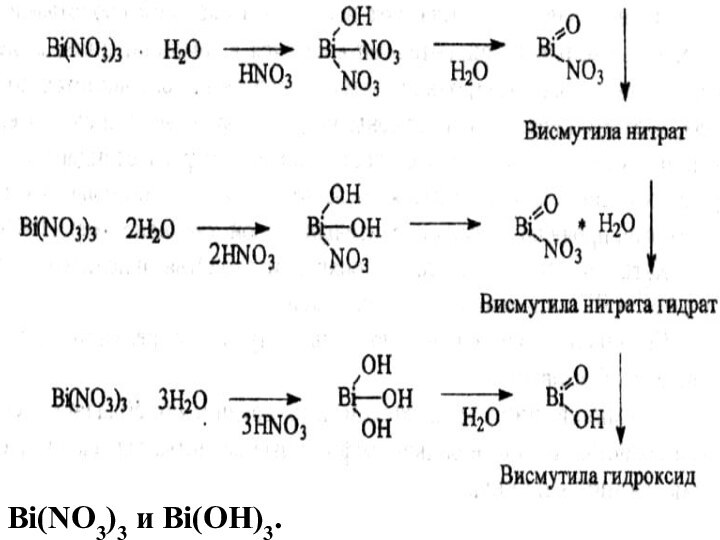
Соединения висмута в природе висмутовая охра Bi2O3 висмутовый
блеск - Bi2S3
Получение
Bi2O3 + 3С → 2 Bi +
СО3
Bi + 4 НNО3 → Bi(NO3)3 + NO↑ +5H2O
При упаривании этого раствора выделяются кристаллы средней соли Bi(NO3)3• 5H2O.
висмута нитрат основной – смесь основных солей, разной степени гидролиза средней соли нитрата висмута
Слайд 12
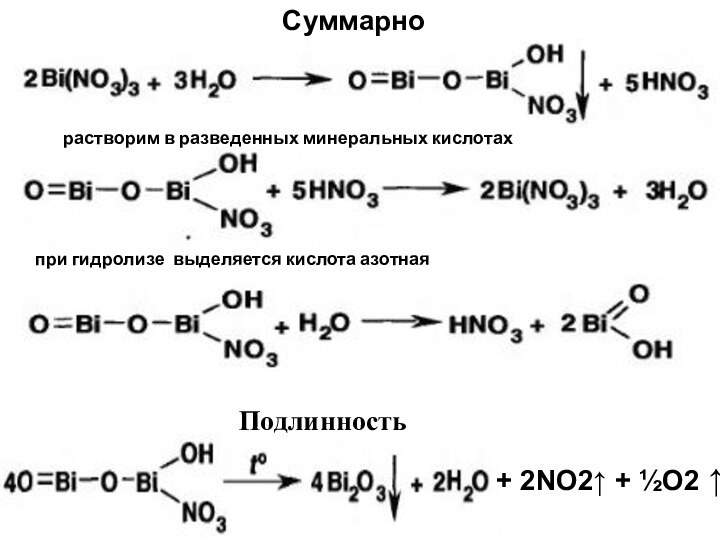
Суммарно
+ 2NO2↑ + ½О2 ↑
Подлинность
растворим в разведенных
минеральных кислотах
при гидролизе выделяется кислота азотная
Слайд 13
Для проведения реакций подлинности на ионы Bi3+ и
NO-
ЛB растворяют в разбавленной кислоте хлороводородной или серной
2. Реакция осаждения раствором натрия сульфида
2Bi3+ + 3Na2S → Bi2S3↓ + 6Na
Коричнево-черный осадок
Bi2S3 + 8НNО3 → 2 Bi(NO3)3 + 2NO2↑+4H2O + 2S↓
3. Реакция осаждения и комплексообразования с раствором калия йодида.
Bi3+ + 3KI → BiI3↓ + ЗК+
2 капли черный осадок
BiI3 + KI → K[BiI4]
избыток желто-оранжевое окрашивание
Слайд 14
Чистота
4.Предельное содержание примеси щелочных и щелочно-земельных металлов обнаруживают
по образованию сухого остатка (примеси) после осаждения висмута Н2S
из солянокислого раствора:
Bi(NO3)3 + HCI → Bi3++ Н2S → Bi2S3↓
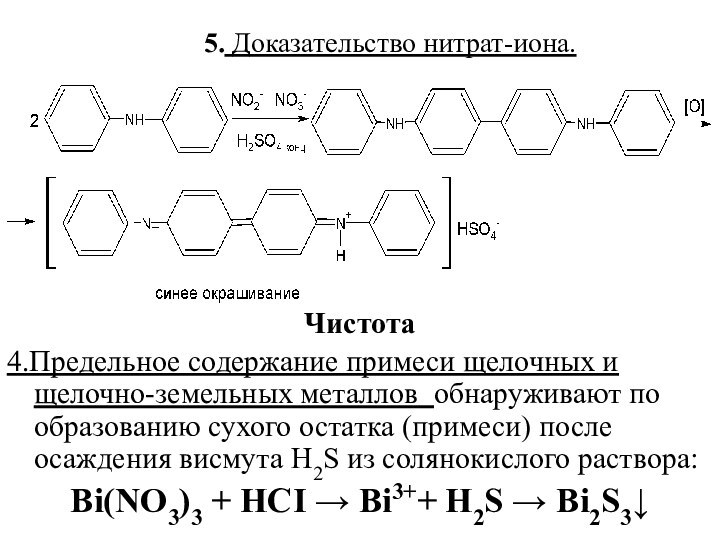
5. Доказательство нитрат-иона.
Слайд 15
5. не допустимые примеси солей меди, свинца,
допустимая
в пределах эталона примесь серебра.
Катион меди (II) с
раствором аммиака (должен оставаться бесцветным):
Cu(NO3)2 + 4NH4OH → [Cu(NH3)4](NO3)2 + 4Н2O
синее окрашивание
Катион свинца (не должна появляться муть):
Pb(NO3)2 + H2SO4 → PbSO4↓ + 2HNO3
Катион серебра (допускается опалесценция, не превышающая опалесценцию эталонного раствора):
AgNO3 + HCl →AgCl↓ + HNO3
Слайд 16
6.не допустимые примеси мышьяка и теллура
7.не допустимые примеси
карбонатов (при растворении в HNO3 не д.б. пузырьков СО2),
солей аммония (+NаOН не д.б. запаха аммиака ) и сульфаты(+BаNO3 не д.б. мути)
Количественное определение
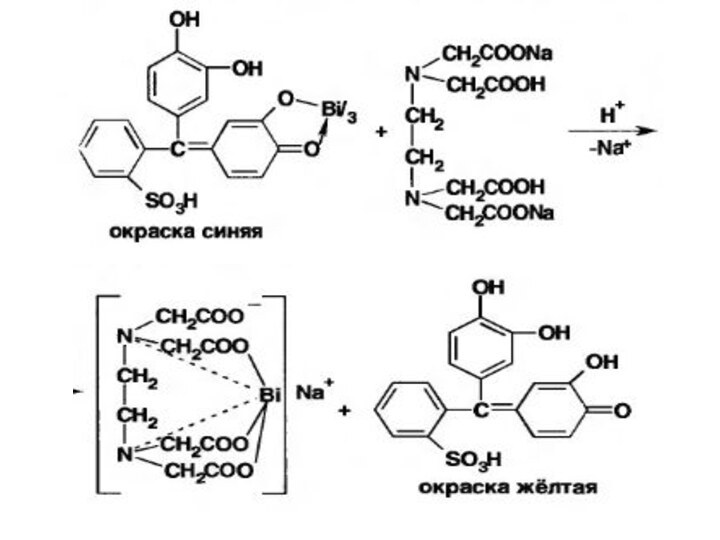
Комплексонометрический метод.
ЛВ растворяют в разв HNO3
Титрант Трилон Б,
в азотнокислой среде рН = 2 – 3.
Индикатор - ксиленоловый оранжевый или пирокатехиновый фиолетовый
(в т.э. краска от синей к желтой).
Слайд 17
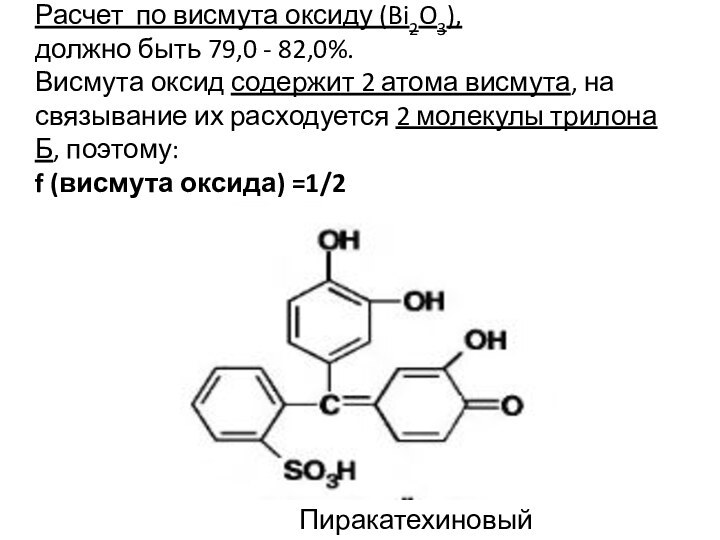
Расчет по висмута оксиду (Bi2O3),
должно быть 79,0
- 82,0%.
Висмута оксид содержит 2 атома висмута, на связывание
их расходуется 2 молекулы трилона Б, поэтому:
f (висмута оксида) =1/2
Пиракатехиновый фиолетовый
Слайд 18
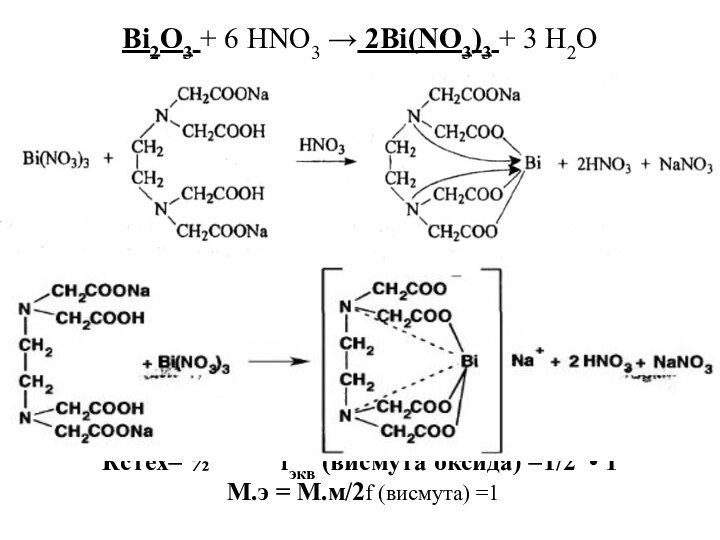
Bi2O3 + 6 HNO3 → 2Bi(NO3)3 + 3
H2O
Кстех= ½ fэкв (висмута
оксида) =1/2 • 1
М.э = М.м/2f (висмута) =1
Слайд 20
Формы выпуска
Субстанция, таблетки по 0,25 и 0,5 г,
мазь 10%. Входит в состав таблеток «Викалин», «Викаир», «Алмагель»
Слайд 21
В природе
цинковая обманка – ZnS, цинковый шпат
– ZnCO3
Цинка оксид
Zinci oxydum
ZnO Zinc oxide (МНН)
Получение1. 5ZnSO4 + 5Na2CO3 + 3H2O → 2ZnCO3·3Zn(OH)2↓ +5Na2SO4 + CO2↑
300 0C
2ZnCO3·3Zn(OH)2 → 5ZnO + 2CO2↑ + 3H2O
2. прокаливанием цинка карбоната (цинкового шпата):
ZnCO3 → ZnO + CO2↑
3. Окислением Zn кислородом:2Zn + O2 → 2ZnO
Соединения цинка
Слайд 22
амфотерные свойства
ZnO + 2 HCI → ZnCI2 +
H2O
ZnO + NaOH → Zn(OH)2↓ +2NaOH→Na2ZnO2
Zn(OH)2 +
4 NH4OH→[Zn(NH3)4](OH)2 + 4H2O
Подлинность
1. Специфическая реакция. При прокаливании JIB окрашивается в желтый цвет, при охлаждении снова становится белым
Реакции на ион цинка
ZnO + H2SO4 → ZnSO4 + H2O
Реакция осаждения раствором калия гексацианоферрата (II)
2ZnSO4+2K4[Fe(CN)6]→K2Zn3[Fe(CN)6]↓+3K2SO4
белый гелеобразный осадок
(желтоватый)
Слайд 23
Реакция осаждения раствором натрия сульфида
ZnSO4 + Na2S
→ ZnS↓ + Na2SO4
белый осадок
При прокаливании с кобальта нитратом образуется плав цинката кобальта ярко-зеленого цвета - «зелень Ринмана»:
ZnO + Co(NO3)2 → CoZnO2 +2 NO2↑ + 0,5 O2 ↑
t°ярко-зеленый плав
Zn2+ + Co(NO3)2 → CoZnO2 + 2NO2↑
Чистота
1.Избыточная щелочность ф/ф не более 0,3 мл 0,1н. HCI
Слайд 24
2.не допустимая примесь – карбонаты
ZnCO3 + 2НСl →
ZnCl2 + CO2↑ + H2O
3. не допустимые примеси Fe3+
, Cu2+ , Al3+
Zn2+ + 4NH4OH → Zn[(NH3)4]2+ + 4Н2O
бесцветный р-р
Fe3+ + 3NH4OH → Fe(OH)3↓ + 3NH4+
красно-коричневый (бурый)
Al3+ + 3NH4OH → Al(OH)3↓ + 3NH4+
белый
Cu2+ + 4NH4OH → [Cu(NH3)4]2+ + 4Н2O
синее окрашивание
Слайд 25
4. не допустимая примесь – Pb.
Pb(CH3COO)2 +
K2CrO → PbCrO4↓ +2CH3COOK
желтый осадок
5. допустимая примесь Аs
Количественное определение
Комплексонометрический метод.
ЛВ предварительно растворяют в кислоте хлороводородной.
ZnO + 2HCl → ZnCl2 + H2O
1. Титрование проводят в среде аммиачного буфера (рН=9-10) индикатор - кислотный хром черный специальный. fэкв =1
2. индикатор ксиленоловый оранжевый при
рН 5-6. среда раствор гексаметилентетрамина.
Слайд 29
Хранение ZnO + CO2
→ ZnCO3
Цинка сульфат
Zinci sulfas
ZnSO4 · 7H2O Zinc sulfate (МНН)
Получение
Zn + H2SO4 → ZnSO4 + H2↑
ZnO + H2SO4 → ZnSO4+ H2О
Кристаллизуется из раствора при 39-41°С гептагидрат гептагидрат цинка сульфата
(ZnSO4 • 7Н20 )
Водные растворы – кислая реакция среды
2ZnSO4 + 2Н2O → Zn2(OH)2SO4 + H2SO4
Подлинность Доказывают Zn2+, SO42-.
Слайд 30
SO4 2- + BaCl2 → 2Cl -
+ BaSO4↓