Слайд 2
Что есть сталь
Сталь (от нем. Stahl) — сплав железа с углеродом (и другими элементами), характеризующийся
эвтектоидным превращением. Содержание углерода в стали не более 2,14 %.
Углерод придаёт сплавам железа прочность и твёрдость, снижая пластичность и вязкость.
Учитывая, что в сталь могут быть добавлены легирующие элементы, сталью называется содержащий не менее 45 % железа сплав железа с углеродом и легирующими элементами (легированная, высоколегированная сталь).
Слайд 3
Фазы и структуры стали
Для начала необходимо осознать ,
что сталь – очень обобщенное понятие . Сталь имеет
в своем структурном составе несколько фаз , т.е сталь соединение не одно , а многофазное . По структуре сталь разделяется на аустенитную, ферритную, мартенситную, бейнитную и перлитную
Слайд 4
Феррит
Феррит - фазовая составляющая сплавов железа, представляющая собой твёрдый раствор углерода и легирующих элементов в α-железе
(α-феррит). Имеет объёмноцентрированную кубическую кристаллическую решётку
При температурах выше 1401 °С в железоуглеродистых
сплавах образуется твёрдый раствор углерода в δ-железе (δ-феррит) , он же высокотемпературный феррит.
К диаграмме
Слайд 5
Свойства феррита
Растворимость углерода в α-феррите 0,02-0,03 % (по массе) при
723 °C, в δ-феррите — 0,1 %. Растворимость легирующих элементов может быть весьма значительной
или неограниченной. Легирование феррита в большинстве случаев приводит к его упрочнению. Нелегированный феррит относительно мягок, пластичен, сильно ферромагнитен до 768—770 °С.
Слайд 6
Аустенит
Аустенит (γ-фаза) — высокотемпературная гранецентрированная модификация железа и его сплавов.
В углеродистых сталях аустенит —
это твёрдый раствор внедрения, где атомы углерода входят внутрь элементарной ячейки
γ-железа во время конечной термообработки. В сталях, содержащих другие металлы (легированные стали), атомы металлов замещают атомы железа в кристаллической решетке и возникает твердый раствор замещения.
К диаграмме
Микроструктуры кристаллов различных фаз стали
Слайд 7
Эвтектоидное превращение
В углеродистых сталях аустенит существует при температурах не ниже 723 °C (1333 °F)
. Эвтектоидное (перлитное) превращение – распад аустенита при температуре
ниже 723 °C на две новых фазы – феррит и цементит , вместе образующие перлит .
Слайд 8
Мартенсит
Мартенсит — микроструктура игольчатого (пластинчатого) вида, а также реечного (пакетного) наблюдаемая
в закалённых металлических сплавах . Мартенсит — основная структурная составляющая закалённой стали; представляет собой
упорядоченный пересыщенный твёрдый раствор углерода в α-железе такой же концентрации, как у исходного аустенита .
К диаграмме
Микроструктура мартенсита ( с остаточным аустенитом )
Слайд 9
Кристаллическая структура мартенсита
Кристалл мартенсита тетрагонален, элементарная ячейка имеет форму прямоугольного параллелепипеда, атомы железа расположены в
вершинах и центре ячейки, атомы углерода в объёме ячеек.
Структура неравновесна, и в ней есть большие внутренние напряжения, что в значительной степени определяет высокую твёрдость и прочность сталей с мартенситной структурой.
Слайд 10
Перлит
Перлит — одна из структурных составляющих железоуглеродистых сплавов — сталей и чугунов:
эвтектоидная смесь двух фаз -феррита и цементита . В зависимости от формы различают
перлит пластинчатый и зернистый . С увеличением переохлаждения пластинки становятся более тонкими. Механические свойства перлита зависят в первую очередь от межпластиночного расстояния : чем оно меньше, тем выше значение предела прочности и предела текучести и ниже критическая температура хладноломкости. При перлитной структуре облегчается механическая обработка стали.
Издалека может показаться , что это современное искусство , но на самом деле это структура перлитной стали
Слайд 11
Бейнит
Бейнит - игольчатый троостит, структура стали, образующаяся в результате так
называемого промежуточного превращения аустенита. Бейнит состоит из смеси частиц пересыщенного углеродом феррита и карбида железа.
Образование бейнита сопровождается появлением характерного микрорельефа на полированной поверхности шлифа.
Верхний бейнит — (строение перистое), образуется из переохлажденного аустенита при температурах 500-350 °С. Имеет более высокую твердость и прочность, но пониженную пластичность.
Нижний бейнит - строение (игольчатое мартенситоподобное), образуется, в результате распада переохлажденного аустенита при температурах 350-200 °С. Имеет высокую твердость и прочность при высокой пластичности.
Еще один образец авангардной металлургии – бейнитная структура стали
Слайд 12
Пластичность
Пласти́чность — способность материала без разрушения получать большие остаточные деформации.
Мерой пластичности являются относительное удлинение , определяемое при проведении
испытаний на растяжение. Чем оно больше , тем более пластичным считается материал. У пластичных материалов прочностные характеристики на растяжение и сжатие сопоставляют по пределу текучести ( по простому говоря , последней точке где образец еще сопротивляется насилию над ним и не деформируется )
1. Предел прочности (временное сопротивление разрушению)
2. Предел текучести (верхний)
3. Точка разрушения
4. Область деформационного упрочнения
5. Образование шейки на образце
Слайд 13
Вязкость
Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих
тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно
другой ( жидкость не хочет , чтобы ее колебало тело и стремиться уравновесить ситуацию , вернуть себя в выгодное состояние с учетом вмешательства тела ). В результате происходит рассеяние в виде тепла работы, затрачиваемой на это перемещение.
Слайд 14
Вязкость v2.0
Механизм внутреннего трения в жидкостях и газах
заключается в том, что хаотически движущиеся молекулы переносят импульс
из одного слоя в другой, что приводит к выравниванию скоростей ( система уравновешивается ) — это описывается введением силы трения. Вязкость , в отличие от сухого трения , не имеет трения покоя и тело , при наличии любой внешней силы , обязательно придет в движение – или наоборот – движение тела в нем никогда не остановится , хоть и будет затухать , стремясь к нулю
Слайд 15
Твердость
Твёрдость — свойство материала сопротивляться внедрению в него другого,

более твёрдого тела — индентора.
Метод определения восстановленной твёрдости ( когда индентор не
пробивает тело , но оказывает на него давление ) :
Твёрдость = отношение величины нагрузки к площади поверхности, площади проекции или объему отпечатка. Различают поверхностную, проекционную и объемную твёрдость:
поверхностная твёрдость — отношение нагрузки к площади поверхности отпечатка;
проекционная твёрдость — отношение нагрузки к площади проекции отпечатка;
объёмная твёрдость — отношение нагрузки к объёму отпечатка.
Метод определения невосстановленной твёрдости ( индентор таки пробил тело ) :
поверхностная твёрдость — отношение силы сопротивления к площади поверхности внедренной в материал части индентора;
проекционная твёрдость — отношение силы сопротивления к площади проекции внедренной в материал части индентора;
объёмная твёрдость — отношение силы сопротивления к объёму внедренной в материал части индентора.
Слайд 16
Собственно , производство стали
Вся суть производства стали –
это обработка чугуна , а именно уменьшение до нужной
концентрации содержания углерода и вредных примесей — фосфора и серы, которые делают сталь хрупкой и ломкой . Эти элементы , как и лишний углерод , попросту окисляют . В зависимости от способа окисления углерода существуют различные способы переработки чугуна на сталь: конверторный, мартеновский и электротермический.
Слайд 17
Чугун
Чугу́н — сплав железа с углеродом с содержанием более 2,14 % (точка предельной растворимости
углерода в аустените на диаграмме состояний). Углерод в чугуне может
содержаться в виде цементита , лейдебурита или графита. В зависимости от формы графита и количества цементита, выделяют: белый, серый, ковкий и высокопрочные чугуны. Чугуны содержат постоянные примеси (Si, Mn, S, P), а в некоторых случаях также легирующие элементы (Cr, Ni,V, Al и др.). Как правило, чугун хрупок.
Слайд 18
Виды чугуна
Белый чугун
В белом чугуне весь углерод находится

в виде цементита. Структура такого чугуна — перлит, ледебурит и цементит. Такое название этот
чугун получил из-за светлого цвета излома.
Серый чугун
Серый чугун это сплав железа, кремния (от 1,2- 3,5 %) и углерода, содержащий также постоянные примеси Mn, P, S. В структуре таких чугунов большая часть или весь углерод находится в виде графита пластинчатой формы. Излом такого чугуна из-за наличия графита имеет серый цвет.
Ковкий чугун
Ковкий чугун получают длительным отжигом белого чугуна, в результате которого образуется графит хлопьевидной формы. Металлическая основа такого чугуна: феррит и реже перлит. Ковкий чугун получил свое название из-за повышенной пластичности и вязкости (хотя обработке давлением не подвергается). Ковкий чугун обладает повышенной прочностью при растяжении и высоким сопротивлением удару.
Высокопрочный чугун
Высокопрочный чугун имеет в своей структуре шаровидный графит, который образуется в процессе кристаллизации. Шаровидный графит ослабляет металлическую основу не так сильно как пластинчатый, и не является концентратором напряжений.
Половинчатый чугун
В половинчатом чугуне часть углерода (более 0,8 %) содержится в виде цементита. Структурные составляющие такого чугуна — перлит, ледебурит и пластинчатый графит.
Слайд 19
Выплавка чугуна . Доменная печь .
До́менная печь, до́мна —
большая металлургическая, вертикально расположенная плавильная печь шахтного типа для выплавки чугуна и ферросплавов из железорудного сырья. Важнейшей особенностью
доменного процесса является его непрерывность в течение всей кампании печи и противоток поднимающихся вверх фурменных газов с непрерывно опускающимся и наращиваемым сверху новыми порциями шихты столбом материалов.
Слайд 21
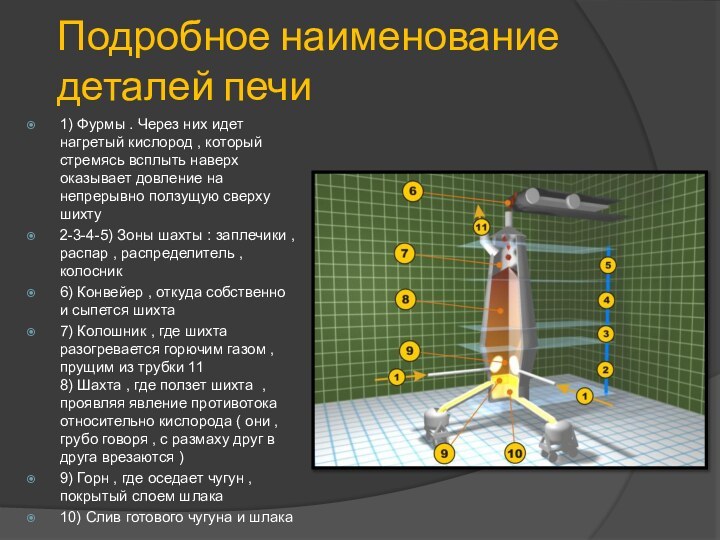
Подробное наименование деталей печи
1) Фурмы . Через них
идет нагретый кислород , который стремясь всплыть наверх оказывает
довление на непрерывно ползущую сверху шихту
2-3-4-5) Зоны шахты : заплечики , распар , распределитель , колосник
6) Конвейер , откуда собственно и сыпется шихта
7) Колошник , где шихта разогревается горючим газом , прущим из трубки 11
8) Шахта , где ползет шихта , проявляя явление противотока относительно кислорода ( они , грубо говоря , с размаху друг в друга врезаются )
9) Горн , где оседает чугун , покрытый слоем шлака
10) Слив готового чугуна и шлака
Слайд 22
Так что же , собсна , происходит ?
В
число сырья для печи входит кокс – особый уголь
, то бишь С . Когда он , разогретый , в составе шихты , под действием силы тяжести ползет вниз он наталкивается на молекулы кислорода , которые вдуваются внутрь печи через фурмы и стремятся попасть наверх ( как пузырьки в чем-нибудь газированном ) . В итоге протекает реакция сгорания угля до СО2 , который тоже начинает ползти наверх .
Слайд 23
Продолжение цикла
СО2 стартует значительно выше О2 , посему
он достигает тех частей шихты , до которых кислород
еще не дошел . Там СО2 реагирует с углеродом , образуя СО . И вот этот самый СО , обладает замечательным свойством восстанавливать оксиды железа . Ведь руда – это их смесь . СО доходит до кусков руды , уже изрядно нагретых , и начинает их восстанавливать : Fe2O3 + CO = Fe3O4 + CO2 . Что происходит с оксидом углерода(4) мы уже знаем , поэтому вернемся к куску руды . На его поверхности образуется пленка железной окалины , но окисление ФеДваОтри продолжается и внутри куска , ведь давление и температура ! Но пленка эта несмотря на то , что постоянно растет , тоже окисляется : Fe3O4 + CO = FeO + CO2 . Т.е появляется уже третий слой ( а изначального Fe2O3 все меньше и меньше ) . Но , впрочем и слой FeO исчезает под действием постоянно прибывающего СО , превращаясь в чистое железо .
Слайд 24
Далее
Рано или поздно почти все оксиды перегоняются

в железо . А расплавленное железо реагирует с углеродом
, который встраивается в его кристаллическую решетку . Так получается чугун . Но руда не состоит из одного железа : при температуре over1200 градусов плавится и пустая порода , состоящая из кремнеземов – оксидов кремния , марганца и железа2 , а так же фософра и серы . Тут включается в работу заранее загруженный флюс из CaO и недовосстановленные оксиды железа FeO , которые , как все типа знают ( общие св-ва классов <3 ) имеют основные свойства . В результате , все оксиды связываются в лютые соли типа (FeO)2SiO2 или (MnO)2SiO2 и выпадают в шлак , который в силу разных плотностей покрывает чугун , булькающий внизу пленкой . Сера и фосфор , связавшиеся с железом ( качество чугуна и стали очень зависит от кол-ва этих элементов в нем – чем меньше тем лучше ) выносятся , когда чугун стекает через шлак – он служит своеобразным фильтром : FeS + CaO + C = CaS + CO + Fe . Полученный чугун и шлак сливают через отверстия внизу печи . PROFIT!!
Слайд 25
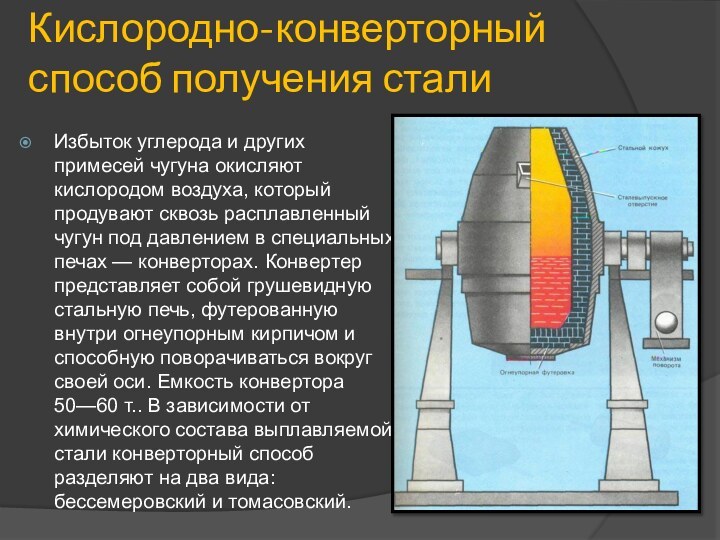
Кислородно-конверторный способ получения стали
Избыток углерода и других примесей
чугуна окисляют кислородом воздуха, который продувают сквозь расплавленный чугун
под давлением в специальных печах — конверторах. Конвертер представляет собой грушевидную стальную печь, футерованную внутри огнеупорным кирпичом и способную поворачиваться вокруг своей оси. Емкость конвертора 50—60 т.. В зависимости от химического состава выплавляемой стали конверторный способ разделяют на два вида: бессемеровский и томасовский.
Слайд 26
Работа конвертора в целом
На данном
рисунке представлен томасовский способ , но от бессемеровского картинка
отличается лишь наличием заранее загруженного СаО
Слайд 27
Бессемеровский способ ч.1
Бессемеровским способом перерабатывают чугуны, содержащие мало
фосфора и серы и богатые кремнием (не менее 2 %).
Конверторы футированы SiO2 . При продувке кислорода сначала окисляется кремний с выделением значительного количества тепла. Вследствие этого начальная температура чугуна примерно с 1300° C быстро поднимается до 1500—1600 °С. Около 1500 °C начинается интенсивное выгорание углерода. Вместе с ним интенсивно окисляется и железо, особенно к концу выгорания кремния и углерода:
Si + O2 = SiO2
2C + O2 = 2CO ↑
2Fe + O2 = 2FeO
Образующийся монооксид железа, FeO, хорошо растворяется в расплавленном чугуне и частично переходит в сталь, а частично реагирует с SiO2 и в виде силиката железа FeSiO3 переходит в шлак:
FeO + SiO2 = FeSiO3
Слайд 28
Бессемеровский способ ч.2
Фосфор полностью переходит из чугуна в
сталь. Так P2O5 при избытке SiO2 не может реагировать с основными
оксидами, поскольку SiO2 с последними реагирует более энергично. Поэтому фосфористые чугуны перерабатывать в сталь этим способом нельзя.
Все процессы в конверторе идут быстро — в течение 10—20 минут, так как кислород воздуха, продуваемый через чугун, реагирует с соответствующими веществами сразу по всему объёму металла . Монооксид углерода CO, образующийся при выгорании углерода, пробулькивает вверх, сгорает там, образуя над горловиной конвертора факел светлого пламени.
Слайд 29
Бессемеровский способ ч.3
Получаемая при этом сталь содержит значительные
количества растворенного монооксида железа FeO, который сильно снижает качество
стали. Поэтому перед разливкой сталь надо обязательно раскислить с помощью различных раскислителей — марганца, кремния или алюминия:
2FeO + Si = 2Fe + SiO2
FeO + Mn = Fe + MnO
3FeO + 2Al = 3Fe + Al2O3
Монооксид марганца MnO как основной оксид реагирует с SiO2 и образует силикат марганца MnSiO3, который переходит в шлак . Оксид алюминия как нерастворимое при этих условиях вещество тоже всплывает наверх и переходит в шлак
Слайд 30
Плюсы/минусы бессемеровского способа
+ Прост
+ Продуктивен
- Нужен особый чугун
-
Довольно таки большое выгорание металла , лишь 90% чугуна
переходит в сталь
- Требует много раскислителей и хим.состав стали не отрегулировать
Готово ! Бессемеровский способ восхитителен !
Слайд 31
Томасовский способ
Томасовские способом перерабатывают чугун с большим содержанием
фосфора (до 2 % и более). Основное отличие этого способа
от бессемеровского заключается в том, что футеровку конвертера делают из оксидов магния и кальция. Кроме того, к чугуну добавляют ещё до 15 % CaO. Вследствие этого шлакообразующие вещества содержат значительный избыток оксидов с основными свойствами.
Слайд 32
Томасовский способ ч.2
В этих условиях фосфатный ангидрид P2O5,
который возникает при сгорании фосфора, взаимодействует с избытком CaO
с образованием фосфата кальция и переходит в шлак:
4P + 5O2 = 2P2O5
P2O5 + 3CaO = Ca3(PO4)2
Реакция горения фосфора является одним из главных источников тепла при этом способе. При сгорании 1 % фосфора температура конвертора поднимается на 150 °C. Сера выделяется в шлак в виде нерастворимого в расплавленной стали сульфида кальция CaS, который образуется в результате взаимодействия растворимого FeS с CaO по реакции:
FeS + CaO = FeO + CaS
Слайд 33
Плюсы и минусы томасовского способа
Т.к дальше все
идет абсолютно идентично способу бессемеровскому и принципиальное отличие способов
лишь в разных подходах к разному сырью , то и плюсы и минусы у них одинаковые
Слайд 34
Мартеновский способ
Мартеновский способ отличается от конверторного тем, что
выжигание избытка углерода в чугуне происходит не только за
счет кислорода воздуха, но и кислорода оксидов железа, которые добавляются в виде железной руды и ржавого железного лома.
Да да , эти мужики со стальными … нервами работают в непосредственной близости к этому аду
Слайд 35
Мартеновская печь
Мартеновская печь состоит из плавильной ванны, перекрытой
сводом из огнеупорного кирпича, и особых камер регенераторов для
предварительного подогрева воздуха и горючего газа. Регенераторы заполнены насадкой из огнеупорного кирпича. Когда первые два регенератора нагреваются печными газами, горючий газ и воздух вдуваются в печь через раскаленные третий и четвёртый регенераторы. Через некоторое время, когда первые два регенератора нагреваются, поток газов направляют в противоположном направлении и т. д.
Слайд 36
Химические процессы в мартене
В плавильную ванну загружают железный
лом и железную руду. К шихте добавляют также известняк
как флюс. Температура печи поддерживается при 1600—1650 °C и выше. Выгорания углерода и примесей чугуна в первый период плавки происходит главным образом за счёт избытка кислорода в горючей смеси с теми же реакциями, что и в конверторе, а когда над расплавленным чугуном образуется слой шлака — за счёт оксидов железа:
4Fe2O3 + 6Si = 8Fe + 6SiO2
2Fe2O3 + 6Mn = 4Fe + 6MnO
Fe2O3 + 3C = 2Fe + 3CO ↑
5Fe2O3 + 2P = 10FeO + P2O5
FeO + С = Fe + CO ↑
Вследствие взаимодействия основных и кислотных оксидов образуются силикаты и фосфаты, которые переходят в шлак. Сера тоже переходит в шлак в виде сульфида кальция:
MnO + SiO2 = MnSiO3
3CaO + P2O5 = Ca3(PO4)2
FeS + CaO = FeO + CaS
Слайд 37
Шихта
Ши́хта — смесь исходных материалов, а
в некоторых случаях и топлива в определённой пропорции, подлежащая
переработке в металлургических, химических и других агрегатах.
Шихтами обычно называют исходные смеси, использующиеся в пирометаллургических или иных высокотемпературных процессах.
Требования к качеству шихты определяются обеспечением стабильности и воспроизводимости результатов процесса, в котором она используется:
постоянство химического состава;
однородность по химическому, минералогическому и гранулометрическому составу;
оптимальная крупность компонентов шихты;
оптимальная влажность.
Слайд 38
Флюс
Флю́сы — неорганические вещества, которые добавляют к руде при выплавке металлов,
чтобы снизить температуру плавления и легче отделить металл от
пустой породы.
Флюсами, или плавнями, называются примеси, прибавляемые при выплавке металлов с целью образования шлака надлежащей степени плавкости. Впрочем, часто флюсами называются также примеси, прибавленные с целью разложить то или другое металлическое соединение или растворить металл или его соединения в массе прибавленного вещества и т. д. Выбор флюса зависит от рода плавки и от состава руд.
Слайд 39
Производственный цикл мартена
Мартеновские печи, как и конверторы, работают
периодически. После разливки стали печь снова загружают шихтой и т. д.
Процесс переработки чугуна в сталь в мартенах происходит относительно медленно — в течение 6—7 часов. В отличие от конвертора, в мартенах можно легко регулировать химический состав стали, добавляя к чугуну железный лом и руду в той или иной пропорции. Перед окончанием плавки нагрев печи прекращают, сливают шлак, а затем добавляют раскислители . В мартенах можно получать и легированную сталь. Для этого в конце плавки добавляют к стали соответствующие металлы или сплавы.
Слайд 40
Электротермический способ
Электротермический способ имеет перед мартеновским конверторным целый
ряд преимуществ. Этот способ позволяет получать сталь очень высокого
качества и точно регулировать её химический состав. Доступ воздуха в электропечь незначительный, поэтому значительно меньше образуется FeO, загрязняющего сталь и ухудшающего её свойства. Температура в электропечи — не ниже 2000 °C. Это позволяет проводить плавку стали на сильно основных шлаках (которые трудно плавятся), при которых полнее удаляется фосфор и сера. Кроме того, благодаря очень высокой температуре в электропечах можно легировать сталь тугоплавкими металлами — молибденом и вольфрамом. Но в электропечах расходуется очень много электроэнергии — до 800 кВт·ч на 1 т стали. Поэтому этот способ применяют только для получения высококачественной спецстали.
Слайд 42
Виды электропечей
Кислые – с футеровкой из SiO2
Индукционные –

где используется тепло выделяемое в металле за счет возбуждения
в нем электрического тока переменным магнитным полем. Источником магнитного поля в индукционной печи служит индуктор. Проводящая электрический ток шихта, помещенная в тигель печи, подвергается воздействию переменного магнитного поля, возникающего от индуктора, нагревается в следствие теплового воздействия вихревых токов.
Ковшевые- После окончания окислительного периода и раскисления металла наводят новый шлак с высоким содержанием СаО. В течение 40 - 60 мин шлак раскисляют молотым коксом и ферросилицием. Перед выпуском в шлак дают CaF2. Высокое (10 - 20 %) содержание CaF2 обеспечивает высокую рафинирующую способность шлака. При выпуске из печи вначале выпускают в ковш жидкий шлак и затем мощной струей металл. Перемешивание металла со шлаком обеспечивает высокую степень рафинирования от примесей (от серы) и неметаллических включений. Одной из форм рафинирования стали в ковше можно считать технологию синтетических шлаков на основе СаО - Al2O
Слайд 43
Дуговые печи
Источником тепла в дуговой печи является электрическая

дуга, возникающая между электродами и жидким металлом или шихтой при
приложении к электродам электрического тока необходимой силы. Дуга представляет собой поток электронов, ионизированных газов и паров металла и шлака. Температура электрической дуги превышает 3000о С. Дуга, как известно, может возникать при постоянном и постоянном токе. Дуговые печи работают на переменном токе. При горении дуги между электродом и металлической шихтой в первый период плавки, когда катодом является электрод, дуга горит, т. к. пространство между электродом и шихтой ионизируется за счет испускания электронов с нагретого конца электрода. При перемене полярности, когда катодом становится шихта - металл, дуга гаснет, т. к. в начале плавки металл еще не нагрет и его температура недостаточна для эмиссии электронов. При последующей перемене полярности дуга вновь возникает, поэтому в начальный период плавки дуга горит прерывисто, неспокойно.
Слайд 44
Характеристики стали
плотность ρ ≈ 7,86 г / см3;
коэффициент линейного теплового расширения α = 11 … 13
· 10−6 K−1;
коэффициент теплопроводности k = 58 Вт / (м · K);
модуль Юнга E = 210 ГПа;
модуль сдвига G = 80 ГПа;
коэффициент Пуассона ν = 0,28 … 0,30;
удельное сопротивление (20 ° C , 0,37-0,42 % углерода) = 1,71 · 10−7 Ом · м
Слайд 45
Механическая обработка стали
Сталь в исходном состоянии достаточно пластична,
её можно обрабатывать путем деформирования: ковать, вальцевать, штамповать. Характерной
особенностью стали является её способность существенно изменять свои механические свойства после термической обработки сущность которой заключается в изменении структуры стали при нагреве, выдержке и охлаждении, согласно специальному режиму. Различают следующие виды термической обработки:
отжиг;
нормализация;
закалки;
отпуск.
Чем богаче сталь на углерод, тем она тверже после термической обработки. Сталь с содержанием углерода до 0,3 % (техническое железо) практически закаливанию не поддается.
Слайд 46
Химико-техническая обработка стали
Химико-термическая обработка сталей в дополнение к

изменениям в структуре стали также приводит к изменению химического
состава поверхностного слоя путем добавления различных химических веществ до определенной глубины поверхностного слоя. Среди наиболее распространенных целей при использовании этих технологий является повышение твердости поверхности при высокой вязкости сердцевины, уменьшение сил трения, повышения износостойкости, повышения устойчивости к усталости и улучшения коррозионной стойкости. К этим методам относятся:
Цементация (C) увеличивает твердость поверхности мягкой стали из-за увеличения концентрации углерода в поверхностных слоях.
Азотирования (N) как и цементация увеличивает поверхностную твердость и износостойкость стали.
Цианирования и нитроцементация (N + C) — это процесс одновременного насыщения поверхности сталей углеродом и азотом. При цианировании используют расплавы солей, имеющих в своем составе группу NaCN, а при нитроцементации — смесь аммиака с газами, которые имеют в составе углерод (СО, СН4 и др.). После цианирования и нитроцементации проводят закаливание и низкий отпуск.
Сульфатирования (S) — насыщение поверхности серой улучшает приработки трущихся поверхностей деталей, уменьшается коэффициент трения.