- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Степень окисления.
Содержание
- 2. Ионная связьNa0 +11 2е,8е,1е Cl0 +17
- 3. Ковалентная полярная связьЗа счет чего дополняется внешний
- 4. Бинарные соединения – Соединения, состоящие из двух видов атомов (NaCl, HCl, H2O, CO2)
- 5. Ковалентная неполярная связьМожно ли в простых веществах отнести общие пары к какому-то атому?
- 6. Сравним соединенияH → ClCl - ClNa +Cl-Независимо
- 7. Степень окисления – Это условный заряд атомов
- 8. Правила определения степени окисления:Степень окисления свободных атомов
- 9. Промежуточные с.о.Рассмотрим возможные с.о. серы – SМаксимальная
- 10. Как определить степень окисления элемента в соединении?
- 11. Задание :Определите С.О. по формулам:Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
- 12. Алгоритм названия бинарных соединений:Пример: Al+32O-23 – оксид
- 13. Алгоритм составления формул по названиям:Записать знаки элементов
- 14. ЗАДАНИЕ: Составить формулы веществ по названиям:хлорид кальцияоксид
- 15. Скачать презентацию
- 16. Похожие презентации
Ионная связьNa0 +11 2е,8е,1е Cl0 +17 2e,8e,7eКакой вид связи может образоваться между этими атомами?Na0 + Cl0 → Na+ + Cl- → Na+Cl-












Слайд 2
Ионная связь
Na0 +11 2е,8е,1е
Cl0 +17 2e,8e,7e
Какой
вид связи может образоваться между этими атомами?
→ Na+ + Cl- → Na+Cl-
Слайд 3
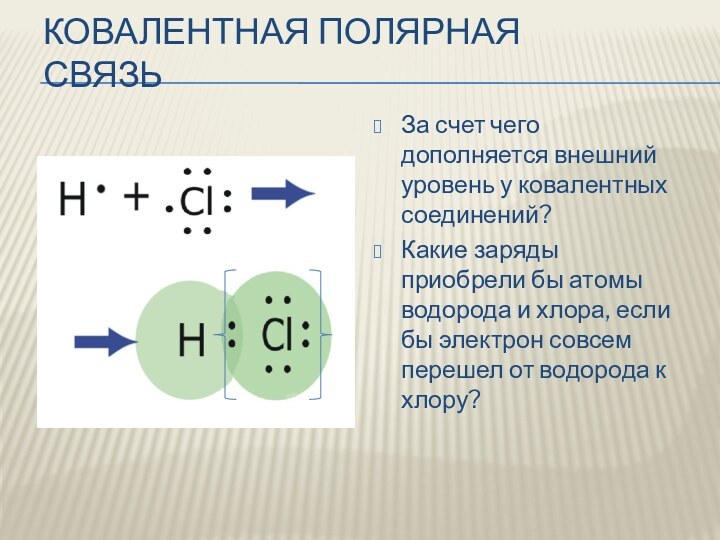
Ковалентная полярная связь
За счет чего дополняется внешний уровень
у ковалентных соединений?
Какие заряды приобрели бы атомы водорода
и хлора, если бы электрон совсем перешел от водорода к хлору?
Слайд 5
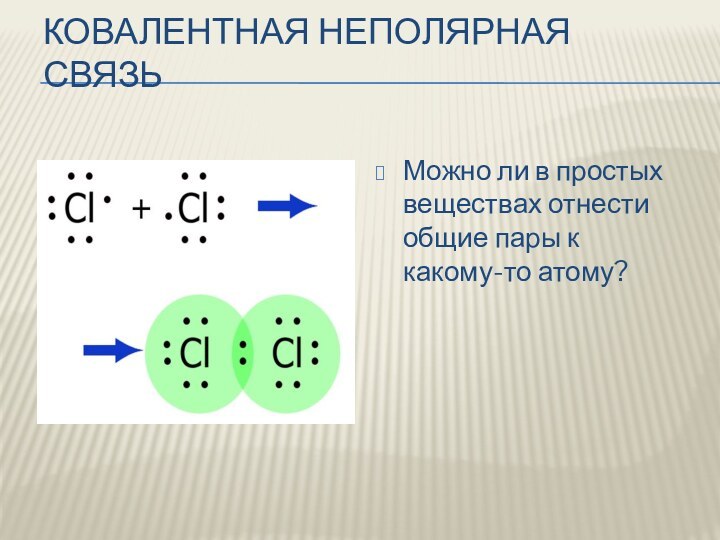
Ковалентная неполярная связь
Можно ли в простых веществах отнести
общие пары к какому-то атому?
Слайд 6
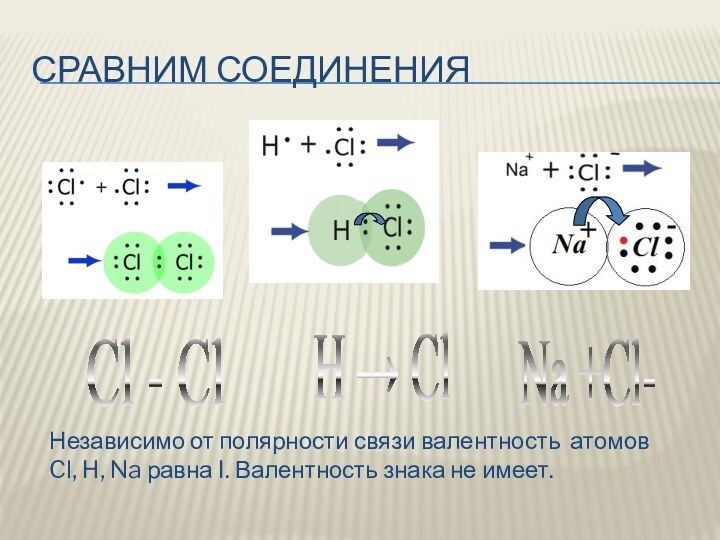
Сравним соединения
H → Cl
Cl - Cl
Na +Cl-
Независимо от
полярности связи валентность атомов Cl, H, Na равна I.
Валентность знака не имеет.
Слайд 7
Степень окисления –
Это условный заряд атомов химического
элемента в соединении, вычисленный на основе предположения, что все
соединения (и ионные и ковалентно-полярные) состоят только из ионов.
Слайд 8
Правила определения степени окисления:
Степень окисления свободных атомов и
простых веществ равна 0: ( Mg0, N20, K0)
Степень окисления
водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH-1, H+1Cl).Степень окисления фтора в соединениях всегда равна -1: (HF-1, CaF-12).
Степень окисления кислорода в соединениях равна -2 (NO-2, Al2O3-2), а в пероксидах -1 (H2O2-1) в соединении с фтором +2 (O+2F2)
Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
Суммарная степень окисления всех атомов в молекуле равна 0.
Высшая степень окисления элемента равна (+№ группы).
Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
Слайд 9
Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6
SO3
Минимальная -2 H2S
Сера может проявлять с.о. 0,+2,+4 –
это промежуточные с.о.Слайд 10 Как определить степень окисления элемента в соединении? (с.
88)
1) Определение степеней окисления начинают с того элемента, у
которого С.О. (Р2О-25); постоянная или известна в соответствии с правилами (см. выше);2) Умножить эту С.О. на индекс (– 2 * 5 = – 10);
3) Полученное число разделить на индекс второго элемента (– 10 / 2 = – 5);
Записать полученную С.О. с противоположным знаком (Р+52О-25).
Слайд 12
Алгоритм названия бинарных соединений:
Пример: Al+32O-23 – оксид алюминия;
Cu+2O-2 – оксид меди (II)
Cl-1 – хлорид; O-2 – оксид; Н-1 – гидрид;
S-2 – сульфид; C-4 – карбид; N-3 – нитрид; P-3 — фосфид; Si-4 — силицид.
Слайд 13
Алгоритм составления формул по названиям:
Записать знаки элементов (частиц)
в порядке: на первом месте – положительно заряженную, на
втором – отрицательно заряженную ( Al O );Расставить степени окисления ( Al+3 O-2);
Найти наименьшее общее кратное (НОК) между значениями степеней окисления, записать его между ними в “окошечко”;
Разделить НОК на значение степеней окисления, полученные результаты записать как индексы (6/3=2; 6/3=3 Al2O3).





























