- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему тема: Реакции щелочно-земельных металлов (Группа 2) – mg, ca
Содержание
- 2. Ц е л и о б
- 3. К р и т е р и
- 6. Изучите материал по общей характеристике щелочно-земельных металлов, заполните таблицу.Интерактивная ПСХЭ с фотографиями элементов: http://periodictable.com/
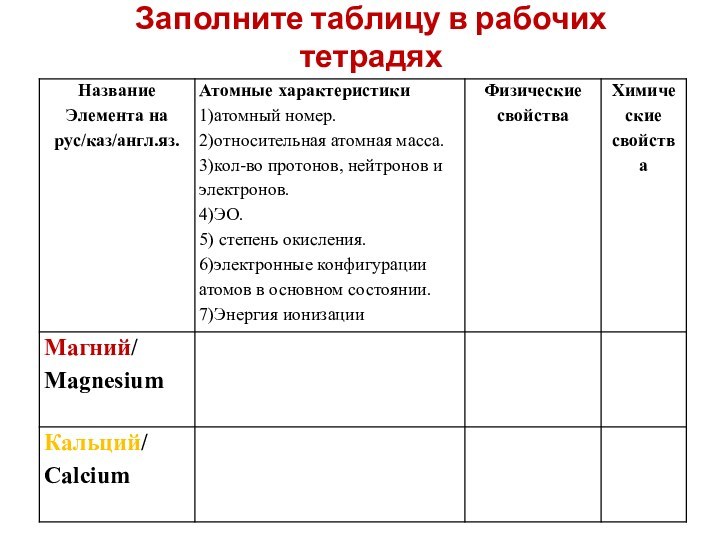
- 7. Заполните таблицу в рабочих тетрадях
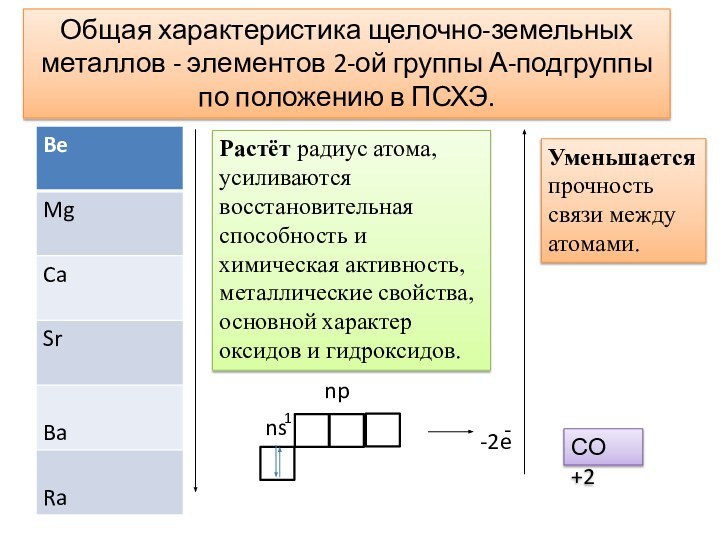
- 8. Растёт радиус атома, усиливаются восстановительная способность и
- 9. Общая характеристика щелочно-земельных металлов - элементов 2-ой группы А-подгруппы по положению в ПСХЭ.
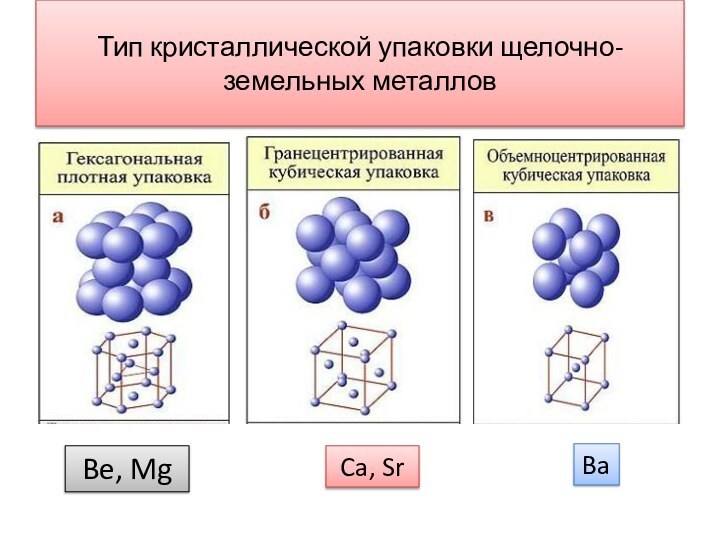
- 10. Тип кристаллической упаковки щелочно-земельных металловBe, MgCa, SrBa
- 11. Общая характеристика физических свойств щелочно-земельных металловВсе щёлочноземельные
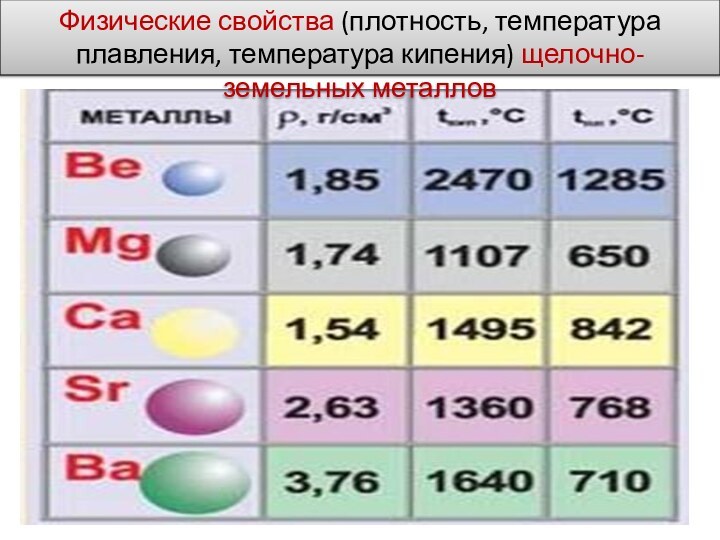
- 12. Физические свойства (плотность, температура плавления, температура кипения) щелочно-земельных металлов
- 15. ХИМИЧЕСКИЕ СВОЙСТВА магния и кальцияВзаимодействие с простыми
- 16. Реакция горения магния: https://www.youtube.com/watch?v=gRUEa07Ji5YПросмотр видеоматериалаРеакция горения кальция:https://www.youtube.com/watch?v=_NM1H2OPlo4
- 17. Просмотр видеоматериалаВзаимодействие кальция с водой: http://www.nofollow.ru/video.php?c=JaXQNtObObwВзаимодействие магния с водой: http://salda.ws/video.php?id=Xa0bxgtMQpY
- 18. Применение важнейших соединений кальция
- 19. Применение важнейших соединений кальция
- 20. Применение важнейших соединений кальция
- 21. Применение важнейших соединений магния
- 22. Скачать презентацию
- 23. Похожие презентации
Ц е л и о б у ч е н и я- знать реакции металлов 2-ой групп с водой, разбавленными кислотами и горение на воздухе

















Слайд 3 К р и т е р и и
у с п е х а
- знает особенности
электронного строения атомов металлов 2 группы;- умеет определить вид химической связи в соединениях металлов 2 группы;
- может предсказать химические свойства для металлов 2 группы;
- может дать сравнительную характеристику металлов 2 группы по положению в ПС (атомный радиус, энергия ионизации, сродство к электрону, электроотрицательность).
Слайд 6
Изучите материал по
общей характеристике щелочно-земельных металлов, заполните таблицу.
Интерактивная
ПСХЭ с фотографиями элементов:
http://periodictable.com/
Слайд 8 Растёт радиус атома, усиливаются восстановительная способность и химическая
активность, металлические свойства, основной характер оксидов и гидроксидов.
Уменьшается прочность
связи между атомами.-2e
СО +2
-
np
1
ns
Общая характеристика щелочно-земельных металлов - элементов 2-ой группы А-подгруппы по положению в ПСХЭ.
Слайд 9 Общая характеристика щелочно-земельных металлов - элементов 2-ой группы
А-подгруппы по положению в ПСХЭ.
Слайд 11
Общая характеристика физических свойств щелочно-земельных металлов
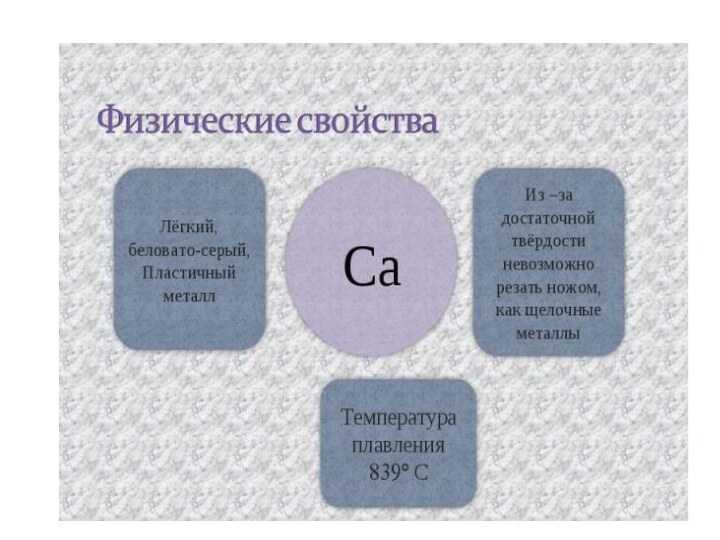
Все щёлочноземельные металлы
серые, твёрдые при комнатной температуре вещества. В отличие от
щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся. Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).Слайд 12 Физические свойства (плотность, температура плавления, температура кипения) щелочно-земельных
металлов
Слайд 15
ХИМИЧЕСКИЕ СВОЙСТВА магния и кальция
Взаимодействие с простыми веществами:
1)Реакция
горения.
2)Реакция с азотом.
3)Реакция с серой.
4)Реакция с хлором.
5)Реакция с водородом.
Взаимодействие
со сложными веществами:1)Реакция с водой.
2)Реакция с разбавленными кислотами.





























