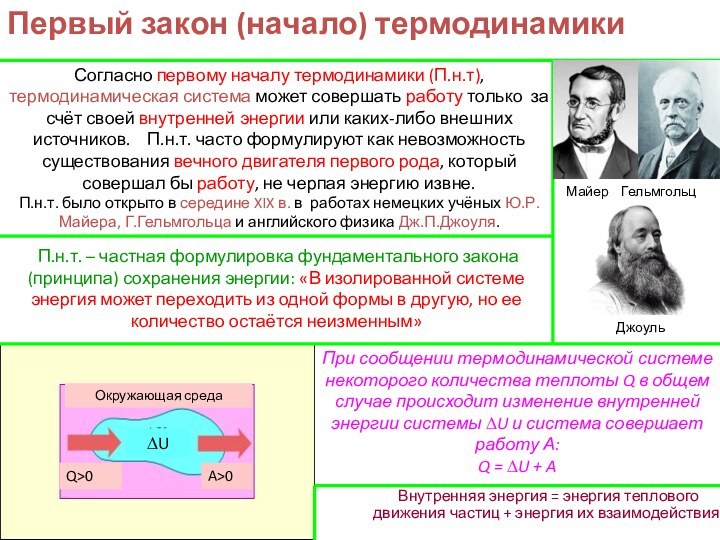
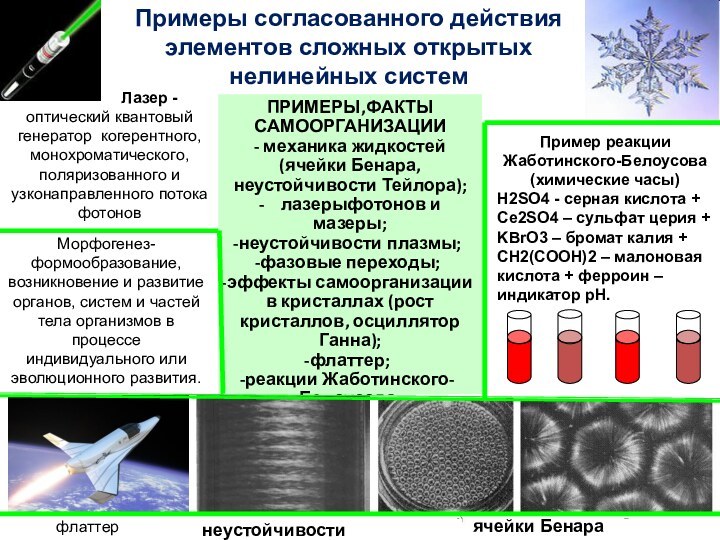
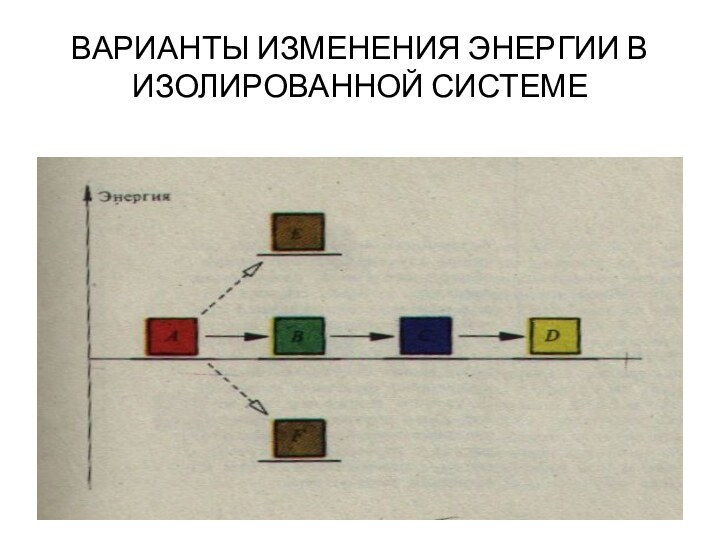
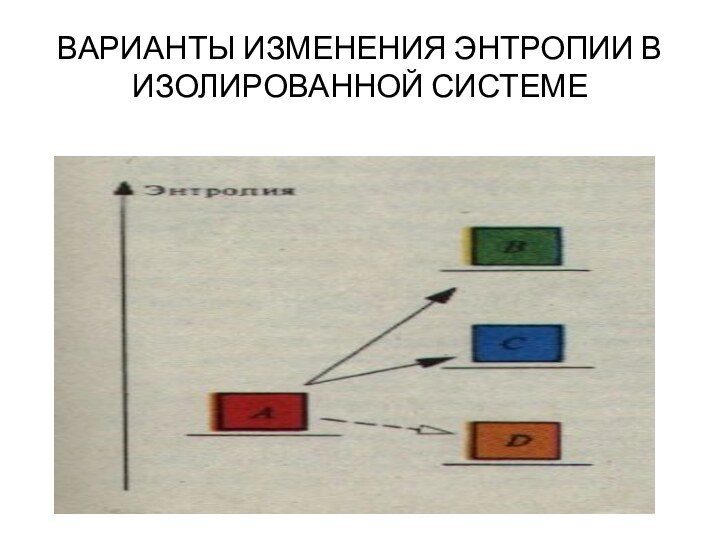
изучением наиболее общих законов преобразования и передачи энергии. Термодинамика
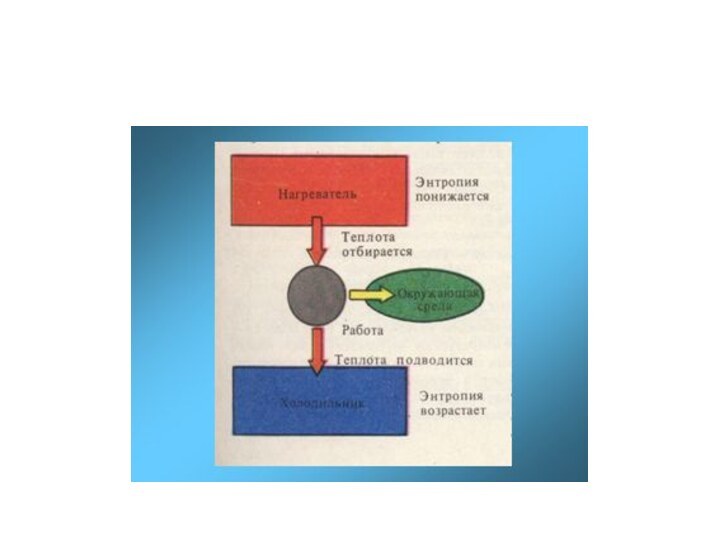
изучает термодинамические системы и термодинамические процессы Термодинамическая система (Т.с) — это любая область пространства, ограниченная действительными или воображаемыми границами, выбранными для анализа её внутренних термодинамических параметров. Т.с. может содержать любой набор тел, находящихся в различных фазовых состояниях. Выделяют Т.с : открытые и изолированные; первые обмениваются с окружающей средой энергией, веществом, информацией, вторые – нет.
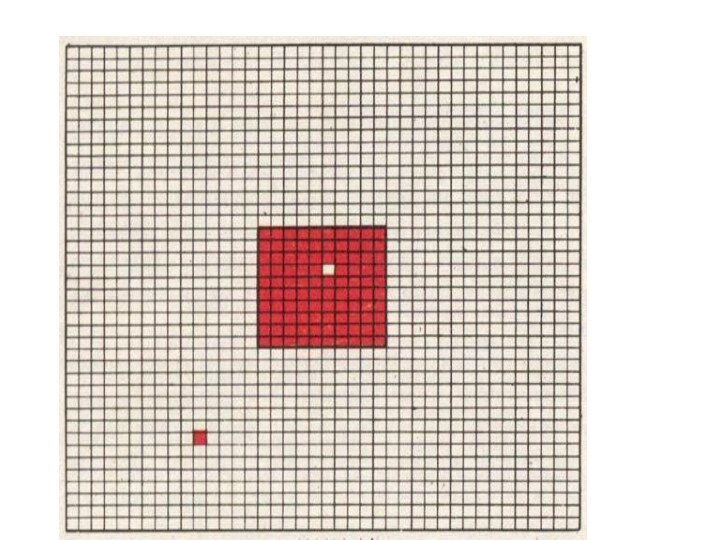
Термодинамическое состояние характеризуется совокупностью макроскопических параметров состояния, определяющих внутренние свойства системы в данном состоянии и её взаимодействие с внешними телами.
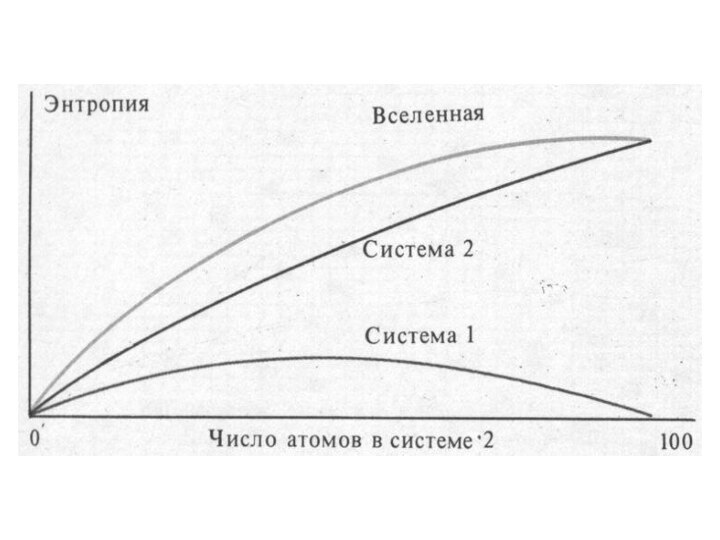
Термодинамический процесс — изменение хотя бы одного макроскопического параметра термодинамической системы.
Параметры состояния ( термодинамические параметры) — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность, электрическая поляризация и др., не применимые к отдельным атомам, молекулам.
Основатель термодинамики – Сади Карно (1796-1832гг.), французский морской офицер