- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Цветная металлургия
Содержание
- 2. Цветная металлургия Цветная металлургия — отрасль металлургии, которая
- 3. Также условно цветные металлы можно разделить на
- 4. > 30 лет назад…
- 5. АлюминийЛекция
- 6. Алюминий Алюминий — элемент главной подгруппы третьей группы
- 7. Алюминиевые руды Важнейшими минералами, содержащими алюминий, являются:Корунд—
- 8. Физические свойстваметалл серебристо-белого цвета, лёгкий,плотность — 2,7
- 9. Производство Основным современным способом производства алюминия является электролитический
- 10. Способ Байера Способ Байера — способ выделения глинозема
- 11. 1. Подготовка боксита к выщелачиванию Боксит дробят и размалывают
- 12. 2. Выщелачивание боксита Выщелачивание боксита, заключается его в химическом
- 13. В растворе алюминат натрия и силикат натрия
- 14. 3. Отделение алюминатного раствора от красного шлама Отделение алюминатного
- 15. 4. Разложение алюминатного раствора Разложение алюминатного раствора, называемое также
- 16. 5. Отделение кристаллов гидрооксида алюминия Отделение кристаллов гидрооксида алюминия
- 17. 6. Обезвоживания гидроокиси алюминия (кальцинации) Это завершающая операция
- 19. Электролитическое получение алюминия Алюминий получают путем электролиза глинозема,
- 20. Кислотный способ получения криолита Во вращающихся трубчатых печах
- 21. Плавиковую кислоту подвергают обескремниванию, для чего к
- 22. Электролизная ванна или электролизер1 — кожух; 2
- 23. Тепло генерируется за счет прохождения тока через
- 24. Рафинирование Рафинирование - очистка чего-либо от посторонних примесей. Черновой
- 25. Хлорирование (проводится в ковше продувкой газообразным
- 26. Для рафинирования алюминия так же используют такие
- 27. Сплавы на основе алюминия В качестве конструкционного материала
- 28. ПрименениеАвиация и космонавтикаТранспортПищевая промышленностьЯдерная энергетикаЭлектроникаХимическая промышленностьИ многое другое
- 30. Вопросы для самоконтроля:Получение глинозема по методу Байера.Получение
- 31. Скачать презентацию
- 32. Похожие презентации
Цветная металлургия Цветная металлургия — отрасль металлургии, которая включает добычу, обогащение руд цветных металлов и выплавку цветных металлов и их сплавов.




























Слайд 3 Также условно цветные металлы можно разделить на четыре
группы:
1) тяжелые металлы — медь, никель, свинец, цинк, олово;
2) легкие металлы
— алюминий, магний, кальций, калий, натрий, барий, бериллий, литий;3) благородные металлы — золото, серебро, платина и ее природные спутники (родий, иридий, палладий, осмий);
4) редкие металлы; к этой группе относятся:
тугоплавкие металлы— молибден, вольфрам, ванадий, титан, ниобий, тантал и цирконий;
легкие — стронций, скандий, рубидий и цезий;
радиоактивные — уран, радий, торий, актиний и протактиний;
рассеянные и редкоземельные — германий, галлий, гафний, индий, лантан, таллий, церий и рений.
Слайд 6
Алюминий
Алюминий — элемент главной подгруппы третьей группы третьего
периода периодической системы химических элементов Д. И. Менделеева. Атомный
номер 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов.Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
Слайд 7
Алюминиевые руды
Важнейшими минералами, содержащими алюминий, являются:
Корунд— Al2O3
Диаспор
(бемит) —AlOOH
Шпинель — Al2O3·MgO
Гиббсит —Al(OH)3
Кианит (андалузит, силимонит) — Al2O3·SiO2
Каолин
— Al2O3·2SiO2·2H2Oи д.р.
Основные алюминиевые руды – бокситы, нефелины, алуниты, каолины и кианиты.
Содержание глинозёма в промышленных бокситах колеблется от 40 % до 60 % и выше. Используется также в качестве флюса в чёрной металлургии. К числу крупных месторождений бокситов в нашей стране относится Тихвинское (Ленинградская область), Северо-уральское (Свердловская область), Южноуральское (Челябинская область), Тургайское и Краснооктябрьское (Кустанайская область).
Слайд 8
Физические свойства
металл серебристо-белого цвета, лёгкий,
плотность — 2,7 г/см³,
температура
плавления у технического алюминия — 658 °C, у алюминия
высокой чистоты — 660 °Cудельная теплота плавления — 390 кДж/кг,
температура кипения — 2500 °C
твёрдость по Бринеллю — 24…32 кгс/мм²,
высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
модуль Юнга — 70 ГПа.
Алюминий обладает высокой электропроводностью (0,0265 мкОм·м) и теплопроводностью (1,24×10−3 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью.
слабый парамагнетик
Алюминий образует сплавы почти со всеми металлами
Сродство алюминия к кислороду очень большое
Слайд 9
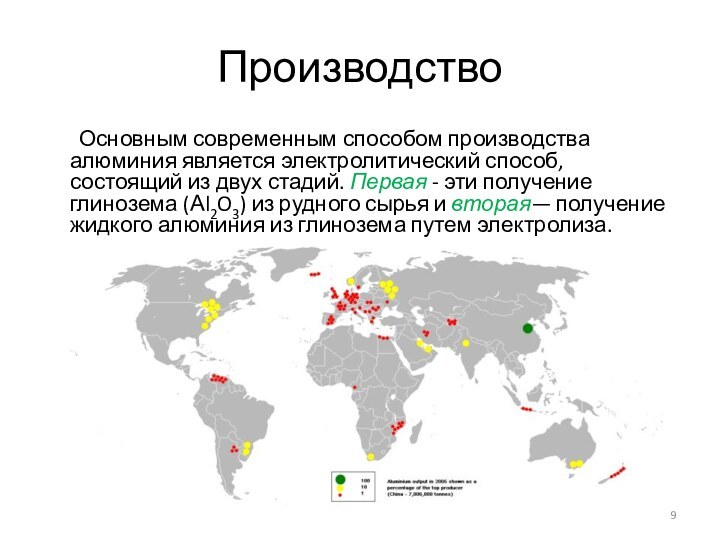
Производство
Основным современным способом производства алюминия является электролитический способ,
состоящий из двух стадий. Первая - эти получение глинозема
(Аl2O3) из рудного сырья и вторая— получение жидкого алюминия из глинозема путем электролиза.
Слайд 10
Способ Байера
Способ Байера — способ выделения глинозема из
боксита — основан на выщелачивании, цель которого растворить содержащийся
в боксите оксид алюминия Аl2O3, избежав перевода в раствор остальных составляющих боксита (SiO2, Fe2O3 и др.).В основе способа лежит обратимая химическая реакция:
Аl2O3 · n Н2O + 2NaOH = Na2O · Аl2O3+ (n + 1)H2O
При протекании реакции вправо глинозем в виде алюмината натрия переходит в раствор, а при обратном течении реакции образующийся гидратированный Аl2O3 выпадает в осадок.
Слайд 11
1. Подготовка боксита к выщелачиванию
Боксит дробят и размалывают до
фракций размером 0,05—0,15 мм в среде добавляемой щелочи и
оборотного раствора щелочи NaOH, добавляют также немного извести, активизирующей выщелачивание.
Слайд 12
2. Выщелачивание боксита
Выщелачивание боксита, заключается его в химическом разложении
от взаимодействия с водным раствором щелочи; гидраты окиси алюминия
при взаимодействии со щелочью переходят в раствор в виде алюмината натрия:AlOOH+NaOH → NaAlO2+H2O
или
Al(OH)3+NaOH → NaAlO2+2H2O;
Содержащийся в боксите кремнезем взаимодействует со щелочью и переходит в раствор в виде силиката натрия:
SiO2+2NaOH → Na2SiO3+H2O;
Слайд 13 В растворе алюминат натрия и силикат натрия образуют
нерастворимый натриевый алюмосиликат; в нерастворимый остаток переходят окислы титана
и железа, предающие остатку красный цвет; этот остаток называют красным шламом. По окончании растворения полученный алюминат натрия разбавляют водным раствором щелочи при одновременном понижении температуры на 100 °С.Выщелачивание производится в автоклавах — сосудах, работающих под давлением. Продуктом является автоклавная пульпа, состоящая из алюминатного раствора (содержащего Na2O · Аl2O3) и шлама (осадка, в который выпадают остальные примеси боксита).
Слайд 14
3. Отделение алюминатного раствора от красного шлама
Отделение алюминатного раствора
от красного шлама обычно осуществляемого путем промывки в специальных
сгустителях; в результате этого красный шлам оседает, а алюминатный раствор сливают и затем фильтруют (осветляют).Получаемый красный шлам (окраску ему придают частицы Fe2O3) идет в отвал, шлам содержит, %: Аl2O3 12—18, SiO2 6—11, Fe2O3 44—50, CaO 8—13.
Слайд 15
4. Разложение алюминатного раствора
Разложение алюминатного раствора, называемое также декомпозицией
или выкручиванием, проводят с целью перевести алюминий из раствора
в осадок в виде Аl2O3 · 3 Н2O, для чего обеспечивают течение приведенной выше реакции выщелачивания влево, в сторону образования Аl2O3 · 3 Н2O.
Слайд 16
5. Отделение кристаллов гидрооксида алюминия
Отделение кристаллов гидрооксида алюминия от
раствора и классификация кристаллов по крупности: после декомпозиции пульпа
поступает в сгустители, где гидрооксид отделяют от раствора.
Слайд 17
6. Обезвоживания гидроокиси алюминия (кальцинации)
Это завершающая операция производства
глинозема; ее осуществляют в трубчатых вращающихся печах, а в
последнее время также в печах с турбулентным движением материала при температуре 1150-1300 °С; сырая гидроокись алюминия, проходя через вращающуюся печь, высушивается и обезвоживается; при нагреве происходят последовательно следующие структурные превращения:Al(OH)3 → AlOOH→ γ-Al2O3 → α-Al2O3
В окончательно прокаленном глиноземе содержится 30-50% α- Al2O3 (корунд), остальное γ- Al2O3.
Слайд 19
Электролитическое получение алюминия
Алюминий получают путем электролиза глинозема, растворенного
в расплавленном электролите, основным
компонентом которого является криолит Na3AlF6.Сырьем для производства криолита служит плавиковый шпат или флюорит CaF2
Из концентрата криолит можно получить двумя способами: кислотным и щелочным.
Слайд 20
Кислотный способ получения криолита
Во вращающихся трубчатых печах при
200 °С протекает реакция взаимодействия плавикового шпата с крепкой
серной кислотой с образованием фтористого водорода и гипса:CaF2 + H2SO4 = 2HF + CaSO4
Если в плавиковом шпате присутствует кремнезем, то возможно протекание следующих реакций:
SiO2(тв) + 4HF(г) = SiF4(г) + H2O
SiF4(г) + 2HF(г) = H2SiF4(г)
Эти реакции показывают, что примеси кремнезема снижают выход HF и загрязняют его кремнефтористой кислотой. Газы поглощаются водой в специальных башнях с насадкой.
Слайд 21 Плавиковую кислоту подвергают обескремниванию, для чего к кислоте
добавляют соду:
H2SiF4 + NaCO3 = NaSiF6↓ + CO2 +
H2OДалее для получения криолита в раствор чистой плавиковой кислоты добавляют расчетное количество Al(OH)3:
6HF + Al(OH)3 = H3AlF6 + 3H2O
Затем на образовавшуюся фторалюминиевую кислоту действуют содой, при этом получается криолит:
2 H3AlF6 + 3 NaCO3 = 2NaAlF6 + 3CO2 + 3H2O
Далее криолит отделяют от раствора, промывают и сушат в сушильных барабанах при 140 – 160 °С.
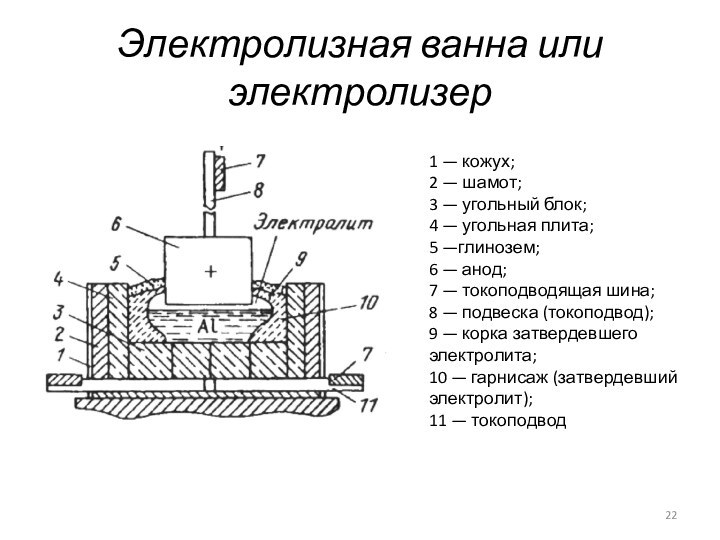
Слайд 22
Электролизная ванна или электролизер
1 — кожух;
2 —
шамот;
3 — угольный блок;
4 — угольная плита;
5 —глинозем;
6 — анод;
7 — токоподводящая шина;
8 — подвеска (токоподвод);
9 — корка затвердевшего электролита;
10 — гарнисаж (затвердевший электролит);
11 — токоподвод
Слайд 23 Тепло генерируется за счет прохождения тока через электролит.
Глинозем в ванну подается сверху. Алюминий накапливается на подине
под слоем электролита. В ванне протекают реакции:На катоде: Al3+ + 3e = Al
На аноде: 2O2- - 4e = O2
Т.е. на катоде выделяется алюминий, который впоследствии скапливается на дне ванны. На анодах выделяется кислород, взаимодействующий с углеродом электродов с образованием газов CO и CO2. По мере сгорания анодов их постепенно опускают вниз. Глинозем добавляют в ванну по мере расходования. В результате электролиза получают алюминий-сырец или черновой алюминий. Слив алюминия проводят через сифон.
Слайд 24
Рафинирование
Рафинирование - очистка чего-либо от посторонних примесей.
Черновой алюминий
содержит примеси трех видов:
Неметаллические включения (их механически захватывает металл
при выпуске, к ним относится глинозем, электролит, карбид алюминия, угольные частицы).Металлические примеси, переходящие из сырья (Fe, Si, Ti, Na, Ca, Cu, Zn и др.)
Газообразные примеси (в основном водород, появляющийся в результате электролиза воды)
Слайд 25
Хлорирование
(проводится в ковше продувкой газообразным хлором)
Для очистки
от механически захваченных примесей, растворенных газов, а также от
Na, Ca и Mg алюминий подвергают хлорированию.Хлор энергично реагирует с алюминием, образуя хлористый алюминий Al2O3.
Пары хлористого алюминия поднимаются через слой металла и вместе с ними всплывают взвешенные неметаллические примеси, часть газов и образующиеся хлориды Na, Ca, Mg и Н2. В результате продувки хлором удаляются также и газообразные примеси.
Слайд 26 Для рафинирования алюминия так же используют такие методы
как:
Электролитические методы (они более эффективны, чем хлор)
Дистилляция (перевод алюминия
в парообразное состояние с последующей конденсацией)Зонная плавка (перемещение расплавленной зоны вдоль твердого стержня алюминия; метод основан на различно растворимости разных элементов в твердой и жидкой фазах одного и того же материала)
Слайд 27
Сплавы на основе алюминия
В качестве конструкционного материала обычно
используют не чистый алюминий, а разные сплавы на его
основе:Алюминиево-магниевые Al-Mg
Алюминиево-марганцевые Al-Mn
Алюминиево-медные Al-Cu (Al-Cu-Mg, дюралюминий)
Сплавы системы Al-Zn-Mg (Al-Zn-Mg-Cu)
Алюминиево-кремниевые сплавы (силумины)
Слайд 28
Применение
Авиация и космонавтика
Транспорт
Пищевая промышленность
Ядерная энергетика
Электроника
Химическая промышленность
И многое другое
Слайд 30
Вопросы для самоконтроля:
Получение глинозема по методу Байера.
Получение металлического
алюминия.
Методы рафинирования алюминия.
Сущность метода “зонной плавки”.
Основные составляющие себестоимости
производства алюминия.Последовательность химических реакций, используемых для получения алюминия.
Физические свойства и области использования алюминия. Какой металл близок по свойствам алюминию.
Что такое криолит и для чего он используется.





























