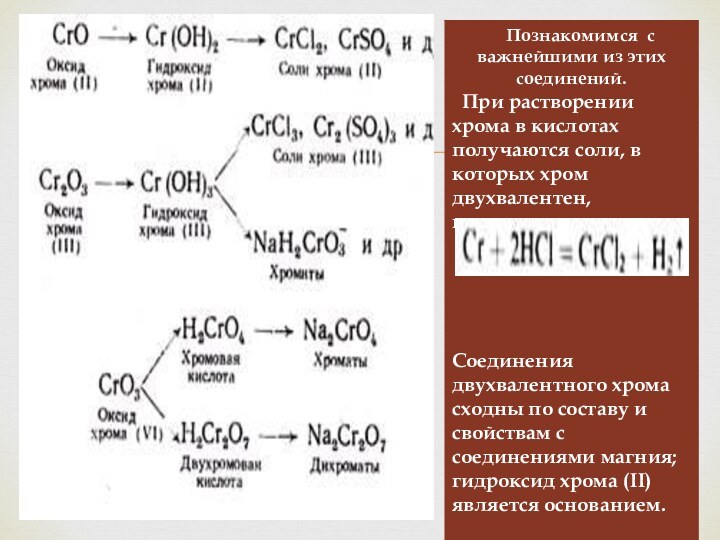
Слайд 2
Побочную подгруппу VI группы составляют следующие элементы —
хром Cr, молибден Мо и вольфрам W.
Cr 1s2|2s22p6|3s23p63d5|4s1
Mo…4d55s1 W …4f145d46s2
Проявляют максимальную степень окисления +6 и образуют оксиды типа RO3, кислоты - H2RO4. Сила кислот закономерно снижается от хрома к вольфраму. Большинство солей этих кислот в воде малорастворимы, хорошо растворяются только соли щелочных металлов и аммония.
По физическим и химическим свойствам молибден и вольфрам сходны между собой и несколько отличаются от хрома. Химическая активность металлов в ряду хром — молибден — вольфрам заметно понижается.
Общая характеристика.
Слайд 3
Элементы подгруппы хрома проявляют также степени окисления +5,
+4, +3, +2. Но наиболее типичны соединения высшей степени
окисления, которые во многом весьма похожи на соответствующие соединения серы. С водородом элементы подгруппы хрома соединений не образуют.
В обычных условиях весьма устойчивы к воздействию воздуха и воды. При нагревании взаимодействуют с кислородом, галогенами, азотом, фосфором, углем, кремнием и др. Известны их многочисленные сплавы с другими металлами. Сплавы и сами металлы — весьма ценные материалы современной техники.
Слайд 4
В 1766 году петербургский профессор химии И. Г.
Леман описал новый минерал, найденный на Урале. Обрабатывая камень
соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец.
Образец этого минерала был в конце XVIII века привезен Палласом в Париж. Им заинтересовался известный французский химик Л. Н. Воклен. В 1796 году он подверг минерал химическому анализу.
Один из друзей Воклена предложил ему назвать элемент хромом. Свое название хром получил от греческого слова «хрома» — краска за то, что все соединения хрома имеют яркие окраски.
Хром.
Слайд 5
Хром — серовато-белый блестящий металл по внешнему виду
похож на сталь. Из металлов он самый твердый, его
плотность 7,19 г/см3, т. пл. 1855 °С. Природный хром состоит из смеси пяти изотопов с массовыми числами 50, 52, 53, 54 и 56. Радиоактивные изотопы получены искусственно.
Хром обладает всеми характерными свойствами металлов — хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет присущий большинству металлов блеск. При температуре около 37°С многие его физические свойства резко, скачкообразно меняются.
Физические свойства.
Слайд 6
Химические свойства.
Как и у алюминия, на поверхности хрома
образуется оксидная пленка Сr2О3. Поэтому хром в разбавленных серной
и соляной кислотах начинает растворяться не сразу, а после растворения оксидной пленки. Хром растворяется в разбавленных кислотах, в концентрированных – пассивируется:
Cr + H2SO4 = CrSO4 + H2
С кислородом хром образует оксиды различного состава: CrO - оксид II хрома, твердое аморфное вещество красного цвета, получается восстановлением водородом при нагревании из оксида III хрома:
Cr2O3 + H2 = 2CrO + H2O
Слайд 7
Соединения Cr+2 неустойчивы и окисляются на воздухе:
4Cr(OH)2
+ O2 + 2H2O =
4Cr(OH)3
При высокой температуре хром горит в кислороде, образуя оксид Cr2О3. Раскаленный хром реагирует с парами воды:
4Cr + 3O2 = 2Cr2O3
2Cr + ЗН2О = Cr2О3 + ЗН2
Cr2O3 – аморфный порошок зеленого цвета, получается сжиганием хрома в кислороде, амфотерный оксид, которому соответствует амфотерный гидроксид Cr(OH)3,слабое, нерастворимое в воде основание, легко растворимо в кислотах и щелочах:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Слайд 8
Соединения хрома в степени окисления +3 самые устойчивые,
обладают окислительными и восстановительными свойствами:
Cr2(SO4)3 + Zn
= 2CrSO4 + ZnSO4 (окислитель)
2CrCl3 + 3KNO3 + 10KOH = 2K2CrO4 + 3KNO2 +
+ 6KCl + 5H2O (восстан.)
CrO3 – хромовый ангидрид, твердое вещество красно-бурого цвета,хорошо растворимое в воде. Получается при взаимодействии хромата калия с концентрированной серной кислотой:
K2CrO4 + H2SO4 = CrO3 + K2SO4 + H2O
Этому ангидриду соответствуют две кислоты,H2CrO4 – хромовая, соли носят название хроматы – желтого цвета и H2Cr2O7 – двуххромовая, соли бихроматы – оранжевого цвета. Хроматы и бихроматы сильнейшие окислители.
С возрастанием степени окисления основные свойства гидроксидов ослабляются, а кислотные усиливаются.
Слайд 9
Металлический хром при нагревании реагирует также с галогенами,
галогеноводородами, серой, азотом, фосфором, углем, кремнием и бором. Например:
Cr
+ 2HF=CrF2 + H2 2Cr + N2=2CrN
2Cr + 3S = Cr2S3 Cr + Si = CrSi
При одинаковых значениях степени окисления и близких значениях ионного радиуса химические свойства гидроксидов элементов оказываются сходными.
Это мы и наблюдаем на гидроксидах хрома, учитывая близость численных значений радиусов ионов Сr2 и Mg2 ; Сr3 и А13; Сr6 и S6*.
Слайд 11
Хром широко используется, как добавочный материал к металлам,
для получения высококачественной стали, подшипников и др. данный процесс
называется хромированием.
Хромиты широко используют в огнеупорной промышленности.
Химики используют хромиты для получения бихроматов калия и натрия, а также хромовых квасцов, которые применяются для дубления кожи, придающего ей красивый блеск и прочность. Такую кожу называют «хромом», а сапоги из нее «хромовыми».
Хром принимает деятельное участие в производстве красителей для стекольной, керамической, текстильной
промышленности.
Применение.
Слайд 12
Недавно оксид хрома приобрел еще одну интересную «специальность»:
в США изготовлена экспериментальная магнитофонная пленка, рабочий слой которой
содержит не частицы оксида железа, как обычно, а частицы оксида хрома. Замена оказалась удачной — качество звучания резко улучшилось, пленка стала надежнее в работе. Новинкой в первую очередь предполагается обеспечить блоки магнитной памяти электронно-вычислительных машин.
Научились наносить хромовую «броню» на изделия из пластмасс. Подвергнутый испытаниям широко известный полимер—полистирол, «одетый» в хром, стал прочнее, для него оказались менее страшными такие известные «враги» конструкционных материалов, как истирание, изгиб, удар. Само собой разумеется, возрос срок службы деталей.
Слайд 14
Вольфра́м —твёрдый серый переходный металл. Главное применение — как основа
тугоплавких материалов в металлургии. Самый тугоплавкий, при стандартных условиях
химически стоек.
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена». Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
В 1781 знаменитый шведский химик Шееле , обрабатывая азотной кислотой минерал шеелит, получил желтый «тяжелый камень».
Вольфрам.
Слайд 15
Вольфрам — светло-серый металл, имеющий самые высокие доказанные
температуры плавления и кипения.
Физические свойства.
Слайд 16
Процесс получения вольфрама проходит через подстадию выделения триоксида
WO3 из рудных концентратов и последующем восстановлении до металлического
порошка водородом при температуре около 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток.
WO3 + 3H2 = W + 3H2O
Получение.
Слайд 17
Кларк вольфрама земной коры составляет (по Виноградову) 1,3
г/т. Его среднее содержание в горных породах, г/т: ультраосновных —
0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4).
Нахождение в природе.
Слайд 18
Наиболее характерная степень окисления +6. Менее активен чем
хром, все реакции идут медленно, легко образуется при нагревании
только карбид (WC2).
В кислотах вольфрам почти нерастворим, кроме смеси азотной и плавиковой кислот.
W + 2HNO3 + 6HF = WF6 + 2NO + 4H2O
При прокаливании в кислороде W или его соединений образуется WO3. Это твердые вещества, плохо растворимые в воде, но легко растворимы в щелочах с образованием солей молибденовой и вольфрамовой кислот (H2MoO4 – белого цвета, H2WO4 – желтого цвета). Данные кислоты - твердые вещества, при нагревании отщепляют воду и переходят в соответствующие оксиды.
2W + 3O2 = 2WO3
Химические свойства.
Слайд 19
При взаимодействии оксида вольфрама с металлическим натрием образуется
нестехиометрический вольфрамат натрия, носящий название «вольфрамовая бронза»:
WO3 + xNa = NaxWO3
Высший хлорид вольфрама WCl6 образуется при взаимодействии оксида вольфрама с хлором или тетрахлоридом углерода. Он отличается от других соединений вольфрама низкой температурой кипения (347° С). По своей химической природе хлорид является хлорангидридом вольфрамовой кислоты, поэтому при взаимодействии с водой образуются неполные хлорангидриды, при взаимодействии со щелочами – соли. В результате восстановления хлорида вольфрама алюминием в присутствии монооксида углерода образуется карбонил вольфрама:
WCl6 + 2Al + 6CO = [W(CO)6] + 2AlCl3 (в эфире)
Слайд 20
Металлический вольфрам:
Тугоплавкость и пластичность вольфрама делают его
незаменимым для нитей накаливания в осветительных приборах, в кинескопах
и других вакуумных трубках.
Благодаря высокой плотности вольфрам используется для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет.
Сплавы вольфрама, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты, танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
Применение.
Слайд 21
4. Вольфрам используют в качестве электродов для аргоно-дуговой
сварки.
5. Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в
качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Соединения вольфрама:
Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама. Широко используется в качестве легирующего элемента в сталях и сплавах на основе железа.
Слайд 22
2. Сульфид вольфрама WS2 применяется как высокотемпературная (до
500 °C) смазка.
3. Трехокись вольфрама применяется для производства твердого
электролита высокотемпературных топливных элементов.
4.Соединения вольфрама применяются как катализаторы и пигменты.
5. Монокристаллы вольфраматов используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
6. Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
7. Оксид вольфрама(VI) полупродукт в производстве вольфрама и его соединений. Является компонентом некоторых промышленно важных катализаторов гидрирования и пигментов для керамики.
Слайд 23
Молибден.
Молибден — (лат.Molybdenum), ковкий переходный металл серебристо-белого цвета.
Главное применение находит в метеллургии.
Открыт в 1778 году шведским
химиком Карлом Шееле, который прокаливая молибденовую кислоту, получил оксид МоО3. В металлическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида углём: он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус.
Название происходит от греч. μολνβδος, означающего «свинец». Оно дано из-за внешнего сходства молибденита (MoS2), минерала из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS). Вплоть до XVIII в. молибденит не отличали от графита и свинцового блеска, эти минералы носили общее название «молибден».
Слайд 25
Промышленное получение молибдена начинается с обогащения руд флотационным
методом. Полученный концентрат обжигают до образования оксида МоО3:
2MoS2 + 7O2 → 2MoO3 + 4SO2,
который подвергают дополнительной очистке. Далее МоО3 восстанавливают водородом:
MoO3 + 3H2 → Mo + 3H2O
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Получение.
Слайд 26
Содержание в земной коре 3·10−4% по массе. В
свободном виде молибден не встречается. Концентрация молибдена в породах
повышается по мере увеличения SiO2. Молибден находится также в морской и речной воде, в золе растений, в углях и нефти. Содержание молибдена в морской воде колеблется от 8,9 до 12,2 мкг/л. Основная масса Мо заключена в полевых шпатах и меньше в кварце. Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной. Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит. В поверхностных условиях образуются преимущественно кислородные соединения Мо6+.
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит СаМоО4 (48 % Мо), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
Нахождение в природе.
Слайд 27
Наиболее характерная степень окисления +6. Менее активен чем
хром, все реакции идут медленно, легко образуется при нагревании
только карбид (MoC).
Mo + C = MoC
Молибден взаимодействует с концентрированной серной кислотой при нагревании:
Mo + 3H2SO4 = H2MoO7 + 3SO2 + 2H2O
С серой образуются сульфиды состава MeS3 в виде порошков коричневого или черного цвета. При нагревании на воздухе они окисляются до MeO3, при прокаливании без кислорода отщепляют серу и переходят в сульфиды состава MeS2.
Mo + S = MoS3
Химические свойства.
Слайд 28
При прокаливании в кислороде металл или его
соединения образуется оксид MoO3 , это твердое вещество, плохо
растворимое в воде, но легко растворимое в щелочах с образованием солей молибденовой кислоты (H2MoO4 – белого цвета). Данная кислота - твердые вещество, при нагревании отщепляет воду и переходит в соответствующие оксиды.
2Mo + 3O2 = 2MoO3
При взаимодействии с фтором образуется гексафторид молибдена (MoF6), легко летучая жидкость, при взаимодействии с водой образуюе оксосоединение типа МеOF4, MeO2F2.
Слайд 29
Молибден используется для легирование сталей, как компонент жаропрочных
и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления
высокотемпературных печей, вводов электрического тока в лампочках. Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений.
Молибден-99 используется для получения технеция-99, который используется в медицине при диагностике онкологических и некоторых других заболеваний.
Применение.
Слайд 30
Чистый монокристаллический молибден используется для производства зеркал
для мощных газодинамических лазеров. Теллурид Мо является хорошим термоэлектрическим
материалом для производства термоэлектрогенераторов. Молибденовый ангидрид широко применяется в качестве положительного электрода в литиевых источниках тока.
Дисилицид молибдена применяется в качестве нагревателей в печах с окислительной атмосферой, работающих до 1800 °С.
Слайд 31
Биологическая роль.
Физиологическое значение молибдена для организма животных
и человека было впервые показано в 1953 г, с
открытием влияния этого элемента на активность фермента ксантиноксидазы. Молибден делает более эффективной работу антиокислителей, в том числе витамина С. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Молибден входит в состав ряда ферментов, выполняющих важные физиологические функции. Молибденоэнзимы катализируют гидроксилирование различных субстратов. Альдегидоксидаза окисляет и нейтрализует различные пиримидины, пурины, птеридины.
При недостатке молибдена страдают анаболические процессы, наблюдается ослабление иммунной системы. Тиомолибдат аммония (растворимая соль молибдена), является антагонистом меди и нарушает ее утилизацию в организме.