Слайд 2
У ферментов, имеющих в своем составе несколько мономеров,
может быть несколько активных центров по числу субъединиц. Также
две и более субъединицы могут формировать один активный центр.
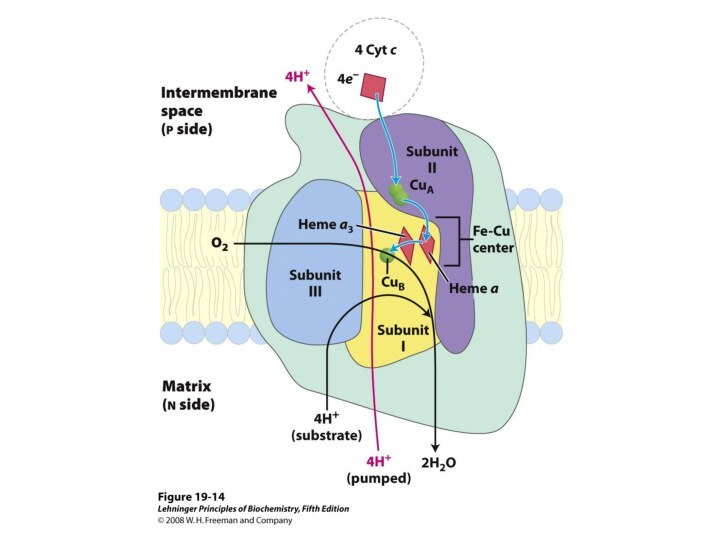
Существуют трансмембранные ферменты, катализирующие сопряженные реакции на противоположных сторонах мембраны. Типичные ферменты этого класса имеют несколько активных центров. Характерными примерами могут служить окислительно-восстановительные ферменты, например фотосинтетические реакционные центры растений и бактерий или цитохром с-оксидаза митохондрий. Расположенные на противоположных сторонах мембраны активные центры этих ферментов сопряжены друг с другом с помощью потока электронов, генерирующего трансмембранный электрический потенциал.
Слайд 5
Множественные формы ферментов можно разделить на две категории:
1.
Изоферменты
2. Собственно множественные формы (истинные)
Слайд 6
Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие
одну и ту же реакцию, но отличающиеся друг от
друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам.
Слайд 7
Виды изоферментов:
Органные — например, ферменты гликолиза в
печени и мышцах.
Клеточные — например, малатдегидрогеназа цитоплазматическая и
митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются разными аллелями одного и того же гена.
Слайд 8
Изоферменты часто являются органоспецифичными, так как в каждой
ткани содержится преимущественно один тип изоферментов. Следовательно, при повреждении
органа в крови появляется соответствующая форма изофермента. Обнаружение определенных изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
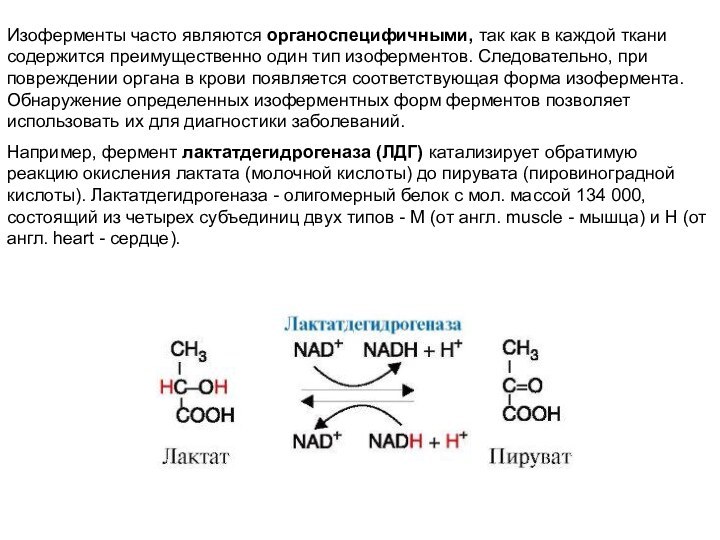
Например, фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты). Лактатдегидрогеназа - олигомерный белок с мол. массой 134 000, состоящий из четырех субъединиц двух типов - М (от англ. muscle - мышца) и Н (от англ. heart - сердце).
Слайд 9
Комбинация этих субъединиц лежит в основе формирования пяти
изоформ лактатдегидрогеназы (рис. А, см. след. слайд). ЛДГ1 и
ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются другие варианты этого фермента. Изоформы ЛДГ различаются друг от друга электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. Б). Для диагностики заболеваний сердца печени и мышц необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифических изоформ ЛДГ широко используется в качестве диагностического теста.
Слайд 10
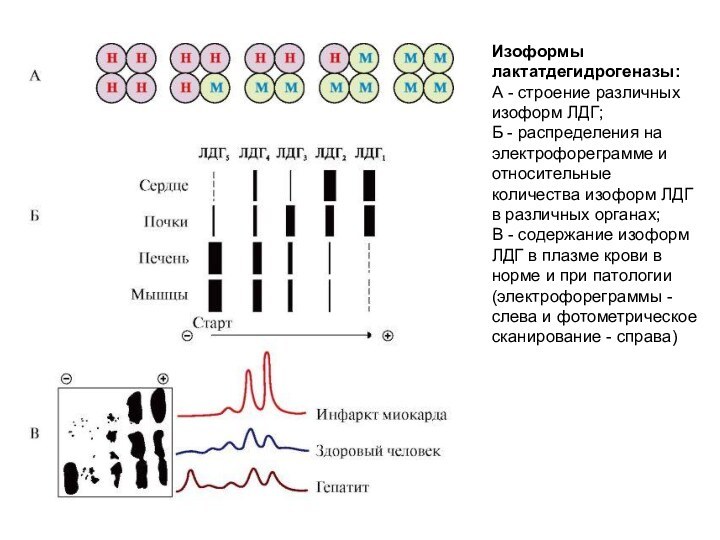
Изоформы лактатдегидрогеназы:
А - строение различных изоформ ЛДГ;
Б
- распределения на электрофореграмме и относительные количества изоформ ЛДГ
в различных органах;
В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа)
Слайд 11
Собственно множественные формы (истинные) — это ферменты, синтез
которых кодируется одним и тем же аллелем одного и
того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации, становятся разными, хотя и катализируют одну и ту же реакцию. Эти ферменты обладают свойствами изоферментов, но образуются в результате посттрансляционных модификаций. Последние могут осуществляться, например, в результате гликозилирования, фосфорилирования, аденилирования, амидирования и деамидирования остатков глутаминовой и аспарагиновой кислот пептидной цепи, а также путем частичного протеолиза последней с образованием более низкомолекулярных продуктов. В модификации пептидных цепей участвуют специфические ферменты - аденилилтрансфераза, гликозилтрансферазы, протеазы, фосфокиназы и др.
Слайд 12
Итак, термин «множественные формы фермента» применим к белкам,
катализирующим одну и ту же реакцию и встречающимся в
природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности).
Слайд 14
Название ферментам в течение долгого времени давали путем
добавления окончания -аза к названию субстрата, который участвует в
данной ферментативной реакции. Так, ферменты, гидролизующие белки, были названы протеазами, а ферменты, гидролизующие жиры, - липазами. Однако в употреблении сохранился ряд тривиальных, исторически закрепленных названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения (например трипсин, пепсин, ренин, тромбин и др.).
Слайд 15
Для того чтобы систематизировать имеющиеся в природе ферменты,
Международный союз биохимии и молекулярной биологии (IUBMB) в 1961
г. разработал номенклатуру, согласно которой все ферменты делятся на шесть основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов, в зависимости от преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из шести классов имеет свой порядковый номер, строго закрепленный за ним: 1-й класс - оксидоредуктазы; 2-й класс - трансферазы; 3-й класс - гидролазы; 4-й класс - лиазы; 5-й класс - изомеразы; 6-й класс - лигазы.
Слайд 16
Эта классификация необходима для точного определения фермента: для
каждого фермента имеется кодовое число. Например, фермент маладегидрогеназа имеет
систематическое название L-малат: NAD-оксидоредуктаза и кодовое число - 1.1.1.38. Первая цифра означает номер класса ферментов (в данном случае цифра 1 свидетельствует, что фермент относится к классу оксидоредуктаз); вторая цифра указывает на тип катализируемой реакции (в данном примере окислению подвергается гидроксильная группа); третья цифра означает наличие кофермента (в данном случае - кофермент NAD+), последняя цифра - это порядковый номер фермента в данной подгруппе.
Слайд 17
1. Оксидоредуктазы катализируют различные окислительно-восстановительные реакции, характеризующиеся переносом
электронов и протонов. Класс делится на подклассы:
а) дегидрогеназы катализируют
реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа, изоцитратдегидрогеназа, сукцинатдегидрогеназа, α-кетобутиратдегидрогеназа и др.;
Слайд 18
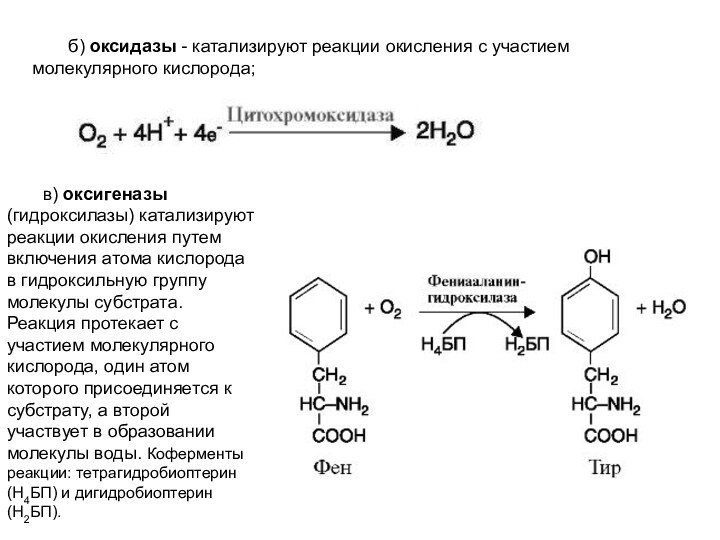
б) оксидазы - катализируют реакции окисления с участием
молекулярного кислорода;
в) оксигеназы (гидроксилазы) катализируют реакции окисления путем
включения атома кислорода в гидроксильную группу молекулы субстрата. Реакция протекает с участием молекулярного кислорода, один атом которого присоединяется к субстрату, а второй участвует в образовании молекулы воды. Коферменты реакции: тетрагидробиоптерин (Н4БП) и дигидробиоптерин (Н2БП).
Слайд 19
2. Трансферазы - катализируют реакции переноса функциональных групп.
В зависимости от переносимой группы подразделяются на подклассы: аминотрансферазы
(рис. 1), ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы) (рис. 2).
Рис. 1. Реакция, катализируемая ферментом АЛТ (Аланин-α-кетоглутаратаминотрансфераза), относящимся к классу трансфераз, подклассу аминотрансфераз. ПФ - кофермент пиридоксальфосфат.
Рис. 2. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз. АТФ является донором остатка фосфорной кислоты.
Слайд 20
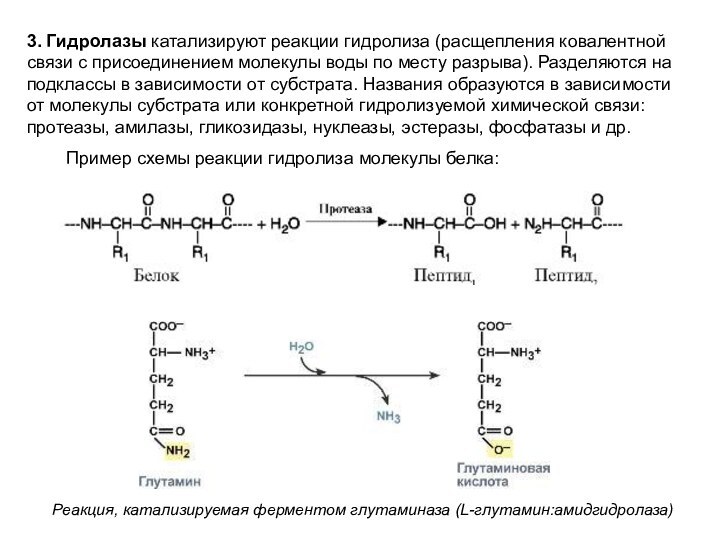
3. Гидролазы катализируют реакции гидролиза (расщепления ковалентной связи
с присоединением молекулы воды по месту разрыва). Разделяются на
подклассы в зависимости от субстрата. Названия образуются в зависимости от молекулы субстрата или конкретной гидролизуемой химической связи: протеазы, амилазы, гликозидазы, нуклеазы, эстеразы, фосфатазы и др.
Пример схемы реакции гидролиза молекулы белка:
Реакция, катализируемая ферментом глутаминаза (L-глутамин:амидгидролаза)
Слайд 21
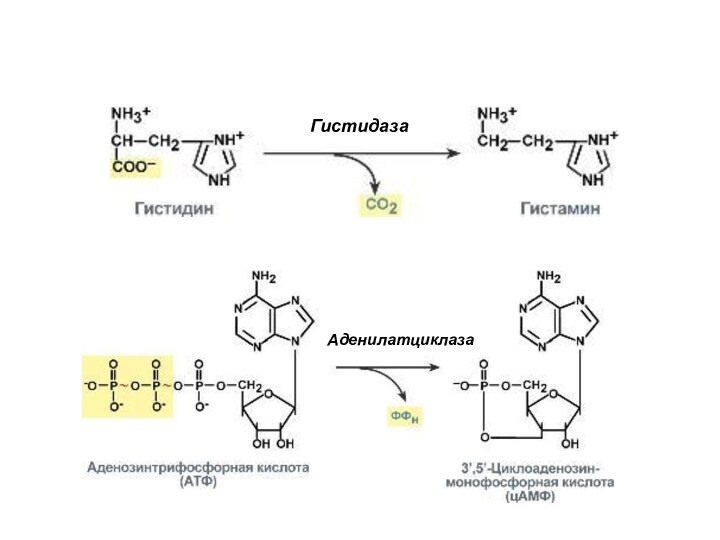
4. Лиазы - ферменты, отщепляющие от субстратов негидролитическим
путем определенные группы (при этом могут отщепляться СО2, Н2О,
NH2, SH2 и др.), т.е. катализирующие разрыв С-О, С-С, C-N и других связей, или присоединяющие чаще всего молекулу воды по двойной связи. То есть эти реакции могут сопровождаются образованием двойной связи или присоединением групп к месту двойной связи.
Примеры: реакция декарбоксилирования (отщепления молекулы CO2) и реакция присоединения молекулы воды (гидратазная реакция).
Слайд 23
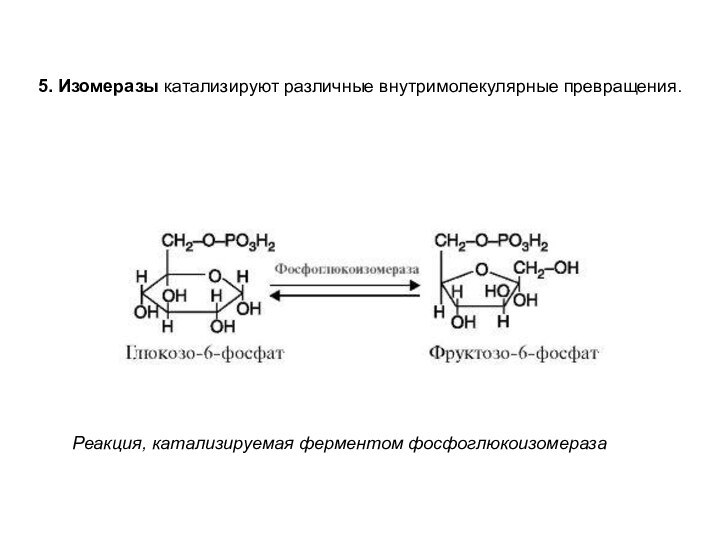
5. Изомеразы катализируют различные внутримолекулярные превращения.
Реакция, катализируемая ферментом
фосфоглюкоизомераза
Слайд 24
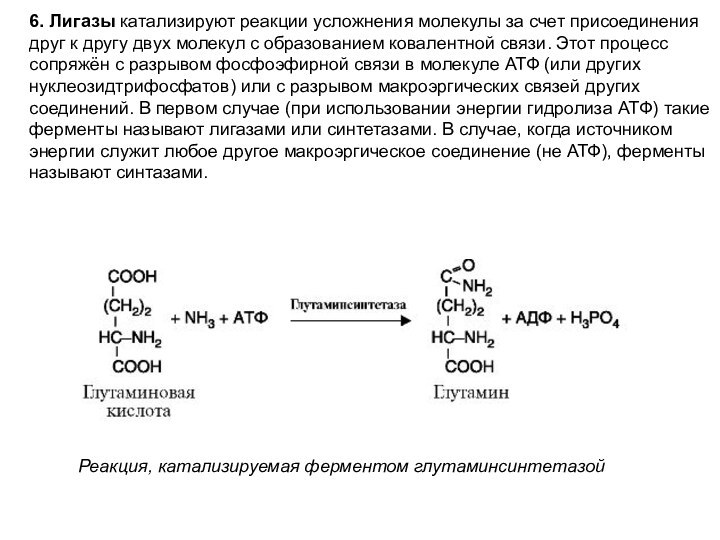
6. Лигазы катализируют реакции усложнения молекулы за счет
присоединения друг к другу двух молекул с образованием ковалентной
связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют лигазами или синтетазами. В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами.
Реакция, катализируемая ферментом глутаминсинтетазой
Слайд 26
Одним из важнейших свойств живых организмов является способность
к поддержанию гомеостаза. Гомеостаз в организме поддерживается за счет
регуляции скорости ферментативных реакций. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления). Регуляция скорости ферментативных реакций осуществляется на трех независимых уровнях:
I. Изменением количества молекул фермента;
II. Доступностью молекул субстрата и кофермента;
III. Изменением каталитической активности молекул фермента.
Слайд 27
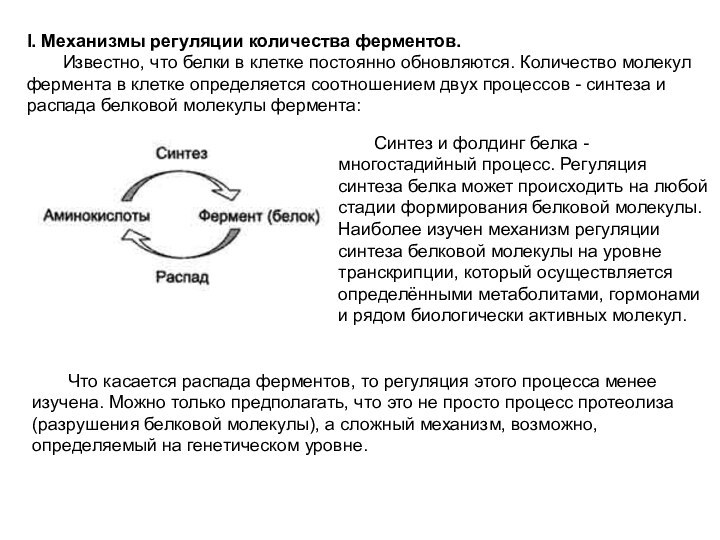
I. Механизмы регуляции количества ферментов.
Известно, что белки
в клетке постоянно обновляются. Количество молекул фермента в клетке
определяется соотношением двух процессов - синтеза и распада белковой молекулы фермента:
Синтез и фолдинг белка - многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы. Наиболее изучен механизм регуляции синтеза белковой молекулы на уровне транскрипции, который осуществляется определёнными метаболитами, гормонами и рядом биологически активных молекул.
Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне.
Слайд 28
II. Доступность молекул субстратов обеспечивается контролируемой работой трансмембранных
транспортных систем. Доступность коферментов зависит от скорости их регенерации.
Чем больше концентрация исходного субстрата и регенерированных коферментов, тем выше скорость метаболического пути.
Путь регуляции ферментативных реакций через изменение количества фермента является путем длительной адаптации метаболических процессов в организме, требует для своего осуществления часы и дни и включения генетического аппарата (медленный процесс).
Пути регуляции ферментативных реакций через доступность молекул субстрата и кофермента и изменение активности фермента является очень быстрым и для изменения активности фермента требуются секунды или минуты.
Слайд 29
III. Регуляция каталитической активности ферментов. Бывает:
1). Неспецифическая регуляция.
В связи с лабильностью всех ферментов, на их каталитическую
активность неспецифически оказывают влияние температура, рН, давление.
2). Специфическая регуляция. Под действием специфических активаторов и ингибиторов изменяется активность регуляторных ферментов, которые контролируют интенсивность метаболических процессов в организме.
Слайд 30
Механизмы специфической регуляции каталитической активности ферментов.
К основным
способам регуляции каталитической активности молекул ферментов относят:
1). Влияние на
активность фермента различного рода ингибиторов, а также аллостерическую регуляцию;
2). Регуляцию с помощью белок-белковых взаимодействий;
3). Регуляцию путем присоединения или отщепления различных функциональных групп (например: фосфорилирования/дефосфорилирования молекулы фермента);
4). Регуляцию частичным протеолизом.
Два последних способа относится к ковалентной модификация фермента. Регуляция происходит в результате или ковалентного присоединения фрагмента к ферменту или отщепления фрагмента от фермента.
Слайд 31
ИНГИБИТОРЫ ФЕРМЕНТОВ
Под термином «ингибирование активности ферментов» понимают
специфическое снижение каталитической активности, вызванное определенными химическими веществами -
ингибиторами.
Ингибиторы способны связываться с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определенных условиях легко отделяются от фермента:
Е + I ↔ EI .
Необратимое ингибирование наблюдается в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента:
Е + I → E-I .
При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Слайд 32
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с
гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин
в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию (концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса). Аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман) и инсектициды (карбофос, дихлофос).
Слайд 33
По типу воздействия на зависимость ферментативной реакции от
концентрации субстрата обратимые ингибиторы делятся на конкурентные, неконкурентные, безконкурентные
и смешанные.
Слайд 34
Конкурентные ингибиторы являются структурными аналогами субстрата и связываются
в активном центре фермента, конкурируя с субстратом за место
связывания. Они вызывают увеличение (ухудшение) константы Михаэлиса, но не влияют на максимальную скорость реакции:
Слайд 35
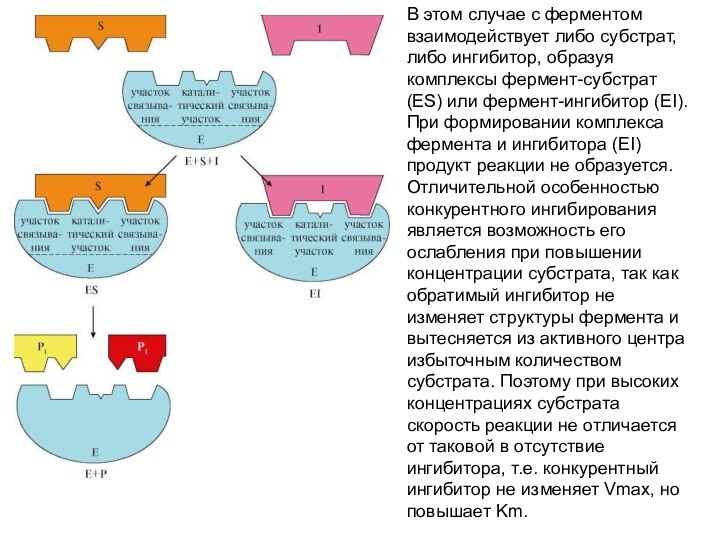
В этом случае с ферментом взаимодействует либо субстрат,
либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI).
При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Отличительной особенностью конкурентного ингибирования является возможность его ослабления при повышении концентрации субстрата, так как обратимый ингибитор не изменяет структуры фермента и вытесняется из активного центра избыточным количеством субстрата. Поэтому при высоких концентрациях субстрата скорость реакции не отличается от таковой в отсутствие ингибитора, т.е. конкурентный ингибитор не изменяет Vmax, но повышает Km.
Слайд 36
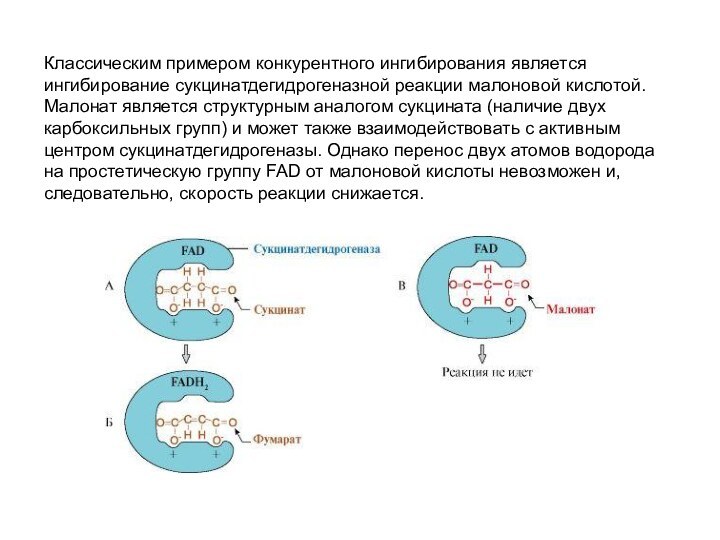
Классическим примером конкурентного ингибирования является ингибирование сукцинатдегидрогеназной реакции
малоновой кислотой. Малонат является структурным аналогом сукцината (наличие двух
карбоксильных групп) и может также взаимодействовать с активным центром сукцинатдегидрогеназы. Однако перенос двух атомов водорода на простетическую группу FAD от малоновой кислоты невозможен и, следовательно, скорость реакции снижается.
Слайд 37
Неконкурентное ингибирование наблюдается, если ингибитор связывается вне активного
центра. Ингибитор реагирует с функционально важной группой фермента, не
препятствуя связыванию субстрата. В этом случае Km остается неизменной, напротив уменьшается концентрация функционально активного фермента и, следовательно, максимальная скорость реакции V.
Слайд 38
Бесконкурентное ингибирование - ингибитор связывается только с фермент-субстратным
комплексом, но не со свободным ферментом, изменяя его конформацию,
что затрудняет катализ. Максимальная скорость реакции и константа Михаэлиса уменьшаются в одинаковое количество раз и на графике в двойных обратных координатах наблюдаются параллельные прямые.
Слайд 39
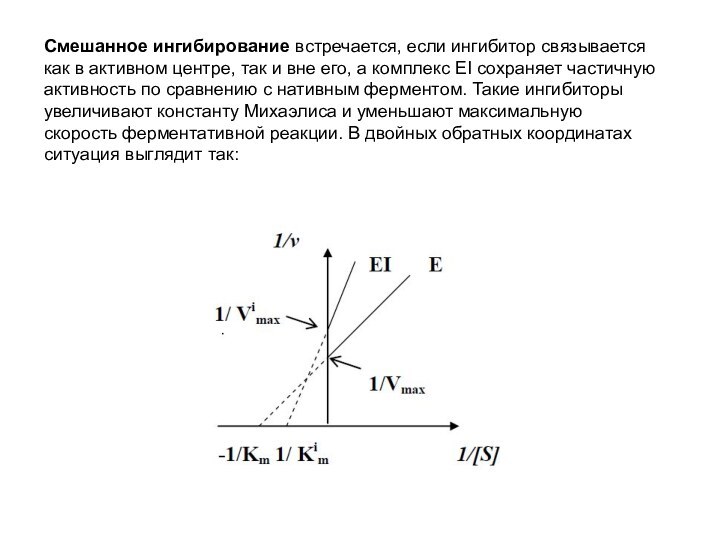
Смешанное ингибирование встречается, если ингибитор связывается как в
активном центре, так и вне его, а комплекс ЕI
сохраняет частичную активность по сравнению с нативным ферментом. Такие ингибиторы увеличивают константу Михаэлиса и уменьшают максимальную скорость ферментативной реакции. В двойных обратных координатах ситуация выглядит так:
Слайд 41
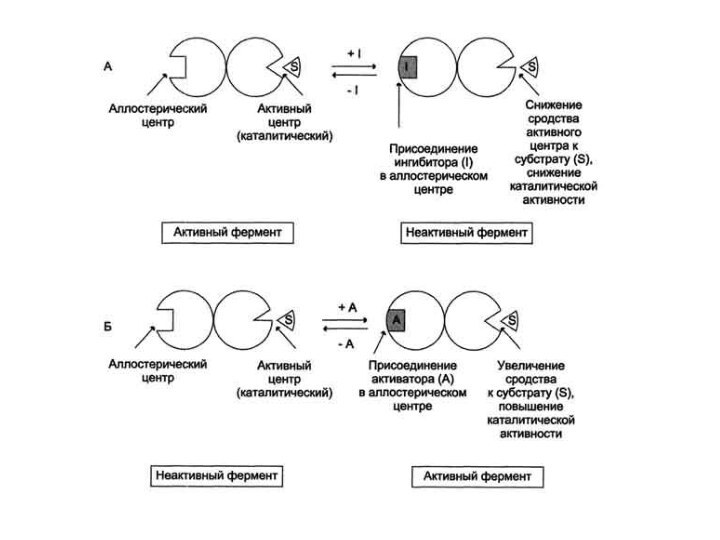
Аллостерическая регуляция
Ферменты, имеющие такой механизм регуляции, являются,
как правило, олигомерными белками. Они состоят из нескольких (не
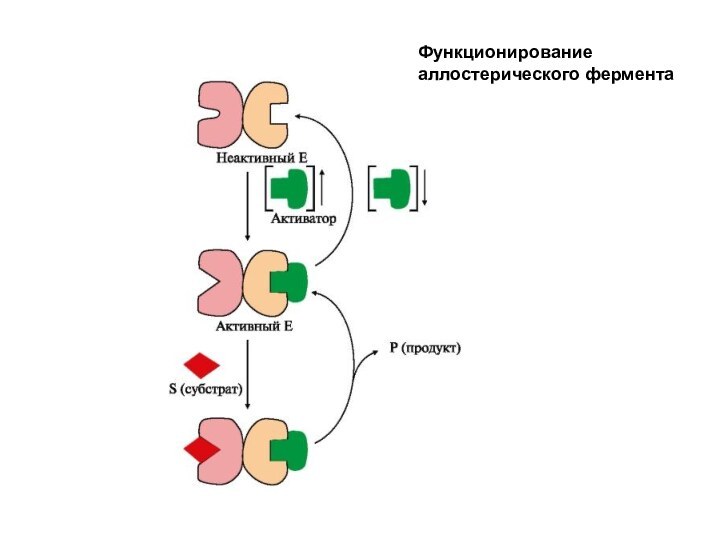
менее 2) субъединиц, имеют активный и аллостерический центры, которые находятся на разных субъединицах. Присоединение эффектора (модулятора) в аллостерический центр вызывает кооперативные конформационные изменения всех протомеров (alios — иной, другой; stereos — форма). Конформационные перестройки в активном центре фермента повышают или понижают его сродство к субстрату. Эффектор, который вызывает снижение (ингибирование) активности фермента, называется ингибитором. Эффектор, который вызывает повышение (активацию) активности ферментов, называют активатором.
Слайд 42
Функционирование аллостерического фермента
Слайд 43
Аллостерические ферменты имеют определенные особенности строения:
- обычно являются олигомерными
белками, состоящими из нескольких протомеров;
- имеют аллостерический центр, пространственно удаленный
от каталитического активного центра;
- эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах.
Аллостерические центры, так же как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
Протомер, на котором находится аллостерический центр, называется регуляторным протомером в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция.
Слайд 44
Аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора
с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц,
приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или повышает каталитическую активность фермента. Если к аллостерическому центру присоединяется ингибитор, то в результате кооперативных конформационных изменений происходит изменение конформации активного центра, что вызывает снижение сродства фермента к субстрату и, соответственно, снижение скорости ферментативной реакции. И наоборот, если к аллостерическому центру присоединяется активатор, то сродство фермента к субстрату увеличивается, что вызывает повышение скорости реакции. Регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента.
Слайд 46
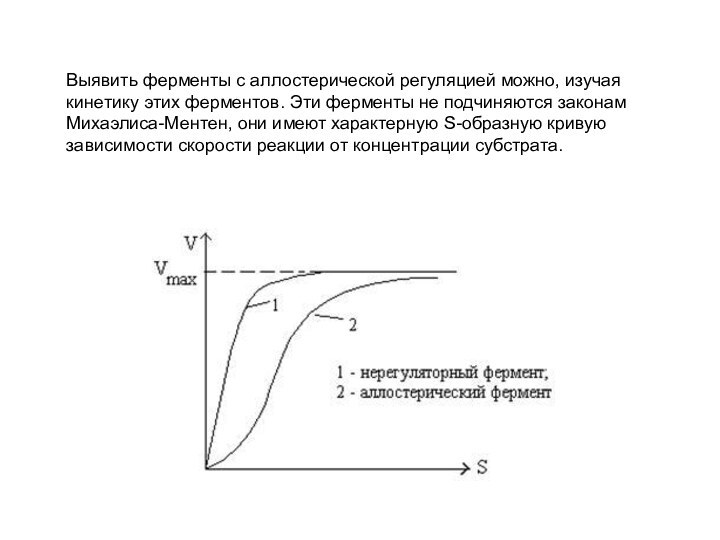
Выявить ферменты с аллостерической регуляцией можно, изучая кинетику
этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они
имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
Слайд 47
Аллостерические ферменты, как правило, регулируют скорость метаболических путей,
которые представляют собой последовательность взаимосвязанных реакций, катализируемых разными ферментами:
Вещество
S превращается в продукт Р в результате 4 последовательных ферментативных реакций. Продукт одной реакции служит субстратом следующей. Первая реакция данного метаболического пути является необратимой.
Слайд 49
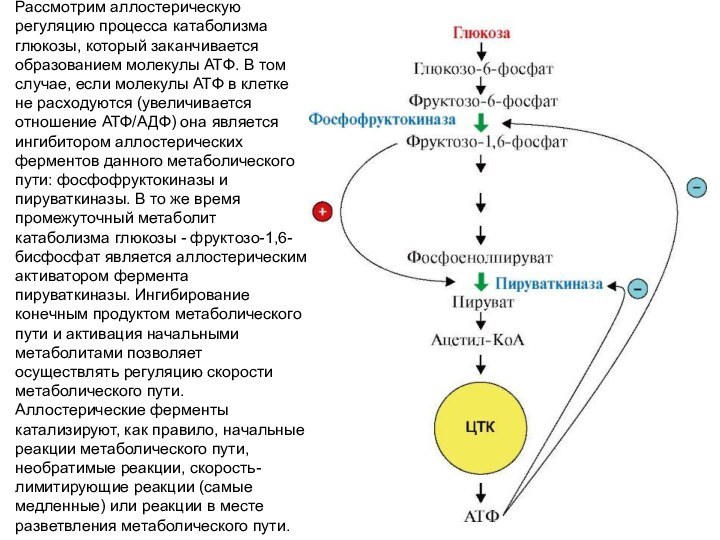
Рассмотрим аллостерическую регуляцию процесса катаболизма глюкозы, который заканчивается
образованием молекулы АТФ. В том случае, если молекулы АТФ
в клетке не расходуются (увеличивается отношение АТФ/АДФ) она является ингибитором аллостерических ферментов данного метаболического пути: фосфофруктокиназы и пируваткиназы. В то же время промежуточный метаболит катаболизма глюкозы - фруктозо-1,6-бисфосфат является аллостерическим активатором фермента пируваткиназы. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяет осуществлять регуляцию скорости метаболического пути. Аллостерические ферменты катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте разветвления метаболического пути.
Слайд 50
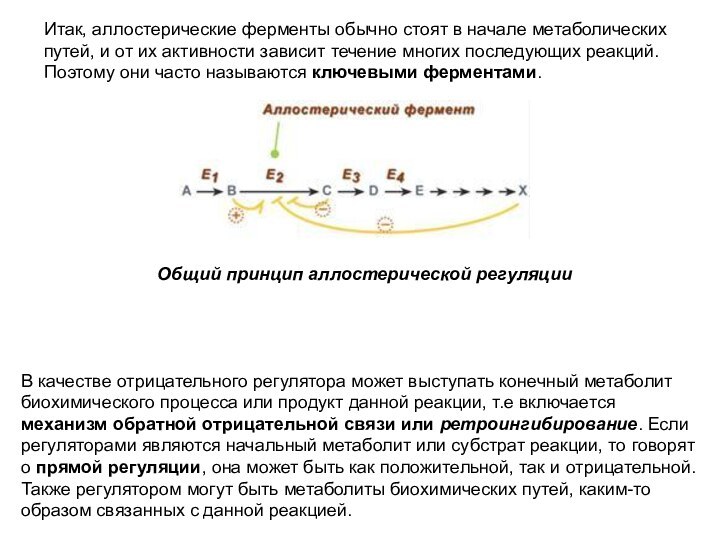
Итак, аллостерические ферменты обычно стоят в начале метаболических
путей, и от их активности зависит течение многих последующих
реакций. Поэтому они часто называются ключевыми ферментами.
В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи или ретроингибирование. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким-то образом связанных с данной реакцией.
Общий принцип аллостерической регуляции
Слайд 51
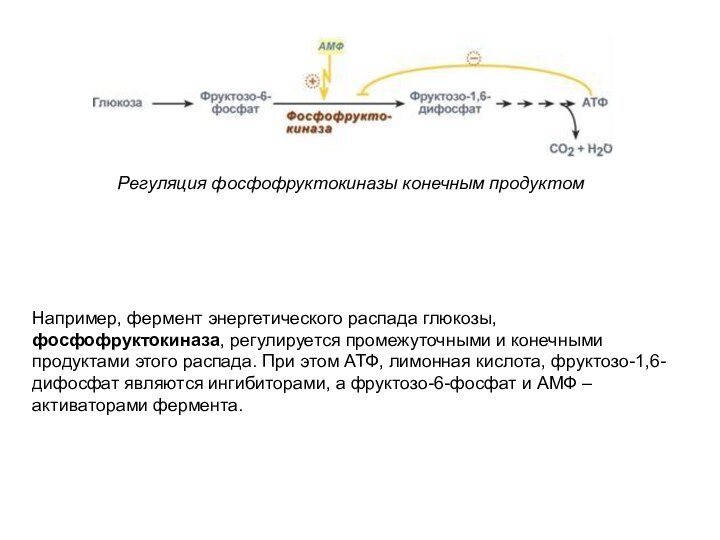
Регуляция фосфофруктокиназы конечным продуктом
Например, фермент энергетического распада глюкозы,
фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При
этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента.
Слайд 52
Регуляция с помощью белок-белковых взаимодействий
Некоторые ферменты изменяют свою
активность в результате белок-белковых взаимодействий. Можно выделить по крайней
мере два механизма изменения активности фермента таким способом: активация ферментов в результате присоединения белков-активаторов (например, аденилатциклаза (Ац), которая катализирует превращение цАМФ из АТФ, активируется присоединением α-субъединицы G-белка. Этот механизм регуляции обратим) и изменение каталитической активности в результате ассоциации и диссоциации протомеров.
Слайд 53
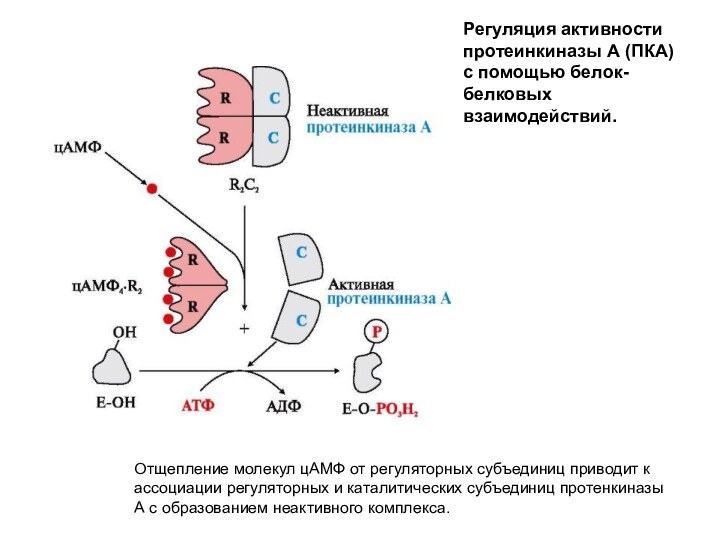
В качестве примера регуляции каталитической активности ферментов ассоциацией
или диссоциацией протомеров можно рассмотреть регуляцию фермента протеинкиназы А.
Протеинкиназа
А (цАМФ-зависимая) состоит из четырех субъединиц двух типов: двух регуляторных (R) и двух каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ) (по два на каждую субъединицу). Присоединение четырех молекул цАМФ к двум регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса; при этом высвобождаются две активные каталитические субъединицы. Активная протеинкиназа А катализирует перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (т.е. вызывает фосфорилирование белков).
Слайд 54
Отщепление молекул цАМФ от регуляторных субъединиц приводит к
ассоциации регуляторных и каталитических субъединиц протенкиназы А с образованием
неактивного комплекса.
Регуляция активности протеинкиназы А (ПКА) с помощью белок-белковых взаимодействий.
Слайд 55
Регуляция каталитической активности ферментов путем фосфорилирования-дефосфорилирования
В биологических системах
часто встречается механизм регуляции активности ферментов с помощью их
ковалентной модификации. Быстрым и широко распространенным способом химической модификации ферментов является их фосфорилирование-дефосфорилирование.
Фосфорилированию подвергаются ОН-группы фермента, которое осуществляется ферментами протеинкиназами (фосфорилирование) и фосфопротеинфосфатазами (дефосфорилирование). Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро варьировать активность ключевых ферментов метаболических путей в зависимости от условий внешней среды.
Слайд 56
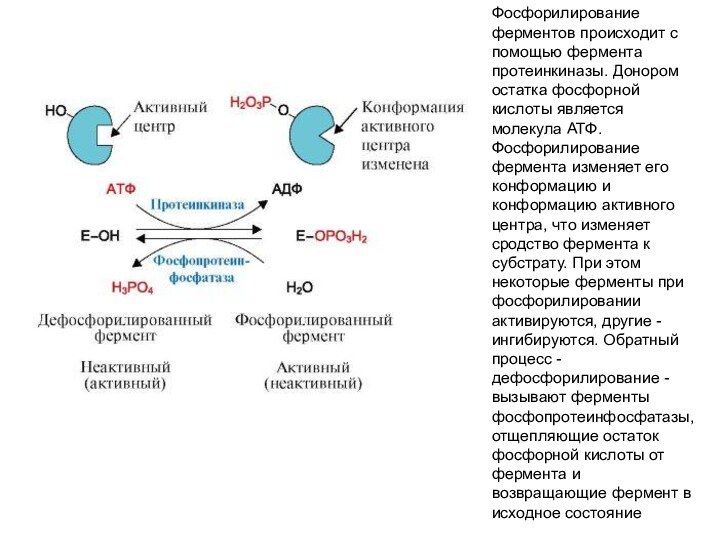
Фосфорилирование ферментов происходит с помощью фермента протеинкиназы. Донором
остатка фосфорной кислоты является молекула АТФ. Фосфорилирование фермента изменяет
его конформацию и конформацию активного центра, что изменяет сродство фермента к субстрату. При этом некоторые ферменты при фосфорилировании активируются, другие - ингибируются. Обратный процесс - дефосфорилирование - вызывают ферменты фосфопротеинфосфатазы, отщепляющие остаток фосфорной кислоты от фермента и возвращающие фермент в исходное состояние
Слайд 57
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты,
которые функционируют вне клеток (в желудочно-кишечном тракте или плазме
крови), синтезируются в виде неактивных предшественников (проферментов) и активируются только в результате гидролиза одной или нескольких определенных пептидных связей, который приводит к отщеплению части молекулы. В оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента. Частичный протеолиз представляет собой пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации пищеварительных протеолитических ферментов (пепсин, трипсин, химотрипсин, эластаза), пептидных гормонов (инсулин), белков свертывающей системы крови и ряда других белков.
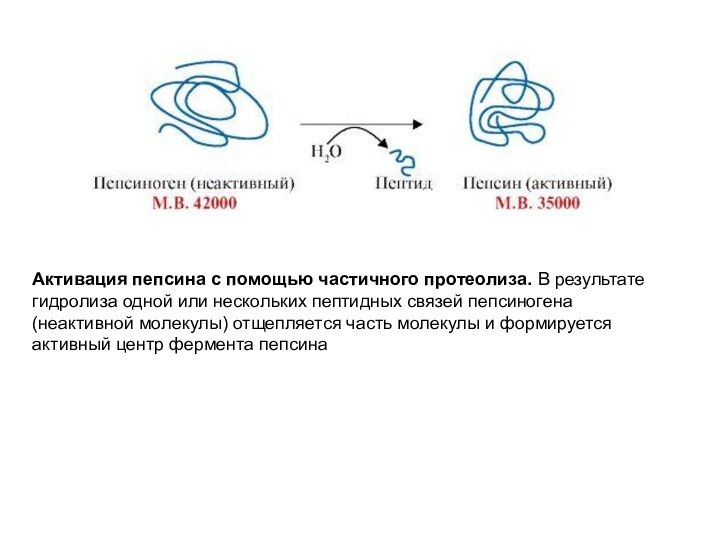
Слайд 58
Активация пепсина с помощью частичного протеолиза. В результате
гидролиза одной или нескольких пептидных связей пепсиногена (неактивной молекулы)
отщепляется часть молекулы и формируется активный центр фермента пепсина