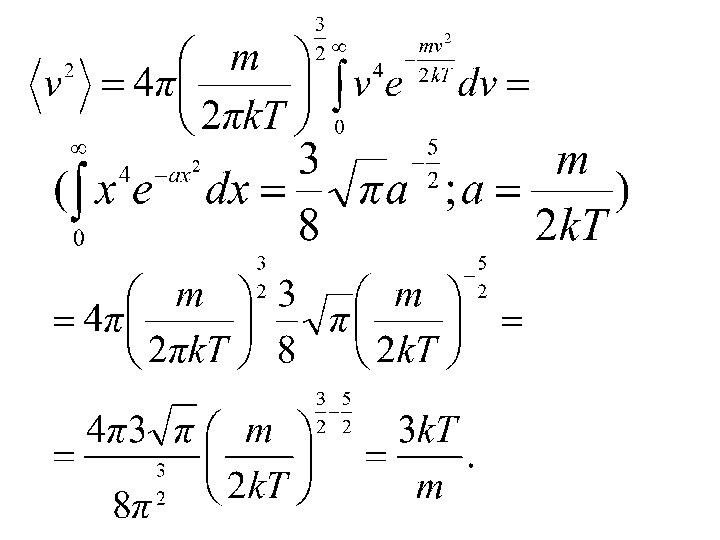Слайд 2
Эргодическая гипотеза: среднее по ансамблю равно среднему по
времени.
Рассмотрим систему, состоящую из n тел, движущихся со скоростями
v1, v2 … vn.
Скорость средняя по ансамблю:
где v1, v2 … vn измерены в
один момент времени.
Скорость средняя по времени:
где v1, v2 … vn измерены для
одной молекулы в разные моменты времени.
Слайд 3
Распределение молекул по скоростям.
(Распределение Максвелла)
функция распределения – доля
молекул, приходящаяся на единичный интервал скоростей вблизи некоторого значения
v, т.е. в интервале
Функция распределения – вероятность того, что скорость молекул лежит в единичном интервале вблизи некоторого значения v.
Слайд 4
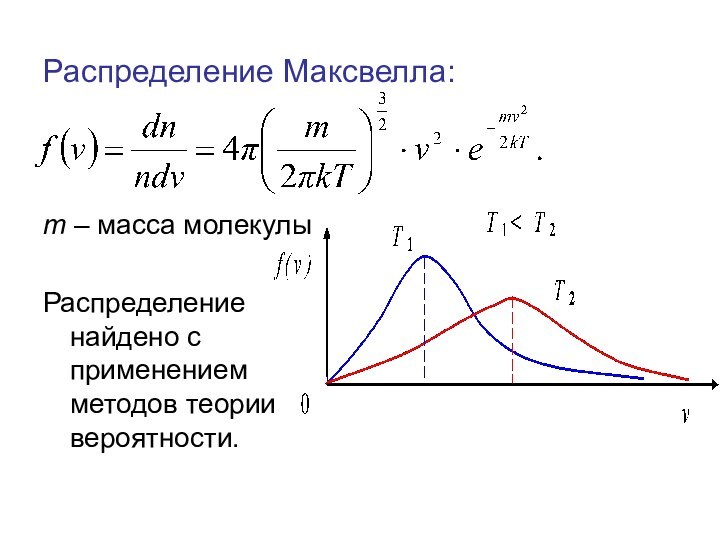
Распределение Максвелла:
m – масса молекулы
Распределение найдено с применением
методов теории вероятности.
Слайд 5
Свойства распределения Максвелла:
1. Кривая распределения имеет максимум, т.к.
при малых значениях скорости v степенная функция v2 растёт
быстрее экспоненты, а при больших наоборот.
Экспонента в формуле распределения зависит от v2
Слайд 6
Свойства распределения Максвелла:
2. При увеличении температуры Т максимум
распределения смещается в сторону более высоких скоростей и понижается,
т.к. площадь под кривой не меняется.
условие нормировки.
Слайд 7
Свойства распределения Максвелла:
3. Доля молекул, приходящихся на единичный
интервал скоростей вблизи v = 0 и v = ∞, равна нулю.
Связано это
с тем, что в соответствии с теорией вероятности молекулы при столкновении не могут либо только отдавать, либо только получать энергию.
Слайд 8
Свойства распределения Максвелла:
4. Доля молекул, обладающих строго определённым
(точным) значением скорости, равна нулю.
Слайд 9
Свойства распределения Максвелла:
5. Распределение Максвелла по скоростям справедливо
для молекул не только идеального газа, но и для
реального газа, жидкости, твёрдого тела.
6. Если систему молекул поместить в силовое поле, то это силовое поле не влияет на распределение молекул по скоростям.
Слайд 10
Опыт Штерна (1888 -1970 гг.)
Первое экспериментальное определение v
молекул и подтверждение распределение Максвелла.
Pt + Ag – платиновая нить, покрытая
серебром.
1, 2, 3 – коаксиальные цилиндры,
в цилиндре 2 сделана диафрагма (щель).
Слайд 11
Опыт Штерна
Платиновая нить нагревается
током до t ~ 12350 C,
при этом атомы серебра испаряются и через щель в
цилиндре 1 и диафрагму в цилиндре 2 попадают на внутреннюю поверхность цилиндра 3, давая изображение щели – полосу О.
При вращении цилиндров 2 и 3 с одинаковой угловой скоростью ω атомы серебра оседают на некотором расстоянии от О, давая расплывчатое изображение щели. Толщина осаждённого слоя соответствует распределению Максвелла.
Слайд 13
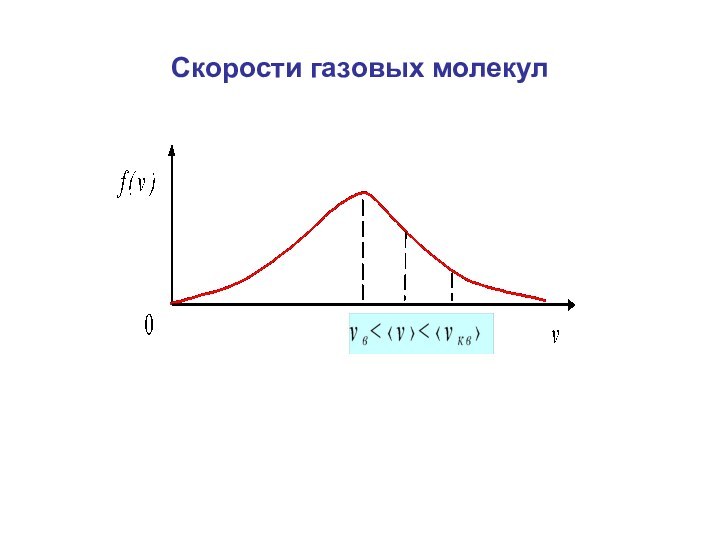
Скорости газовых молекул
Средняя скорость (средняя арифметическая скорость).
в интервале
от v до v + dv.
Сумма всех скоростей:
Слайд 14
Скорости газовых молекул
Средняя скорость:
Слайд 15
Скорости газовых молекул
2. Средняя квадратичная скорость.
Слайд 18
Скорости газовых молекул
3. Наивероятнейшая скорость (наиболее вероятная скорость)
– скорость, которая соответствует максимуму распределения Максвелла.
Слайд 21
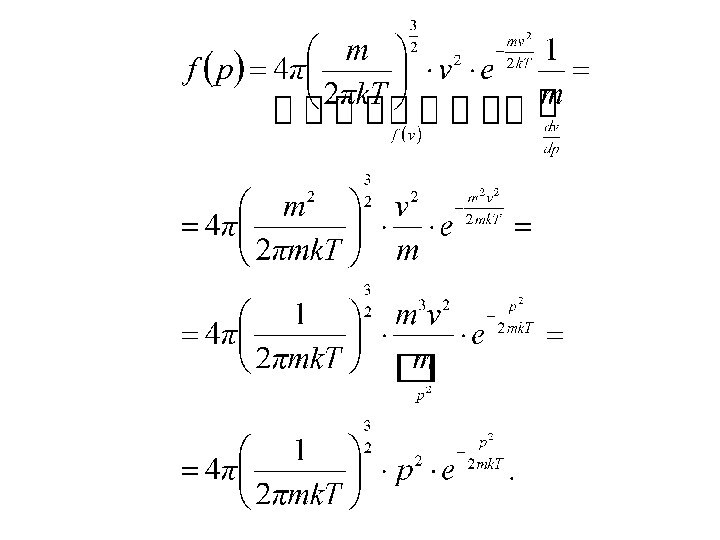
Распределение молекул по импульсам и
кинетическим энергиям
Слайд 22
Распределение молекул по импульсам и
кинетическим энергиям
Делаем замену переменных:
Слайд 24
Распределение молекул по импульсам и
кинетическим энергиям
Слайд 26
Распределение молекул по потенциальным энергиям
(Распределение Больцмана)
Слайд 27
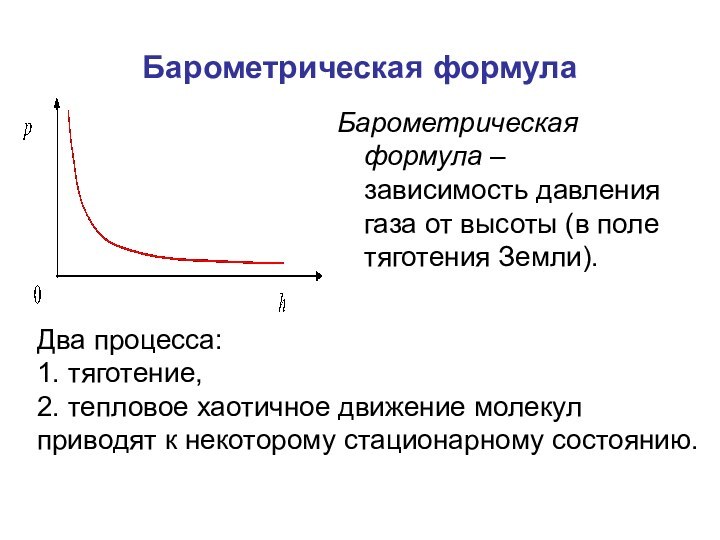
Барометрическая формула
Барометрическая формула – зависимость давления газа от
высоты (в поле тяготения Земли).
Два процесса:
1. тяготение,
2. тепловое хаотичное
движение молекул
приводят к некоторому стационарному состоянию.
Слайд 28
Барометрическая формула
Предположим:
1) идеальный газ, m = const,
2) поле тяготения однородно,
g = const,
3) T = const.
сила давления столба воздуха высотой dh сечением S.
m
– масса молекулы.
n – концентрация молекул.
Слайд 29
Барометрическая формула
Знак «–» отражает то, что с увеличением
h давление p падает.
Слайд 30
Применение: прибор для измерения высоты над поверхностью земли
– высотомер (альтиметр).
Для концентрации молекул.
Уравнение (7).
Слайд 31
Распределение молекул по потенциальным энергиям
(Распределение Больцмана)
потенциальная энергия
в
поле тяготения.
распределение Больцмана.
Больцман показал, что распределение такого вида справедливо
для любого внешнего поля.
n0 – концентрация молекул с нулевой потенциальной
энергией U = 0.
Слайд 32
Опыт Перрена (1870 – 1942 гг.)
Определение числа Авогадро
Основан
на распределении молекул по высоте.
Под микроскопом исследовалось броуновское движение
частиц, которые распределялись по высоте подобно молекулам газа в поле тяготения.
1 – предметное стекло,
2 – покровное стекло,
3 – микроскоп,
4 – эмульсия шариков диаметром доли микрон (частицы гуммигута – млечного сока деревьев).
Плотность жидкости примерно равна плотности шариков.
Слайд 33
Опыт Перрена
m – масса шарика,
mж – масса объёма
жидкости, вытесненной шариком.
Слайд 34
Опыт Перрена. Определение числа Авогадро
Получил
Точное значение:
Слайд 35
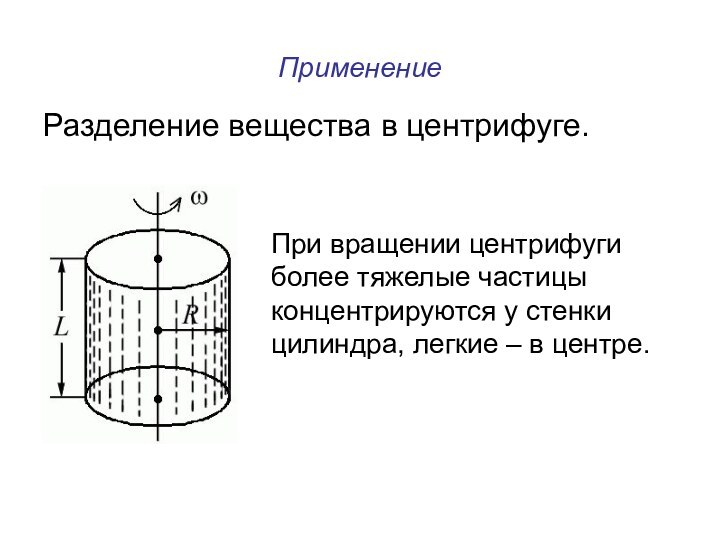
Применение
Разделение вещества в центрифуге.
При вращении центрифуги
более
тяжелые частицы
концентрируются у стенки
цилиндра, легкие – в
центре.
Слайд 36
Закон равномерного распределения энергии по степеням свободы
Степени свободы
– число независимых координат, определяющих положение и конфигурацию системы
в пространстве.
Слайд 37
1. Одноатомный газ имеет три степени свободы,
т.к. может
двигаться в 3-х направлениях.
Следовательно, обладает 3 поступательными степенями свободы.
Молекула –материальная точка.
Энергии вращательного движения нет
Слайд 38
2. Двухатомная жестко связанная молекула
(совокупность двух материальных точек,
связанных недеформируемой связью)
обладает 3 поступательными и 2 вращательными степенями
свободы.
Вращение относительно оси 33' не меняет положение молекулы в пространстве.
Слайд 39
3. Трёхатомная жестко связанная молекула
обладает 3 поступательными и
3 вращательными степенями свободы.
Слайд 40
Закон равномерного распределения энергии по степеням свободы
(закон Больцмана):
если
система частиц находится в состоянии термодинамического равновесия, то средняя
кинетическая энергия хаотического движения молекул, приходящаяся на 1 степень свободы поступательного и вращательного движения, равна
Для реальных молекул, не обладающих жёсткими связями между молекулами, необходимо учитывать также степени свободы колебательного движения.
Слайд 41
На колебательную степень свободы
приходится не только кинетическая энергия,
но и потенциальная, причём среднее значение кинетической энергии равно
среднему значению потенциальной энергии и равно
Следовательно, средняя суммарная энергия молекулы:
i = iпоступат. + iвращат. + 2iколеб.