Слайд 2
Информация о ЕГЭ. Мнения учащихся и родителей.
Школьные выпускные
экзамены – первая по-настоящему серьезная проверка эффективности той работы,
которой ученик занимался несколько лет. С 2001 ЕГЭ в порядке эксперимента введен на территории РФ, а с 2009 года переведен в штатный режим как государственный механизм контроля качества образования.
На мой взгляд введение ЕГЭ в школах имеет свои положительные и отрицательные моменты.
Слайд 3
Положительные стороны ЕГЭ:
Тестирование как форма опроса вводится во
все сферы жизни человека, школьники готовятся к особенностям выполнения
тестовых заданий, которые позволяют проверить общий уровень грамотности.
Благодаря ЕГЭ молодые люди могут продолжить свое обучение в различных учебных заведениях РФ.
ЕГЭ может защитить ученика от несправедливого учитель.
Слайд 4
Отрицательные стороны ЕГЭ:
Тесты хороши для инертных, ограниченных людей,
а не творческих. Значит этим снижается интерес к предмету,
интерес поиска своих решений даже у сильно увлеченного человека.
Введение ЕГЭ приведет к натаскиванию выполнения заданий, поэтому снизится целостность восприятия химического образования.
При минимальном количестве учебного времени на подготовку, роль репетиторства будет необходима.
При снижении учебной нагрузки невозможно готовить учащихся к ЕГЭ.
Слайд 5
Количество учебных часов по химии на весь период
обучения
8 – 9 классы – 68 часов – 2
часа в неделю – 5,5% всего учебного времени за год.
10 – 11 классы – 34 часа - 1 час в неделю – 2,7% всего учебного времени за год.
10 – 11 классы (профильные) – 170 часов в неделю- 13,8% всего учебного времени за год.
На период обучения химии отводится 204 урока за 4 года в непрофильных классах.
Слайд 6
Некорректные формулировки и ошибки в тестах:
Верны ли следующие
суждения о галогенах?
А. Все галогены проявляют
высшую степень окисления.
Б. Радиус атома уменьшается от фтора к йоду.
(ответ: верно только Б).
Карбонат натрия в растворе не взаимодействует с
1) серной кислотой, 2) углекислым газом, 3) сульфатом натрия, 4) хлоридом железа (2).
(ответ: 2)
Слайд 7
Вопросы к родителям:
Считаете ли вы ЕГЭ защитой от
несправедливости учителя?
Вдруг ваш ребенок не справится с ЕГЭ, кого
будите винить?
Какой вопрос вы бы хотели задать авторам этого эксперимента?
Слайд 8
Вопросы к учащимся:
Как вы относитесь к ЕГЭ как
системе контроля качества ваших знаний?
Можно ли сказать, что КИМЫ
дают объективную оценку качества ваших знаний?
Приведите 3-4 примера наиболее сложных заданий
Расшифруйте аббревиатуру ЕГЭ на современном школьном сленге.
Ваши предложения к проведению контрольного тестирования школьников.
Слайд 9
Результаты опроса учащихся
На 1 вопрос: положительно – 30
% учащихся, отрицательно – 55 % учащихся, затрудняются с
ответом – 15% учащихся.
На 2 вопрос: да – ответили 40 % учащихся, нет – 60 %.
На 3 вопрос: наиболее трудными считают- задачи варианта С, цепочки органических превращений, ОВР.
На 4 вопрос: ЕГЭ это: единый государственный эшафот, единая гениальная эйфория, европейская глобальная экзекуция, если готов- экзаменуйся!
Слайд 10
Изучение КИМОВ показало:
Часть А- содержит вопросы, связанные с
ОВР- А4, А7,А8, А24. Всего 4 балла.
Часть В –
В2, всего 2 балла.
Часть С – С1, С2, всего 7 баллов.
На ОВР приходится 13 набранных баллов. Это 26% ответов от оценки «5», 39% ответов от оценки «4», 81% ответов от оценки «3».
Вывод: Знания об окислительно-восстановительных реакциях влияют на количество баллов при ответах.
Слайд 11
Изучение программ показало:
На изучение темы ОВР в 8
классе отводится :
а) в теме «Строение вещества»-
1 урок,
б) в теме «Типы химических реакций»- 2 урока.
На изучение темы ОВР в 9 классе отводится:
а) в теме «Азот и его соединения» -1 урок
На изучение темы ОВР в 11 классе отводится –2 урока.
Итого 6 уроков за 4 года обучения.
Слайд 12
ТЕМА УРОКА: ОВР. Метод полуреакций и влияние среды
на ход ОВР
Цель урока: Формирование умения составлять уравнения окислительно-восстановительных
процессов, идущих в разных условиях.
Учащиеся умеют: распознавать ОВР, определять степени окисления, составлять процессы окисления и восстановления, подбирать коэффициенты методом электронного баланса.
Формируемые умения: записывать уравнения полуреакций окислительно-восстановительных превращений, подбирать сопряженные пары окислительной и восстановительной полуреакций для ОВ процесса.
Слайд 13
Девиз к уроку:
БЛАГОДАРЯ ИСТИННОМУ ЗНАНИЮ ТЫ БУДЕШЬ ГОРАЗДО
СМЕЛЕЕ И СОВЕРШЕННЕЕ, ЧЕМ БЕЗ НЕГО.
ДЮРЕР.
Слайд 14
Используемые технологии:
Технология интерактивного обучения(использование кластеров, метод « мозгового
штурма»).
Здоровьесберегающие технологии(физкульминутка, релаксация).
Информационно-коммуникативные технологии (мультимедийные слайды, интерактивная доска).
Проблемное обучение.
Исследования
в группах( лабораторная работа).
Технология сотрудничества.
Слайд 15
Использование кластеров
С каким настроением вы пришли на урок?
С
каким настроением вы ушли с урока?
Слайд 16
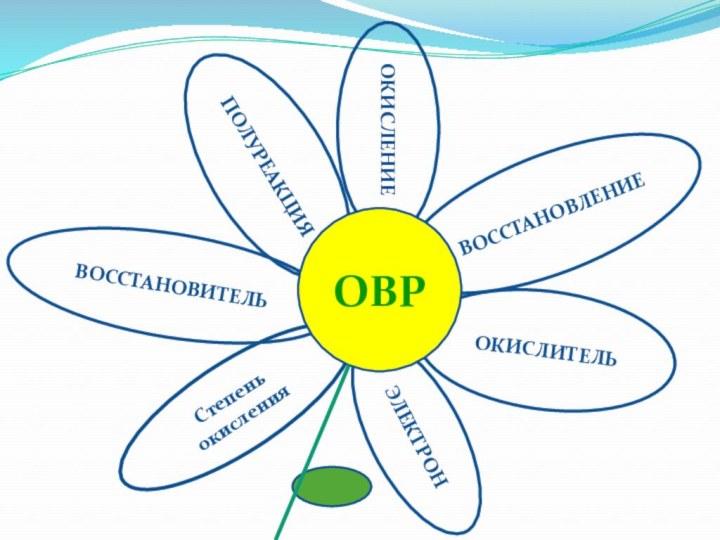
Основные понятия для изучения данной темы
Окисление
Восстановление
Окислитель
Восстановитель
Степень окисления
Полуреакция
Электронный баланс
Коэффициент
Электрон
Слайд 17
Степень
окисления
ПОЛУРЕАКЦИЯ
ЭЛЕКТРОН
ВОССТАНОВИТЕЛЬ
ОКИСЛИТЕЛЬ
ВОССТАНОВЛЕНИЕ
ОКИСЛЕНИЕ
ОВР
Слайд 18
Прием «мозгового штурма»
Что такое окислитель?
Какой процесс называют окисление?
Что
такое восстановитель?
Какой процесс называют восстановление?
Какие реакции называют окислительно-восстановительными?
Что такое
степень окисления?
Какой заряд имеет электрон?
Назовите типы ОВР
Назовите способы расстановки коэффициентов в ОВР.
Слайд 19
Методы расстановки коэффициентов в ОВР
1)
2)
3)
Слайд 20
Расставить коэффициенты методом электронного баланса
H2SO4 + Cu =
CuSO4 + SO2 + H2O
Слайд 22
Алгоритм метода полуреакций
Находим элементы, которые изменили степень окисления
и определяем в состав какого иона они входят.
В кислой
среде атомы кислорода добавляем за счет молекул воды, а атомы водорода за счет катионов водорода.
В щелочной среде атомы кислорода добавляем за счет гидроксогрупп из расчета 1:2, а атомы водорода- добавлением воды.
В нейтральной среде слева всегда вода, а справа протоны или гидроксогруппы.
Восстановитель переходит в соединение с высшей степенью окисления.
Составляем электронный баланс.
Суммируем обе правые части и левые с учетом коэффициентов.
Составляем молекулярное уравнение.
Слайд 23
Лабораторная работа в группах «Превращение хроматов в дихроматы
и наоборот» –проблемная ситуация
К раствору хромата калия добавить раствор
серной кислоты. Что наблюдаем? Составить уравнение реакции. Является ли она ОВР?
К раствору дихромата калия добавить раствор щелочи. Что наблюдаем? Составить уравнение реакции. Является ли эта реакция ОВР?
Слайд 24
Лабораторная работа в группах «Влияние среды на ОВР»
К
раствору сульфита натрия добавьте раствор серной кислоты и раствор
перманганат калия? Что наблюдаете? Составьте ОВР. Расставьте коэффициенты методом полуреакций.
К раствору сульфита натрия добавьте раствор перманганата калия. Что наблюдаете? Составьте ОВР. Расставьте коэффициенты методом полуреакций.
К раствору сульфита натрия добавьте раствор щелочи и раствор перманганата калия. Что наблюдаете? Составьте ОВР. Расставьте коэффициенты методом полуреакций.
Слайд 25
Расставить коэффициенты методом полуреакций:
K2SO3 +KMnO4+H2SO4=
Слайд 26
Расставить коэффициенты методом полуреакций
K2SO4 + KMnO4 + H2O=
Слайд 27
Расставить коэффициенты методом полуреакций
K2SO4 + KMnO4 + KOH
Слайд 28
Примеры уравнений
для тренировки
CuCI + K2Cr2O7 + HCI =
Cr2O3 + KCIO3
+ KOH =
H2SO3 + CI2 + H2O =
Na2CrO4 + NaI + NaOH =
Слайд 30
Выводы:
Для изучения данного метода расстановки коэффициентов учащиеся должны
обладать необходимыми навыками и оперировать определенными понятиями при изучении
ОВР.
Необходимы знания основных окислителей и восстановителей и их переход в другую форму в различной среде.
Данная методика составления ОВР универсальна и проста, ее использование позволяет прогнозировать состав продуктов реакций, что выходит за рамки программы средней школы.
Умения в составлении таких уравнений отрабатываются на нескольких уроках.