- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролитическая диссоциация. (Лекция 14)
Содержание
- 2. Электролиты и неэлектролитыСолиКислотыЩелочиПростые вещества-неметаллыОрганические водорастворимые вещества (кроме кислот, аминов, солей)
- 3. Две теории растворов«Растворы – химические соединения, определяе-мые
- 4. Две теории растворовС.Аррениус«Электролиты в растворах состоят частично
- 5. Физико-химическая теория растворовИ.А.КаблуковИонизация = диссоциация +
- 6. Энергетика диссоциацииNa+(газ) + OH–(газ) ++ H2O (частично
- 7. Кислоты, основания, солиКислота: катионы при диссоциации –
- 8. Амфотерные гидроксидыX(OH)n[X(OH)n-1]+ +OH–[XO(OH)n-1]– +H+Диссоциация по основному типуДиссоциация по кислотному типуОт чего зависит?X–O–HКакая из связей полярнее?
- 9. Сильные электролитыДиссоциируют полностью или почти полностью
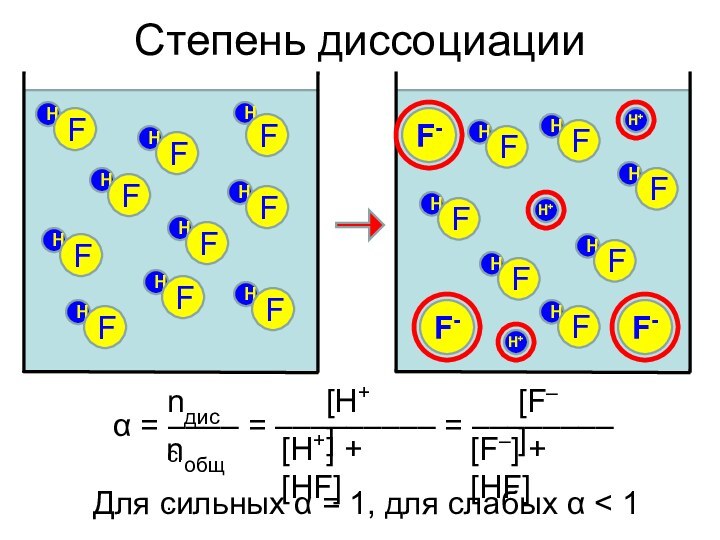
- 10. Степень диссоциацииH+F-HFHFHFHFHFHFHFHFHFHFH+H+F-F-Для сильных α = 1, для слабых α < 1
- 11. От чего зависит α?Природа растворителя (полярность и
- 12. Закон разбавления ОствальдаК.В.ОствальдТолько для очень разбавленных
- 13. Константа диссоциацииHAn ⇄ H+ + An–– константа
- 14. Вывод закона разбавления HAn
- 15. Скачать презентацию
- 16. Похожие презентации
Электролиты и неэлектролитыСолиКислотыЩелочиПростые вещества-неметаллыОрганические водорастворимые вещества (кроме кислот, аминов, солей)




![Электролитическая диссоциация. (Лекция 14) Амфотерные гидроксидыX(OH)n[X(OH)n-1]+ +OH–[XO(OH)n-1]– +H+Диссоциация по основному типуДиссоциация по кислотному типуОт чего зависит?X–O–HКакая из связей полярнее?](/img/tmb/15/1417417/dc956f5b792fe79a5c07362d1fe87a38-720x.jpg)





Слайд 2
Электролиты и неэлектролиты
Соли
Кислоты
Щелочи
Простые вещества-неметаллы
Органические водорастворимые вещества (кроме
кислот, аминов, солей)
Слайд 3
Две теории растворов
«Растворы – химические соединения, определяе-мые силами,
действующи-ми между растворителем и растворенным веществом»
Д.И.Менделеев
Химическая теория
«Рассуждение о соединении
спирта с водой», 1861
Слайд 4
Две теории растворов
С.Аррениус
«Электролиты в растворах состоят частично из
диссоциированных молекул, число которых растет при разбавлении раствора;
Образующиеся при
диссоциации молекул ионы определяют специфические физические и химические свойства растворов электролитов;В бесконечно разбавленных растворах молекулы существуют только в виде ионов;
Вещество в растворе тем более активно, чем больше оно диссоциировано на ионы».
Теория электролитической диссоциации
Слайд 5
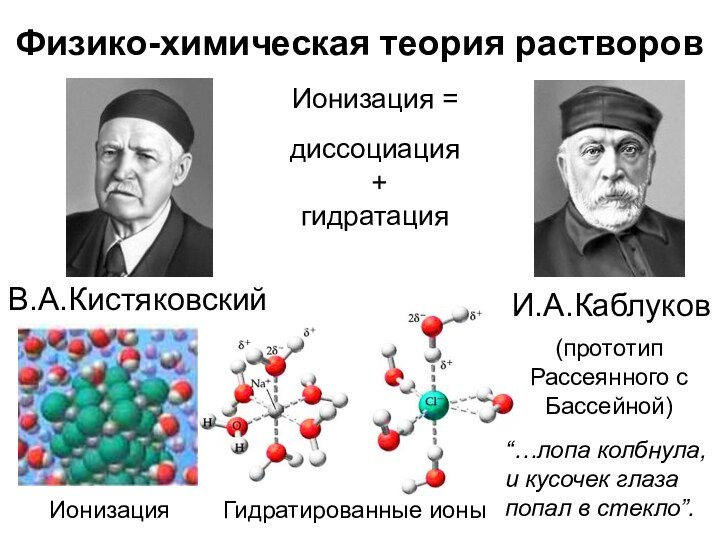
Физико-химическая теория растворов
И.А.Каблуков
Ионизация =
диссоциация
+
гидратация
Гидратированные ионы
(прототип Рассеянного
с Бассейной)
В.А.Кистяковский
Ионизация
“…лопа колбнула, и кусочек глаза попал в стекло”.
Слайд 6
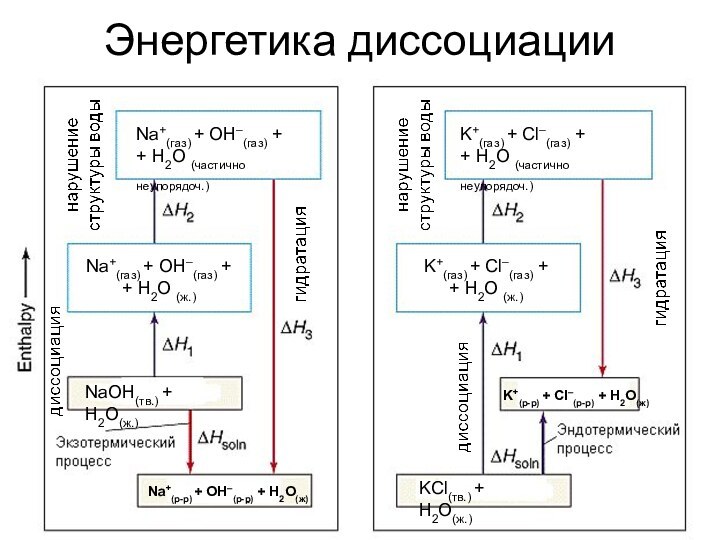
Энергетика диссоциации
Na+(газ) + OH–(газ) +
+ H2O (частично неупорядоч.)
NaOH(тв.)
+ H2O(ж.)
Na+(р-р) + OH–(р-р) + H2O(ж)
K+(р-р) + Cl–(р-р) +
H2O(ж)KCl(тв.) + H2O(ж.)
Na+(газ) + OH–(газ) +
+ H2O (ж.)
K+(газ) + Cl–(газ) +
+ H2O (ж.)
K+(газ) + Cl–(газ) +
+ H2O (частично неупорядоч.)
Слайд 7
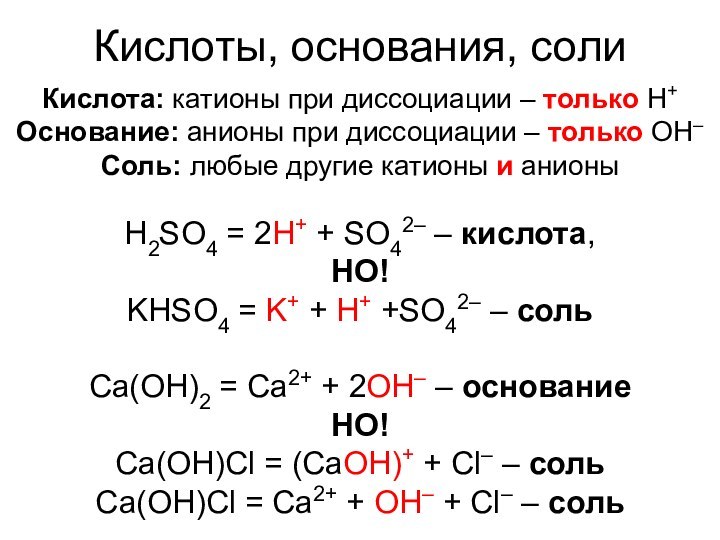
Кислоты, основания, соли
Кислота: катионы при диссоциации – только
H+
Основание: анионы при диссоциации – только OH–
Соль: любые другие
катионы и анионыH2SO4 = 2H+ + SO42– – кислота,
НО!
KHSO4 = K+ + H+ +SO42– – соль
Ca(OH)2 = Ca2+ + 2OH– – основание
НО!
Ca(OH)Cl = (CaOH)+ + Cl– – соль
Ca(OH)Cl = Ca2+ + OH– + Cl– – соль
Слайд 8
Амфотерные гидроксиды
X(OH)n
[X(OH)n-1]+ +OH–
[XO(OH)n-1]– +H+
Диссоциация по основному типу
Диссоциация по
кислотному типу
От чего зависит?
X–O–H
Какая из связей полярнее?
Слайд 11
От чего зависит α?
Природа растворителя (полярность и др.)
–
Н2О > C2H5OH > (C2H5)O > C6H6
HCl в безводном
эфире не реагирует с Na!2. Природа электролита
– Ионная связь – сильные электролиты
– Ковалентная полярная – сильные и слабые
– Ковалентная неполярная – неэлектролиты
3. Концентрация
– Для слабых электролитов – С↑ ⇒ α↓
4. Присутствие одноименных ионов
– α↓ – принцип Ле Шателье
5. Температура
– Обычно ΔНдисс > 0 ⇒ с ростом температуры α↑
Слайд 12
Закон разбавления Оствальда
К.В.Оствальд
Только для очень разбавленных
растворов слабых
электролитов!
α ~ 1/√CKtAn
С → 0 ⇒ α → 1
HCl
– при разбавлении в 10 раз
[H+] падает в 10 разCH3COOH – при разбавлении в 10 раз [H+] падает только в ~ 3,1 раза!
В очень разбавленных растворах
даже слабые электролиты диссоциируют почти полностью!
Слайд 13
Константа диссоциации
HAn ⇄ H+ + An–
– константа диссоциации
Для
многоосновных кислот – ступенчатая диссоциация
H3PO4 ⇄ H+ + H2PO4–
Чем
дальше, тем слабее!H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
Слайд 14
Вывод закона разбавления
HAn ⇄
H+ + An–
С0 СHAn
0 0ΔC –x x x
Сравн СHAn – x x x
Т.к. , то:
Т.к. , то: