Слайд 2
Основні відомості
Фосфор (від грец. Phosphoros - світлоносний ;
лат. Phosphorus) P, хімічний елемент V групи періодичної системи.
Відомо 10 модифікацій фосфору, з них найважливіші - білий , червоний і чорний фосфор (технічний білий фосфор називають жовтим фосфором ).
Один з найпоширеніших елементів земної кори: 0,08-0,09% її маси. Концентрація у морській воді 0,07 мг/л.
У вільному стані не зустрічається через високу хімічну активність.
Утворює близько 190 мінералів, найважливішими з яких є апатит Ca5(PO4)3(F, Cl, OH), фосфорит та інші.
Слайд 3
Алотропні модифікації
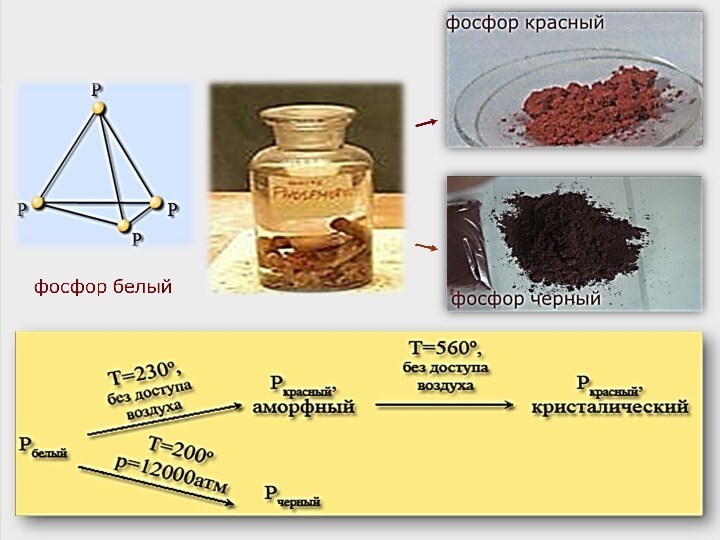
Білий фосфор - м’яка, безбарвна кристалічна речовина,
схожа на віск.
Має молекулярні кристалічні ґратки, у вузлах
яких розміщені тетраедричні молекули P4. Летка, легкоплавка речовина, має характерний запах часнику.
Не розчиняється у воді, але добре розчиняється у сірковуглеці CS2 і бензині. Легкозаймиста речовина, тому зберігають її під водою.
Білий фосфор у темряві на повітрі світиться зеленкувато-жовтим світлом. Це явище називається люмінесценція. Воно спричиняється повільним окисненням білого фосфору. Білий фосфор - надзвичайно отруйна речовина, навіть у малих дозах. 50 мг білого фосфору - смертельні!
При тривалому слабкому нагріванні білий фосфор переходить у червоний.
Слайд 4
Алотропні модифікації
Червоний фосфор - порошок червоно-бурого кольору, неотруйний.
Має атомні кристалічні ґратки. Не розчиняється у воді і
сірковуглеці.
Без запаху, у темряві не світиться.
Встановлено, що червоний фосфор є сумішшю кількох алотропних модифікацій, які відрізняються одна від одної кольором - від яскраво-червоного до фіолетового.
Червоний фосфор легко вбирає вологу, тобто є гігроскопічним.
При нагріванні без доступу повітря випаровується, а при охолодженні його пара перетворюється на білий фосфор.
Слайд 5
Алотропні модифікації
Чорний фосфор - речовина, схожа на графіт,
масна на дотик, має металічний блиск, не отруйний, виявляє
властивості напівпровідників.
Добувають чорний фосфор тривалим нагріванням білого фосфору під великим тиском.
Слайд 7
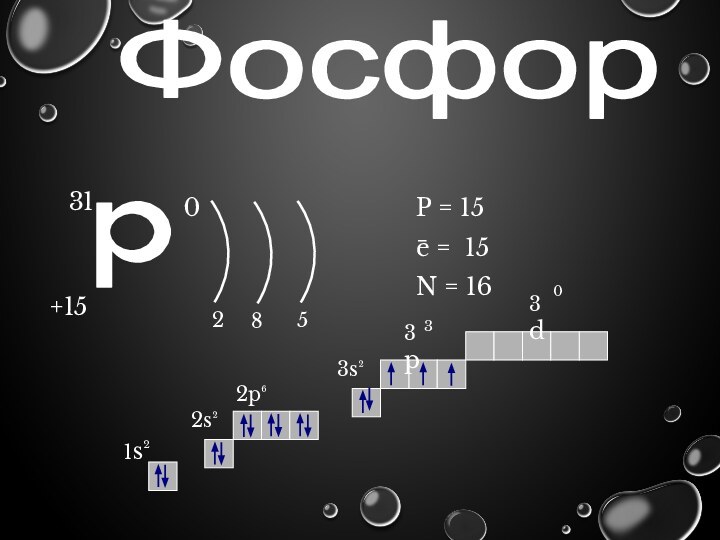
Фосфор
p
31
+15
0
2
8
5
P = 15
e = 15
N = 16
−
1s²
2p⁶
2s²
3s²
3d
0
Слайд 9
Поширення у природі
Фосфати
Фосфорити
Слайд 10
Застосування фосфору
Для виробництва добрив та миючих засобів
Червоний
фосфор:
у виробництві сірників
Білий фосфор
як димоутворювальний і запальний засіб
Чорний
фосфор
в металургії
Слайд 11
Фізичні властивості
Білий фосфор
біла речовина (через домішки
може мати жовтуватий відтінок)
легко ріжеться ножем і деформується від
невеликих зусиль
має молекулярну будову, формула P 4.
легкорозчинний в органічних розчинниках щільність становить близько 1823 кг / м .
плавиться при 44,1 C.
надзвичайно активний.
отруйний (викликає ураження кісток, кісткового мозку, некроз щелеп, летальна доза білого фосфору для дорослого чоловіка становить 0,05-0,1 м.
Жовтий фосфор
вогненебезпечна кристалічна речовина від світло-жовтого до темно-бурого кольору.
плавиться при +34 C, кипить при +280 C.
у воді не розчиняється, на повітрі легко окислюється і займається
горить сліпучим яскраво-зеленим полум'ям з виділенням густого білого
Слайд 12
Фізичні властивості
Червоний фосфор
більш термодинамічно стабільна модифікація
елементарного фосфору
має формулу Р n і являє собою полімер
зі складною структурою
має відтінки від пурпурно-червоного до фіолетового, а в литому стані - темно-фіолетовий з мідним відтінком металевий блиск
малорозчинний
на повітрі не самозаймається, аж до температури 240-250 С (при переході в білу форму під час сублімації)
розчиняється у воді, а також в бензолі, сірковуглеці й інших
щільність досягає 2400 кг / м
Чорний фосфор
найменш активна форма
має високу (2690 кг / м ) щільність
чорна речовина з металевим блиском, жирна на дотик і дуже схоже на графіт, і з повністю відсутньою розчинністю у воді або органічних розчинниках
проводить електричний струм і має властивості напівпровідника
температура плавлення чорного фосфору 1000 С
Слайд 13
Добування
Вільний фосфор отримують з природних фосфатів, прожарюючи їх
з коксом і піском:
Ca3(PO4)2 +3SiO2 +5C = 2P +3CaSiO3
+5CO
Слайд 14
Хімічні властивості
Для фосфору характерні відновні властивості, які
він виявляє у реакціях з неметалами:
4P+3O2 (нестача) = 2P2O3
4P+5O2 (надлишок) = 2P2O5
2P+5Cl2 (надлишок) = 2PCl5
В реакціях з активними металами фосфор виступає в ролі окисника:
3Mg+2P = Mg3P.
Слайд 15
Хімічні властивості
Суміш червоного фосфору з бертолетовою сіллю
КСl03 займається з вибухом навіть від найменшого тертя або
натискання:Суміш червоного фосфору з бертолетовою сіллю КСl03 займається з вибухом навіть від найменшого тертя або натискання:
10KClO3 + 12P(черв.) = 10KCl + 3P4O10
До молекул оксиду вмить приєднуються молекули води й утворюється метафосфорна кислота:
P2O5+H2O=2HPO3
Слайд 16
Хімічні властивості
Фосфор реагує з деякими неметалами-окисниками, при
цьому можуть утворюватися похідні Фосфору з різним ступенем окиснення:
2P
+ 3S = P2S3
2P + 5S = P2S5
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
Фосфор вступає у взаємодію з багатьма активними металами:
3Ca + 2P = Ca3P2
Відходи фосфору знищують за допомогою розчину купрум(ІІ) сульфату:
2P + 5CuSO4 + 8H2O = 2H3PO4 + 5Cu + 5H2SO4