- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Удобрения и их классификация
Содержание
- 2. АктуальностьС точки зрения практического растениеводства важнейшим средством
- 3. Цель и задачи проектаЦель - изучение удобрений
- 4. Общая информация об удобрениях. Удобрения - это
- 5. Классификация удобренийВсе удобрения, по различиям в их
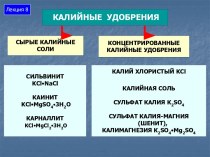
- 7. Классификация минеральных удобрений
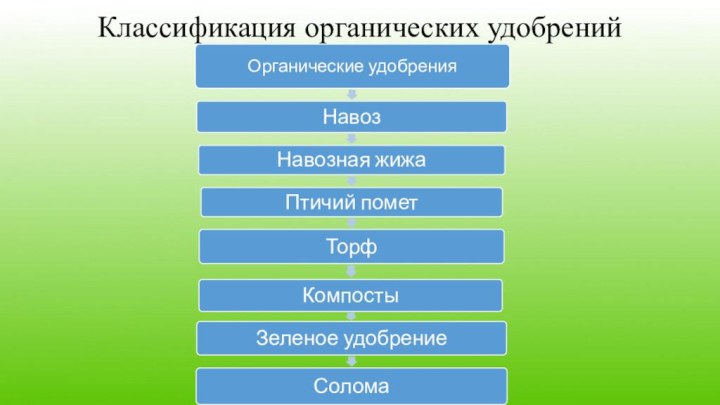
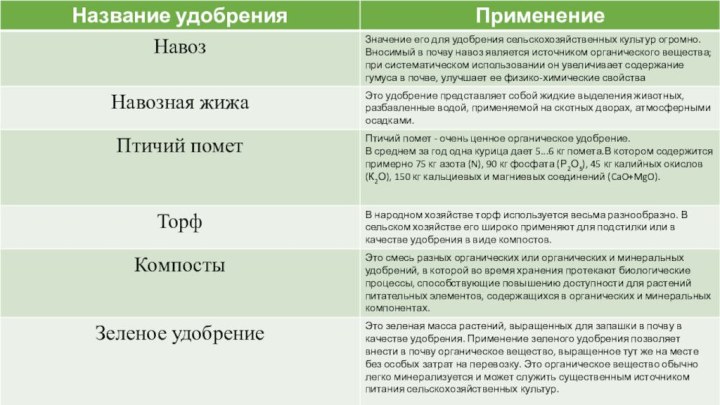
- 8. Классификация органических удобрений
- 10. Бактериальные удобренияБактериальные удобрения - это препараты, содержащие
- 11. Бактериальные удобренияФитогормоны.Фитогормоны (от греч. phyton - растение
- 12. Физические свойстваФизическое состояние удобрения (агрегатное состояние): минеральные
- 13. Химические свойстваМассовая доля элементов питания, %– это
- 14. Усвоение растениями удобренийНаличие достаточного количества питательных веществ
- 15. Практическая частьРаспознайте удобрения: сульфат аммония, суперфосфат, нитрат
- 16. Результаты проведенных исследований можно оформить в виде
- 17. Практическая значимость исследованияПрактическая значимость моего исследования заключается
- 18. Выводы: Внесение удобрений – обязательное условие правильного
- 19. Литература рекомендованная при изучении дисциплины «Химия»Библиотека
- 20. Скачать презентацию
- 21. Похожие презентации
АктуальностьС точки зрения практического растениеводства важнейшим средством улучшения питания сельскохозяйственных культур является прежде всего применение органических и минеральных удобрений. Рост растительной продукции определяется множеством факторов, среди которых ведущая роль все же принадлежит удобрениям и особенно минеральным,
















Слайд 3
Цель и задачи проекта
Цель - изучение удобрений и
их классификации.
Задачи:
Изучить литературу по данной теме «Удобрения и
их классификация»Выяснить, какую роль играют удобрения в жизни растений.
Рассмотреть классификацию удобрений.
Выяснить отличительные особенности минеральных, органических и бактериальных удобрений.
Рассмотреть физико-химические свойства удобрений.
Объяснить как растения усваивают удобрения.
Приставить полученные результаты и рекомендации по применению удобрений.
Слайд 4
Общая информация об удобрениях.
Удобрения - это неорганические и
органические вещества, применяемые в сельском хозяйстве и рыболовстве для
повышения урожайности культурных растений и рыбопродуктивности прудов. Удобрения - это неорганические и органические вещества, применяемые в сельском хозяйстве. Видов удобрений существует очень много. Все они делятся на минеральные и органические.
Слайд 5
Классификация удобрений
Все удобрения, по различиям в их происхождении,
делят на такие группы:
минеральные;
органические.
Органические и минеральные группы удобрений каждая
имеют свои подгруппы и делятся по составу активных веществ.По характерным свойствам, признакам виды удобрений классифицируются в зависимости от:
Происхождения (методы изготовления, используемое сырьё)
Актуального метода наполнения почвы (поверхностный, предпосевной, подкормочный, внутрипочвенный, основной)
Способа воздействия (косвенный, прямой) метода кормления растительной культуры (внекорневой, корневой)
Агрегатного состояния (твёрдое, полужидкое, жидкое)
Слайд 10
Бактериальные удобрения
Бактериальные удобрения - это препараты, содержащие культуру
микроорганизмов, способствующих улучшению питания растений. Питательных веществ они не
содержат. Бактериальные препараты непосредственно не служат для питания растений, а лишь способствуют развитию полезных микроорганизмов, которые влияют на питательный режим почвы.Для приготовления бактериальных препаратов, как правило, берут чистые культуры определенных бактерий, размножают их в какой-либо благоприятной среде и выпускают в виде торфяной массы или сухого порошка с большим содержанием определенных видов бактерий.
Большинству бобовых культур (клевер, соя, фасоль) присущи определенные специфические расы клубеньковых бактерий. Некоторые расы живут одновременно на нескольких видах растений, например одна и та же раса клубеньковых бактерий пригодна для гороха, вики, чечевицы, бобов. Одна и та же раса бактерий свойственна люцерне и доннику пли люпину и сераделле.
Слайд 11
Бактериальные удобрения
Фитогормоны.Фитогормоны (от греч. phyton - растение и
гормоны) - гормоны растений, физиологически активные органические соединения, действующие
в ничтожно малых количествах как регуляторы роста и развития. Образуются главным образом в зонах интенсивного роста, иногда и в тканях, закончивших рост.Синтезируясь в одних органах или зонах растения, фитогормоны оказывают влияние на другие, обеспечивая тем самым функциональную целостность растительного организма.Известно 5 типов фитогормонов, для которых установлены химическое строение и в основных чертах механизм регуляторного действия: ауксины, гиббереллины, цитокинины (стимуляторы), а также абсцизовая кислота и этилен (ингибиторы).
Разные фитогормоны, с одной стороны, оказывают одновременное и различное действие на все процессы роста и развития растений, а с другой - взаимодействуют один с другим. Так, ауксин индуцирует синтез этилена и способствует синтезу цитокининов, а действие гиббереллина сопровождается увеличением содержания ауксина.Поэтому для растений важно не содержание какого-либо одного фитогормона, а соотношение между ними .
Области применения фитогормонов и их аналогов: размножение ценных сортов с помощью культуры тканей; укоренение черенков ; стимуляция предуборочного опадения плодов, дефолиантное и гербицидное действие ; повышение урожайности томата и бессемянных сортов винограда, выхода льноволокна.
Стимуляторы роста.Стимуляторы роста, а точнее, регуляторы роста приобретают большую популярность у садоводов и огородников. Дело в том, что они способствуют значительному росту урожайности сельскохозяйственных культур. Стимуляторы роста обеспечивают повышенное качество сельскохозяйственных культур, успешно используются в садоводстве, виноградарстве и овощеводстве для ускорения укоренения при размножении, уменьшения предуборочного опадения плодов, с целью задержки цветения, прореживания цветков и завязей.
Слайд 12
Физические свойства
Физическое состояние удобрения (агрегатное состояние): минеральные удобрения
бывают твердые (порошкообразные, гранулированные, кристаллические и зернистые) и жидкие
(сжиженные газы, растворы и суспензии).ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА.
1) Растворимость – масса удобрения в кг, которая может быть растворена в 100 кг воды при определенной температуре. Наиболее актуальным этот показатель является для листовых удобрений и фертигаторов.
2) рН – реакция раствора определенной концентрации, выраженная в единицах рН. Особенно важный показатель для удобрений, используемых в системах фертигации, поскольку в этом случае очень важно удерживать рН раствора в определенном диапазоне значений во избежание образования осадка.
3) Гигроскопичность – способность удобрения поглощать атмосферную влагу с интенсивностью, которая зависит от температуры и влажности атмосферы. При повышенной гигроскопичности удобрения слеживаются, ухудшается их сыпучесть и способность к рассеванию, гранулы теряют плотность. Оценивается по 10-бальной шкале . Например, гигроскопичность гранулированной аммиачной селитры составляет 9,3 балла, кальциевой селитры – 9,5-8,4, карбамида гранулированного 3,6, крупнокристаллического хлорида калия 4,4, мелкокристаллического – 3,6–3,2, нитроаммофоски 8,1–7,2.
Слайд 13
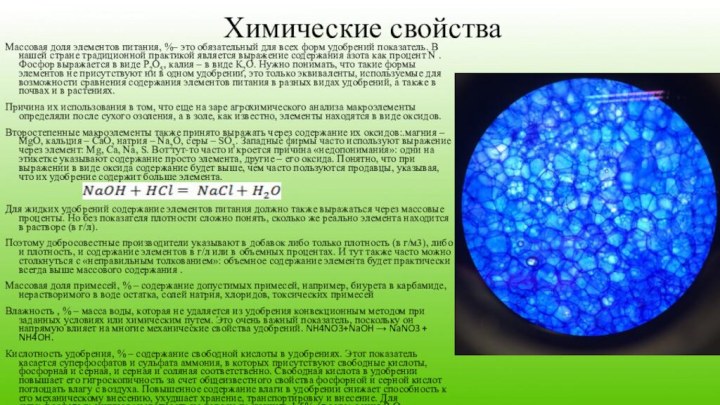
Химические свойства
Массовая доля элементов питания, %– это обязательный
для всех форм удобрений показатель. В нашей стране традиционной
практикой является выражение содержания азота как процент N . Фосфор выражается в виде Р2О5, калия – в виде К2О. Нужно понимать, что такие формы элементов не присутствуют ни в одном удобрении, это только эквиваленты, используемые для возможности сравнения содержания элементов питания в разных видах удобрений, а также в почвах и в растениях.Причина их использования в том, что еще на заре агрохимического анализа макроэлементы определяли после сухого озоления, а в золе, как известно, элементы находятся в виде оксидов.
Второстепенные макроэлементы также принято выражать через содержание их оксидов:.магния – MgO, кальция – CaO, натрия – Na2О, серы – SO3. Западные фирмы часто используют выражение через элемент: Mg, Ca, Na, S. Вот тут-то часто и кроется причина «недопонимания»: одни на этикетке указывают содержание просто элемента, другие – его оксида. Понятно, что при выражении в виде оксида содержание будет выше, чем часто пользуются продавцы, указывая, что их удобрение содержит больше элемента.
Для жидких удобрений содержание элементов питания должно также выражаться через массовые проценты. Но без показателя плотности сложно понять, сколько же реально элемента находится в растворе (в г/л).
Поэтому добросовестные производители указывают в добавок либо только плотность (в г/м3), либо и плотность, и содержание элементов в г/л или в объемных процентах. И тут также часто можно столкнуться с «неправильным толкованием»: объемное содержание элемента будет практически всегда выше массового содержания .
Массовая доля примесей, % – содержание допустимых примесей, например, биурета в карбамиде, нерастворимого в воде остатка, солей натрия, хлоридов, токсических примесей
Влажность , % – масса воды, которая не удаляется из удобрения конвекционным методом при заданных условиях или химическим путем. Это очень важный показатель, поскольку он напрямую влияет на многие механические свойства удобрений. NH4NO3+NaOH → NaNO3 + NH4OH.
Кислотность удобрения, % – содержание свободной кислоты в удобрениях. Этот показатель касается суперфосфатов и сульфата аммония, в которых присутствуют свободные кислоты, фосфорная и серная, и серная и соляная соответственно. Свободная кислота в удобрении повышает его гигроскопичность за счет общеизвестного свойства фосфорной и серной кислот поглощать влагу с воздуха. Повышенное содержание влаги в удобрении снижает способность к его механическому внесению, ухудшает хранение, транспортировку и внесение. Для суперфосфата граничная кислотность не должна превышать 1,5% от содержания Р2О5.
Слайд 14
Усвоение растениями удобрений
Наличие достаточного количества питательных веществ в
почве не дает гарантии их попадания в растения. Усваиваемость
элементов питания культурами зависит от многих факторов, как внутренних, так и внешних.Главным условием хорошей поглощаемости растениями микроэлементов является их доступность. Если элементы питания находятся в почвенном растворе, они наиболее легко усваиваются растениями. Наиболее важными для питания культур являются находящиеся в почвенном растворе ионы Са2+, К+, Mg2+, NH4+, NO3-, SO42- и H2PO4-. В процессе поглощения их корневой системой растений необходимо постоянное пополнение этих элементов путем внесения удобрений.
Растения способны питаться не только ионами микро- и макроэлементов, которые находятся в почвенном растворе, но и теми ионами, которые связаны в коллоидах. С помощью корневых выделений , обладающих растворяющей способностью, растения способны воздействовать на твердую фазу почвы, превращая необходимые им элементы из малодоступных соединений в легко усваиваемую форму.
Достаточное количество азота в питании растения способствует лучшей усваиваемости кальция, калия, фосфора, железа, меди, магния, марганца и цинка.
На уровень усваиваемости удобрений растениями большое влияние оказывают параметры окружающей среды: температура и влажность почвы, воздуха, освещенность, кислотно-щелочная реакция грунта, его механический и химический состав и пр.
Освещение, необходимое для процессов фотосинтеза, так же необходимо и для поглощения растениями элементов питания. Чем меньше света, тем ниже уровень усвоения полезных веществ.
Достаточная влажность почвы положительно влияет на развитие корневой системы растений и улучшает ее поглотительную способность..Оптимальный уровень влажности для каждого типа почв не одинаков. Для суглинистого чернозема он составляет около 55 – 61%, для песчаного чернозема этот показатель находится в пределах 35 – 40%, а для подзолистых почв – от 41% до 61%.. На усваиваемость микро- и макроэлементов растениями негативно влияют как засуха, так и переувлажнение грунта.
Не меньшее влияние на доступность питательных элементов для растений оказывает и кислотно-щелочная среда почвы. Для каждого из элементов минерального питания есть определенное значение рН почвы, при котором он будет максимально доступен для растения. Избыток водорастворимых солей в почвенном растворе очень вреден для растительных организмов, а высокие концентрации (0,3 – 0,5%) приводят к гибели растений.
Слайд 15
Практическая часть
Распознайте удобрения: сульфат аммония, суперфосфат, нитрат натрия
и сильвинит.
Приготовим раствор первого неизвестного минерального удобрения. Отберем в
пробирки пробы этого раствора. В первую пробирку добавляем концентрированную серную кислоту (H2SO4) и медь (Cu) – реакция не идет. Значит, нитрат-ионов (NO3- ) в растворе нет. Во вторую пробирку добавляем раствор хлорида бария (BaCl2) – выпадает белый осадок. Следовательно, в испытуемом растворе присутствуют сульфат-ионы (SO42-).SO42- + BaCl2 = BaSO4↓ + 2Cl-
В третью пробирку наливаем раствор щелочи и нагреваем его. Влажная универсальная индикаторная бумага становится синей у отверстия пробирки. Это значит, что выделяется аммиак (NH3). В испытуемом растворе присутствуют ионы аммония (NH4+).
NH4 + NaOH = NH3 ↑ +Na+ + H2O
В четвертую пробирку добавляем раствор нитрата серебра AgNO3 – изменений не происходит. Это значит, что хлор-ионов (Cl-) и фосфат-ионов (PO43-) в растворе нет. Мы обнаружили в пробах сульфат-ионы и ионы аммония. Следовательно, определяемое удобрение – сульфат аммония (NH4)2SO4.
2. Приступим к анализу второго неизвестного удобрения. Приготовим раствор удобрения и пробы этого раствора. В первую пробирку добавим концентрированную серную кислоту и медь – появился бурый газ.
2NO3- + 2H2SO4 + Cu = 2NO2 ↑ + CuSO4 + SO42‑ + 2H2O
Следовательно, в растворе присутствуют нитрат-ионы (NO3- ). Во вторую пробирку добавим раствор хлорида бария BaCl2 – изменений не происходит. Это значит, что сульфат-ионов (SO42-). в исследуемом растворе нет. К третьей пробе добавим раствор щелочи и нагреем пробирку. Влажная универсальная индикаторная бумага не меняет свой цвет. Это значит, что ионов аммония (NH4+) в пробе нет. В четвертую пробирку добавляем раствор нитрата серебра AgNO3 – изменений не происходит. Хлорид-ионов (Cl-) и фосфат-ионов (PO43-) в растворе нет. Мы обнаружили только нитрат-ионы. Следовательно, анализируемое удобрение является нитратом натрия NaNO3.
3. Приготовим раствор третьего неизвестного удобрения и отберем пробы. К первой пробе добавляем серную кислоту H2SO4 и медь Cu: изменений не происходит. Нитрат-ионов (NO3- ) в пробе нет. Раствор хлорида бария BaCl2 обнаруживает присутствие сульфат-ионов SO42-: выпадает белый осадок сульфата бария.
SO42- + BaCl2 = BaSO4 ↓ + 2Cl-
К третьей пробе добавляем раствор щелочи и нагреваем. Влажная универсальная индикаторная бумага у отверстия пробирки не меняет свой цвет. Это значит, что ионов аммония (NH4) в пробе нет. В четвертой пробирке при добавлении раствора нитрата серебра выпадает желтый осадок. Это свидетельствует о присутствии в пробе фосфат-ионов.
PO43- + 3AgNO3 = Ag3PO4↓ + 3NO3-
Следовательно, анализируемое удобрение является суперфосфатом.
4. Приготовим раствор четвертого неизвестного удобрения и отберем пробы раствора. К раствору в первой пробирке добавляем концентрированную серную кислоту H2SO4 и медь Cu: реакция не идет. Это значит, что нитрат-ионов (NO3- ) в пробе нет. Во вторую пробирку добавляем раствор хлорида бария BaCl2 – изменений нет. Сульфат-ионы (SO42-) в пробе не обнаружены. Третью пробу анализируем на присутствие ионов аммония (NH4+).. Добавляем щелочь и нагреваем. Влажная универсальная индикаторная бумага не меняет цвет у отверстия пробирки. Значит, ионов аммония в пробе нет. В четвертую пробирку добавляем раствор нитрата серебра AgNO3 – выпадает белый творожистый осадок. Следовательно, в растворе присутствуют хлорид-ионы.
AgNO3 + Cl- = AgCl ↓ + NO3
Слайд 16
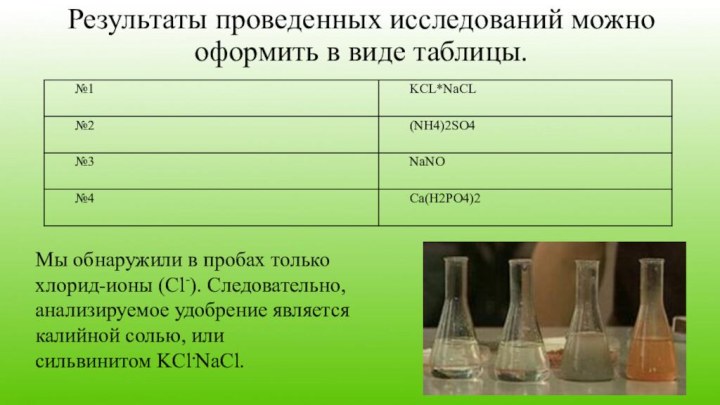
Результаты проведенных исследований можно оформить в виде таблицы.
Мы
обнаружили в пробах только хлорид-ионы (Cl-). Следовательно, анализируемое удобрение
является калийной солью, или сильвинитом KCl.NaCl.
Слайд 17
Практическая значимость исследования
Практическая значимость моего исследования заключается в
распознании удобрений .И в результате проведенного мною исследования мы
обнаружили в пробах хлорид-ионы. Следовательно, анализируемое удобрение является калийной солью, или сильвинитом KCl.NaCl.Это как никогда важно для правильного расчета удобрения для растений.Что бы не нанести ему вред.
Слайд 18
Выводы:
Внесение удобрений – обязательное условие правильного ухода
за любым приусадебным участком. Подкормки насыщают грунт питательными веществами,
способствуют хорошему росту, развитию и плодоношению огородных культур.Одним из факторов нормального развития растений является наличие питательных веществ в почве. Для того, чтобы восполнить запас питательных веществ, необходимо вносить в почву удобрения. Наиболее безопасными для окружающей среды являются органические и бактериальные удобрения.
Слайд 19
Литература рекомендованная
при изучении дисциплины «Химия»
Библиотека ФТК
Габриелян О.С., И. Г. Остроумов Химия для профессий и
специальностей ЕН профиля: учебник для СПО / О.С. Габриелян, И. Г. Остроумов. – М.: Академия, 2014.Габриелян О.С., И. Г. Остроумов Химия: практикум: учеб. пособие / О.С. Габриелян, И. Г. Остроумов. – М.: Академия, 2013.
Ерохин Ю. М. Химия для профессий и специальностей и технического и ЕН профилей: учебник для СПО / Ерохин Ю. М., Ковалева И. Б. – М.: Академия, 2013.