Слайд 2
Цель: эффективно повторить и обобщить знания, устранить отставание
учащихся по теме «Алканы»
Задачи :
Повторить теорию;
Выполнить упражнения в
режиме самопроверки;
Выполнить контрольные разноуровневые задания
Слайд 3
Содержание
теория
контроль
состав
строение
получение
1 уровень
2 уровень
3 уровень
ответы
свойства
Слайд 4
АЛКАНЫ
СОСТАВ
СТРОЕНИЕ
СВОЙСТВА
ПРИМЕНЕНИЕ
ЭКОЛОГИЧЕСКИЕ
ПОСЛЕДСТВИЯ
СИНТЕЗЫ
ХИМИЧЕСКИЕ
ПРЕВРАЩЕНИЯ
ГЕНЕТИЧЕСКАЯ
СВЯЗЬ
Слайд 5
Состав
CH4
C2H6
C3H8
CnH2n+2
Гомологический ряд:
CH4,C2H6,…..C8H18….C10H22
Метан, этан, ……..октан ……декан -
ЭТО ВЕЩЕСТВА- ГОМОЛОГИ
Слайд 6
Гомологи -
вещества, сходные по строению
и свойствам,
состав которых отличается
на одну или более групп CH2
Слайд 7
Гомологами являются :
а) C2H6 и C2H4
б)
в) C4H8 и C7H16 г) CH4 и C6H10
C3H8
и С5H12
Слайд 8
Определите формулы алканов:
а) C5H10
б) C2H2
в)
C7H16 г) C3 H8
Ответ:
В,Г
Слайд 9
Строение алканов
Первое валентное состояние атома углерода
Невозбужденный атом
углерода
Возбужденный атом углерода
Слайд 10
Гибридизация -
«перемешивание»
электронных облаков
Слайд 11
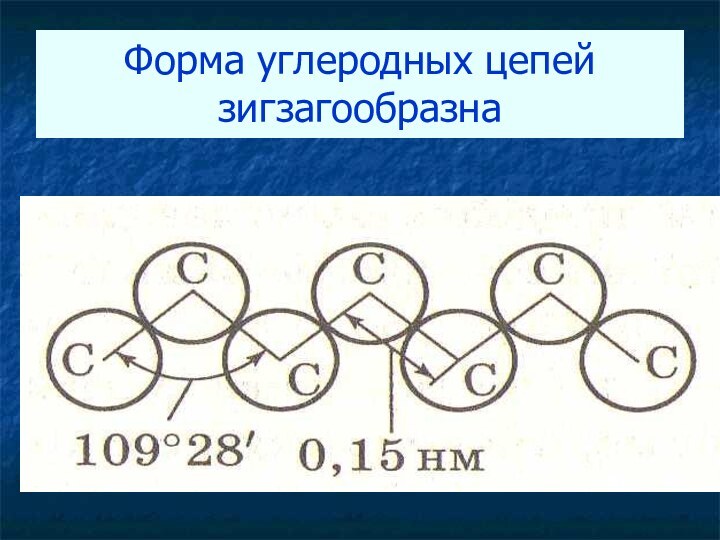
Форма углеродных цепей зигзагообразна
Слайд 13
Изображение молекул алканов на плоскости- формулы строения
Длина связи
С-С равна 0,15 нм
Слайд 14
ИЗОМЕРЫ
ЭТО ВЕЩЕСТВА, ИМЕЮЩИЕ
ОДИНАКОВЫЙ КАЧЕСТВЕННЫЙ СОСТАВ,
СХОДНЫЕ
ХИМИЧЕСКИЕ СВОЙСТВА, НО
РАЗНОЕ СТРОЕНИЕ И
РАЗЛИЧАЮЩИЕСЯ ПО ФИЗИЧЕСКИМ СВОЙСТВАМ
Слайд 15
Сколько углеводородов изображено формулами?
Ответ :а)один б)два в)
три г) четыре
Один ; это бутан
Слайд 16
Номенклатура алканов
Назовем алкан -
1.Выбираем самую длинную цепь
атомов углерода и
нумеруем ,начиная с того конца, к
которому ближе
разветвление :
Слайд 17
2.В начале названия перечисляют радикалы и другие заместители
с указанием номеров атомов углерода, с которыми они связаны
CH3-метил,
C2H5-
этил,
Cl - хлор;
Если их несколько, то цифрой указывают место каждого в главной цепи и перед названием ставят частицы : ди- (2),три - (3), тетра -(4).
3. Основа названия - наименование алкана в главной цепи
Слайд 19
Назовем алкан:
1
2
3
4
5
2,4- диметилпентан
Слайд 20
Название углеводорода с формулой:
А)2,2,4-триметилгексан
Б)5,5-диметил-3этилгексан
В)2-диметил-4 этилгексан
Г)2,2-диметил-4 этилгексан
Слайд 21
Свойства алканов
Физические
химические
С1- С4 - газы
С5- С17 -
жидкости
с запахом бензина
начиная с С 18 -
твердые
вещества
(парафины)
У алканов сигма-связи прочны,
насыщенны, поэтому при н.у.
предельные углеводороды
пассивны
2. Поэтому для них нехарактерны
реакции присоединения,
а характерны реакции
свободно-радикального
замещения
Слайд 22
Химические
превращения алканов обусловлены:
1. Разрывом цепи углеродных атомов.
2.
Отрывом атомов водорода с последующим замещением их в соединении
другими атомами или группами атомов
Слайд 23
Галогенирование -радикальное замещение водорода на галоген
(хлорирование и бромирование
происходит под действием солнечного света, УФ-излучения, при нагревании до
300-500градусов; фторирование и йодирование не призводят: фтор реагирует со взрывом, йод- слишком медленно)
Эти реакции протекают по механизму
цепных радикальных реакции.
Николай Николаевич Семенов (Россия)
в 1956 получил Нобелевскую премию
за изучение механизма протекания таких реакций
Слайд 24
2. Нитрование - замещение водорода на нитрогруппу
(реакция Коновалова)
CH4 + HNO3→CH3 - NO2 + H2O
Коновалов
«оживил химических мертвецов», действуя раствором азотной кислоты на алканы при температуре +140 градусов
Замещение атома водорода у гомологов метана ,
так же как и при бромировании,
в первую очередь замещается атом водорода у
третичного атома углерода, затем - у вторичного, и в
последнюю очередь - у первичного
Слайд 25
3. Изомеризация
Использование хлорида алюминия при нагревании
вызывает
превращение алканов с нормальной
цепью в их изомеры с
разветвленной цепью.
Этот процесс называют изомеризацией
Бутан
2-метилпропан, или изобутан
Слайд 26
4.Крекинг -
разрыв связей С - С , происходит
при температуре свыше 400 градусов без доступа воздуха, в
присутствии катализаторов
C8H18→ C4H8 + C4H10
алкен алкан
Слайд 27
5. Дегидрирование -
отщепление водорода; происходит при разных температурах
(от300 до 600град.),на разных катализаторах:
Ni, Pd, Pt, Cr2O3
В
зависимости от этого образуются разные продукты
Слайд 28
6. Риформинг (ароматизация)
Если алкан содержит шесть или более
атомов углерода,
то дегидрирование может сопровождаться замыканием
цикла с образованием
бензола или его гомологов
Слайд 29
7. Горение
Cn H2n +2 +
(3 n + 1)/2 O2
→ n CO2↑ + (n +1)H2O + Q
Слайд 30
8.Конверсия метана
CH4 + H2O катализатор, температура→CO+3H2
синтез-газ
Слайд 31
9.Каталитическое окисление бутана, метана
Слайд 32
Синтезы алканов
Природными источниками
алканов (предельных
углеводородов) являются:
нефть,
газ и горный воск.
Химики открыли способы синтеза
алканов →
Слайд 33
1. Гидрирование непредельных углеводородов
(промышленный способ)
(гидрированием называют реакции
присоединения водорода по кратным связям); происходит в присутствии катализаторов
(Ni, Pd), повышенного давления и при нагревании
CH2 = CH2 + H2→ CH3 - CH3
Слайд 34
2. Реакция Фишера -Тропша
(промышленный способ)
Смесь предельных углеводородов
от С6
до С12 под названием
синтетический бензин
получают из синтез-газа при использовании катализаторов Co,Fe,Ni в интервале температур от170 до 330 градусов:
CO + H2 → Cn H2n + 2 + H2O
Слайд 35
3. Реакция Вюрца
(лабораторный способ)
В 1855 г французский химик
Ш.А.Вюрц разработал способ синтеза алканов путем нагревания галогеналканов с
металлами (натрием, цинковой пылью):
2CH3CH2Br +2Na →
CH3CH2CH2CH3 + 2NaBr
Слайд 36
4. Реакция Дюма -
декарбоксилирование солей карбоновых кислот
Эта реакция
протекает при нагревании смеси порошков соли карбоновой кислоты и
гидроксида натрия и сопровождается отщеплением группы -COONa от молекулы соли. в молекуле образовавшегося алкана остается на один атом углерода меньше, чем в молекуле исходной соли:
CH3CH2COONa + NaOH t→
CH3CH3 + Na2CO3
Слайд 37
5. Реакция Кольбе-
электролиз расплавов солей карбоновых кислот
В ходе
электролиза на аноде анионы CH3COO- окисляются до радикалов CH3COO•
, которые распадаются с образованием радикалов СН3∙ и углекислого газа СО2. Радикалы СН3∙ соединяются попарно, и образуется молекула симметричного алкана:
2СН3СOONa +2H2O→эл-из
CH3CH3 + 2CO2 + 2NaOH + H2
Слайд 38
6.Синтез метана из простых веществ
При нагревании углерода в
атмосфере водорода при температуре 400-500 градусов и повышенном давлении
в присутствии катализатора образуется метан:
C + 2 H2 → CH4
Слайд 39
7.Гидролиз карбида алюминия
Al4 C3 + 12 H2O →4Al(OH)3+3CH4
На
карбид можно действовать не только водой, но и раствором
кислоты
Al4 C3 + 12 HCl→4AlCl3+3CH4
Другие алканы получить этим способом нельзя
Слайд 41
Контроль
1 Уровень. Воспроизведение знаний
1).Для вещества, имеющего строение
CH3-CH -
CH - CH3
⏐
⏐
CH3 CH3
составьте формулы одного гомолога и двух изомеров. Дайте им названия по систематической номенклатуре.
Слайд 42
2). Напишите уравнения реакций:
а) изомеризации бутана;
б)
горения пропана в кислороде; в) первой, второй и третьей
стадий хлорирования метана. Дайте названия всем продуктам реакции
Слайд 43
3). Решите задачу:
Какая масса сажи образуется
при разложении метана
массой 24 ?
Массовая доля выхода продукта составляет 96%.
Слайд 44
4). Решите задачу:
Найдите молекулярную формулу углеводорода, если
массовая доля углерода в нем равна 80%, плотность вещества
по водороду равна 15.
Слайд 45
2 уровень. Применение знаний по образцу, в знакомой
ситуации
1) Дано вещество - 2 метилбутан. Составьте формулу по
названию, приведите по одному примеру гомолога и изомера и дайте им названия по систематической номенклатуре
Слайд 46
2) Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
CH4→CH3 Cl→C2H6→C2H5Br
Слайд 47
3) Решите задачу:
При термическом разложении метана количеством вещества
14 моль получен ацетилен (С2Н2) ,объем которого при н.у.
составляет 120,96 л. Вычислите объемную долю(%) выхода ацетилена.
Слайд 48
4). Решите задачу:
Найдите молекулярную формулу углеводорода, содержащего по
массе 85,7% углерода и 14,3% водорода. Плотность вещества по
водороду равна 28. относится ли этот углеводород к предельным?
Слайд 49
3 уровень. Умение применять полученные знания в новой
ситуации
1) Напишите уравнения реакций, с помощью которых можно осуществить
следующие цепочки превращений:
Al4C3→+HOH X1→ +Cl2,светX2 →+2K →X3
CH3COONa(безводн) +NaOH,тв,сплав→X1 →CH3Cl →C2H6
CH3COONa → CH4 → t=1500 X4
Назовите продукты Х1 - Х4.
Слайд 50
2) Хлорэтан - газ, легко превращающийся в жидкость,
которая при быстром испарении охлаждает кожу,что используют для местной
анестезии при легких операциях.
Составьте уравнение реакции получения хлорэтана из этана.
Слайд 51
3) В качестве хладагента в холодильниках наиболее широко
используется дифтордихлорметан (фреон-1)- газ, легко переходящий в жидкое состояние.
Составьте структурную и электронную формулы дифтордихлорметана
Слайд 52
4) Решите задачу:
При сгорании вещества массой 1,5 г
образовались оксид углерода (IV) массой 4,4 г и вода
массой 2,7 г. Относительная плотность паров вещества по воздуху равна 1,03. Установите молекулярную формулу данного вещества.
Слайд 53
Ответы
I уровень
№ 3 -17,28 г
№ 4 -
C2H6
II уровень
№ 3 - 77,14%
№ 4 - C4H8
III уровень
№
1 - X1 - CH4 , X2- CH3Cl , X3 -CH4 ,X4-C2H2
№ 2 - CH3Cl , №3 - CF2-CCl2 №4 -C2H6