- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Ортофосфорная кислота
Содержание
- 2. История открытия и получения фосфорной кислоты
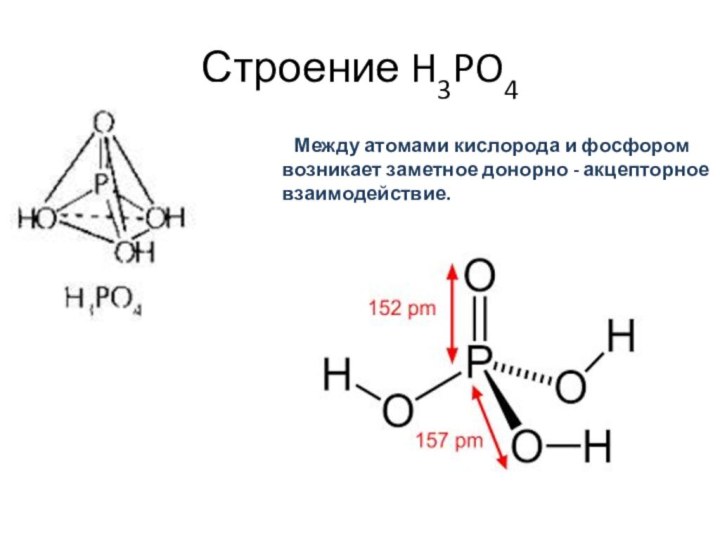
- 3. Строение H3PO4 Между атомами кислорода и фосфором возникает заметное донорно - акцепторное взаимодействие.
- 4. Физические свойстваТвердое прозрачное кристаллическое вещество;Гигроскопичное;Хорошо растворимое в
- 5. Ортофосфорная кислота Н3РО4 образует три ряда солей:
- 6. 3) Кислые-гидрофосфаты- СаНРО4 Гидрофосфаты малорастворимы в воде
- 7. Химические свойстваН3РО4 проявляет все свойства кислот Реагирует:
- 8. Химические свойства Фосфаты всех металлов
- 9. Химические свойства Некоторые реакции с
- 10. Специфические свойстваПри нагревании постепенно превращается в метафосфорную
- 11. Качественная реакция на фосфат-ион РО43-
- 12. Диссоциация солей фосфораNa3PO4-фосфат натрия
- 13. Получение фосфорной кислоты1) Фосфорную кислоту получают из
- 14. ПрименениеОсновная область использования - производство фосфорных и
- 15. Скачать презентацию
- 16. Похожие презентации
История открытия и получения фосфорной кислоты Фосфорную кислоту открыл Р. Бойль с помощью индикаторов. Сжигая фосфор и растворяя образовавшийся белый продукт в воде он получил неизвестную химикам кислоту. По исходному веществу он назвал














Слайд 3
Строение H3PO4
Между атомами кислорода и фосфором
возникает заметное донорно - акцепторное взаимодействие.
Слайд 4
Физические свойства
Твердое прозрачное кристаллическое вещество;
Гигроскопичное;
Хорошо растворимое в воде
в любых соотношениях;
Трехосновная кислота средней силы;
T°пл.= 42°С;
p = 1,88
г/см3;Окислительные свойства не проявляет.
Слайд 5
Ортофосфорная кислота Н3РО4 образует три ряда солей:
1) Средние соли, или
фосфаты - Са3 (РО4)3Фосфаты нерастворимы в воде, кроме фосфатов щелочных металлов .
2) Кислые, или дигидрофосфаты- Са(Н2РО4)2
Большинство дигидрофосфатов хорошо растворимы в воде.
Слайд 6
3) Кислые-гидрофосфаты- СаНРО4
Гидрофосфаты малорастворимы в воде (кроме
фосфатов натрия, калия и аммония), т.е. занимают промежуточное положение
между фосфатами и дигидрофосфатами по растворимости.Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.
Слайд 7
Химические свойства
Н3РО4 проявляет все свойства кислот
Реагирует:
с
щелочами: NaOH, КОН
H3PO4 + 3NaOH = Na3PO4 + 3H2OH3PO4 + 3KOH = K3PO4 + 3H2O
с основными оксидами: Li2O, Na2O
2H3PO4 + 3Li2O = 2Li3PO4 + 3H2O
2H3PO4 + 3Na2O = 2Na3PO4 + 3H2O
c солями: К2СО3
2H3PO4 + 3K2CO3 = 2K3PO4 + 3H2CO3
с металлами не реагирует
Слайд 8
Химические свойства
Фосфаты всех металлов (кроме
щелочных металлов) нерастворимы, т.к. на поверхности этих металлов образуется
нерастворимая пленка, препятствующая их дальнейшему растворению в кислоте.Щелочные металлы при растворении в кислоте, начинают взаимодействовать с водой.
Слайд 9
Химические свойства
Некоторые реакции с металлами
протекают в очень разбавленных растворах:
2Н3РО4 (разб.) + 3Мg
= Мg3(РО4)2↓ + 3Н2↑
Слайд 10
Специфические свойства
При нагревании постепенно превращается в метафосфорную кислоту:
2H3PO4 = H4P2O7 + H2О
2) Ортофосфорная кислота играет большую
роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты - АТФ. При разложении АТФ выделяется большое количество энергии.
Слайд 11
Качественная реакция на фосфат-ион РО43-
Реактивом
на фосфорную кислоту и растворимые фосфаты является раствор нитрата
серебра, при взаимодействии с которым образуется осадок Ag3РО4РО43- + 3 Ag+ = Ag3РО4 ↓
Однако в отличие от AgBr и AgI этот осадок растворяется при добавлении раствора кислоты.
Слайд 12
Диссоциация солей фосфора
Na3PO4-фосфат натрия
Na3PO4=
3Na+ + PO43- (одна ступень диссоциации)
Na2HPO4-гидрофосфат натрия
Na2HPO4 = 2Na+
+ HPO42- (первая с.д.)HPO42- = H+ + PO43- (вторая с.д.)
NaH2PO4 – дигидрофосфат натрия
NaH2PO4 = Na+ + H2PO4- (первая с.д.)
H2PO4- = H+ + HPO42- (вторая с.д.)
HPO42- = H+ + PO43- (третья с.д.)
Вывод: Каждая последующая ступень диссоциации протекает в меньшей степени, чем предыдущая.





























