- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Факторы, влияющие на скорость химических реакций
Содержание
- 2. Цель урока:Сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.
- 3. Задачи:1. Исследовать факторы, влияющие на скорость химических
- 4. Методы и методологические приёмы: Диалогический метод изложения
- 5. Средства обучения:- инструкция для выполнения лабораторного эксперимента;-
- 6. Подготовка учащихся к уроку.1. Деление класса на
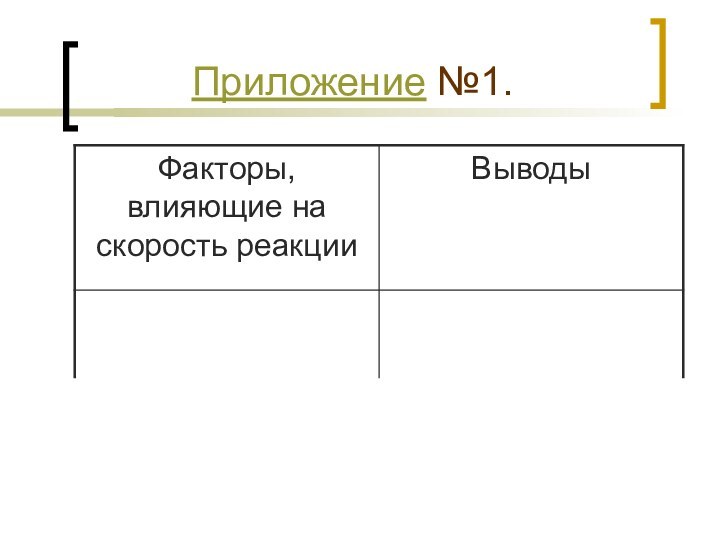
- 7. Приложение №1.
- 8. 3.Группа получает оборудования и реактивы для проведения эксперимента.4. Каждый учащийся получает рабочую карту урока (Приложение №2).
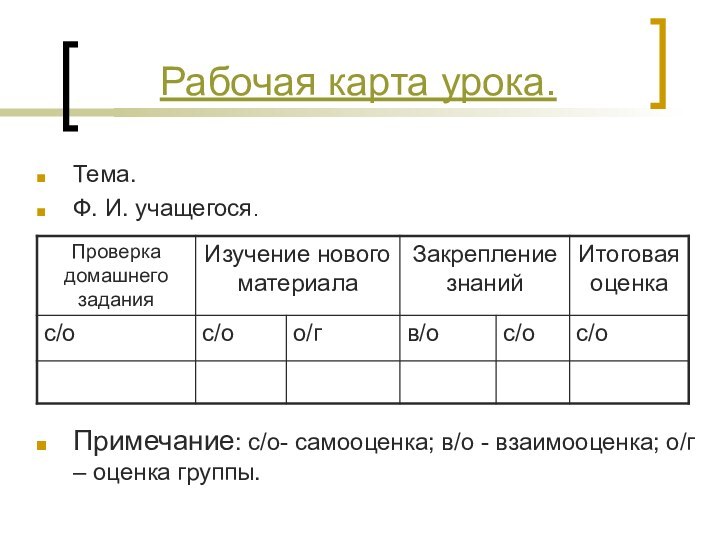
- 9. Тема.Ф. И. учащегося.Примечание: с/о- самооценка; в/о - взаимооценка; о/г – оценка группы.Рабочая карта урока.
- 10. Структура урока.1. Организационный этап.2. Актуализация знаний (фронтальная
- 11. ХОД УРОКА.I. Организационный этап.II. Актуализация знаний.
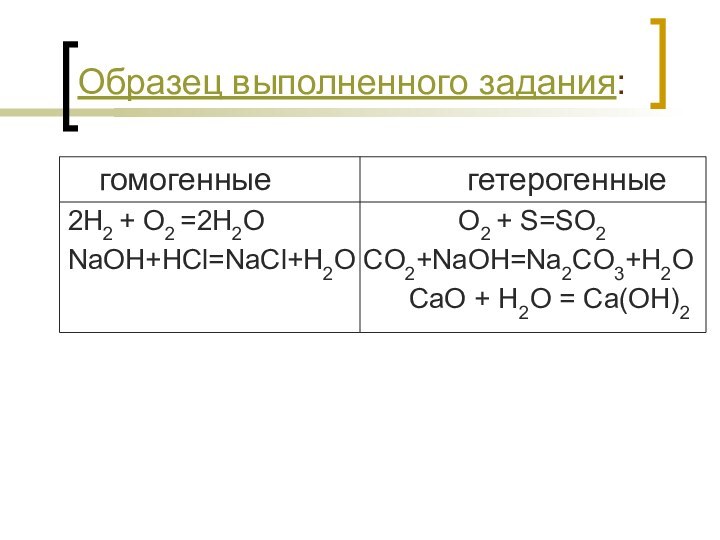
- 12. Образец выполненного задания:гомогенные
- 14. IIIIII. Изучение нового материала.Тема урока: «Факторы,
- 15. Правило Я. Вант-ГоффаV2/V1=γt2-t1/10Я. Вант-Гофф (1852 -1911). Голландский химик. Один из основателей физической химии и стереохимии
- 16. Закон действующих масс.Гульдберг (1836-1902). Норвежский физикохимик.П. Вааге (1833-1900). Норвежский ученый.V=kcAacBb
- 17. IVIV. Закрепление знаний (работа в группах, тестирование).Задачи на применение правила Вант-Гоффа и закона действующих масс
- 18. Образцы решенныхОбразцы решенных задач I I группа. N2+3H2=2NH3V=k·CN2·CH23V2=k·3CN2·(3CH2)3=81·kCN2CH23V2/V1=81·kCN2CH23/kCN2CH23=81V2=81V1
- 19. IIII группаII группа. V2/V1=j(to2-to1) /10 V2/V1=3 (80о-20о) /10оV2/V1=36V2=729 V1
- 20. III III группа. V2/V1=j(to2-to1) /10 V2/V1=3 (200о -150о) /10оV2/V1=35 V2=243 V1
- 21. IV IV группа.H2 + Cl2= 2HCl V1
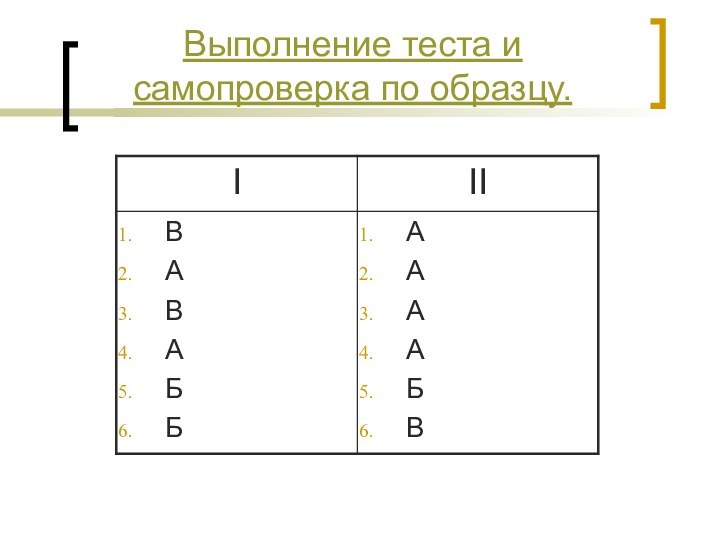
- 22. Выполнение теста и самопроверка по образцу.
- 23. VV.V. V. Рефлексия (самооценка). Каждый учащийся выставляет
- 24. Скачать презентацию
- 25. Похожие презентации
Цель урока:Сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.




















Слайд 2
Цель урока:
Сформировать у учащихся знания о факторах, влияющих
на скорость химических реакций.
Слайд 3
Задачи:
1. Исследовать факторы, влияющие на скорость химических реакций
и механизм их выполнения;
2. Продолжить развитие умений устанавливать причинно-следственные
связи, проводить эксперимент, развивать умения осуществлять самоконтроль и взаимоконтроль;3. Воспитывать интерес к учению, личностные качества, обеспечивающие успешность в творческой деятельности.
Слайд 4
Методы и методологические приёмы:
Диалогический метод изложения знаний
с элементами исследования, выполнения демонстрационного и лабораторного эксперимента, работа
в группах, фронтальная беседа, тестирование, самопроверка и взаимопроверка
Слайд 5
Средства обучения:
- инструкция для выполнения лабораторного эксперимента;
- инструкция
по технике безопасности;
- демонстрационное оборудование;
- лабораторное оборудование;
- рабочая карта
урока;- тесты;
- компьютер;
- проектор.
Слайд 6
Подготовка учащихся к уроку.
1. Деление класса на группы
по 5 человек (в каждой группе есть учащийся с
прочными глубокими знаниями).2. В тетрадях у учащихся приготовлена таблица, которая заполняется во время объяснения нового материала (Приложение №1).
Слайд 8
3.Группа получает оборудования и реактивы для проведения эксперимента.
4.
Каждый учащийся получает рабочую карту урока (Приложение №2).
Слайд 9
Тема.
Ф. И. учащегося.
Примечание: с/о- самооценка; в/о - взаимооценка;
о/г – оценка группы.
Рабочая карта урока.
Слайд 10
Структура урока.
1. Организационный этап.
2. Актуализация знаний (фронтальная форма
работы)
3. Изучение нового материала.
4. Закрепление знаний (работа в группах,
тестирование)5. Рефлексия (самооценка).
6. Домашнее задание.
Слайд 11
ХОД УРОКА.
I. Организационный этап.
II. Актуализация знаний.
Примеры реакций.
Гомогенные
Гетерогенные газ + газ газ + твёрдое вещ-во
жидкость + жидкость газ + жидкость
тв. вещество + жидкость
Слайд 12
Образец выполненного задания:
гомогенные
гетерогенные
2H2 + O2 =2H2O
O2 + S=SO2NaOH+HCl=NaCl+H2O CO2+NaOH=Na2CO3+H2O
CaO + H2O = Ca(OH)2
Слайд 13
Таблица №2.
Рабочая карта урока.«5» - все примеры составлены верно, «4» - 1 ошибка, «3» - 2 ошибки, больше ошибок – не оцениваем.
Самооценка выполненной работы.
Слайд 14
IIIIII. Изучение нового материала.
Тема урока: «Факторы, влияющие
на скорость химических реакций».
Лабораторный эксперимент.
Лабораторный опыт №1. Зависимость скорости
химической реакции от природы реагирующих веществ.Лабораторный опыт №2. Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ.
Лабораторный опыт №3. Влияние температуры на скорость.
Лабораторный опыт №4. Влияние концентрации исходных веществ на скорость.
Слайд 15
Правило Я. Вант-Гоффа
V2/V1=γt2-t1/10
Я. Вант-Гофф (1852 -1911). Голландский химик.
Один из основателей физической химии и стереохимии
Слайд 16
Закон действующих масс.
Гульдберг (1836-1902). Норвежский физикохимик.
П. Вааге (1833-1900).
Норвежский ученый.
V=kcAacBb
Слайд 17
IVIV. Закрепление знаний (работа в группах, тестирование).
Задачи на
применение правила Вант-Гоффа и закона действующих масс
Слайд 18
Образцы решенныхОбразцы решенных задач
I I группа.
N2+3H2=2NH3
V=k·CN2·CH23
V2=k·3CN2·(3CH2)3=81·kCN2CH23
V2/V1=81·kCN2CH23/kCN2CH23=81
V2=81V1
Слайд 21
IV IV группа.
H2 + Cl2= 2HCl
V1 =
kCH2·CCl2
V2 = k·(4CH2) ·1/2 CCl2
V2 = 2kCH2·CCl2
V2/V1= 2k·CH2·CCl2 /kCH2·CCl2
V2/V1=2
V2
=2 V1
Слайд 23
VV.V. V. Рефлексия (самооценка).
Каждый учащийся выставляет себе итоговую
оценку за урок в рабочей карте и отвечает на
вопрос :Что удалось и что не удалось на уроке?Каждый учащийся получил оценку на всех этапах урока и в целом за урок.
Итоговые оценки:
«5» - 7,
«4» - 12,
«3» - 2





























