- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Алюминий
Содержание
- 2. Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,9815Порядковый номер. Химический элемент III группы главной подгруппы 3-го периода.
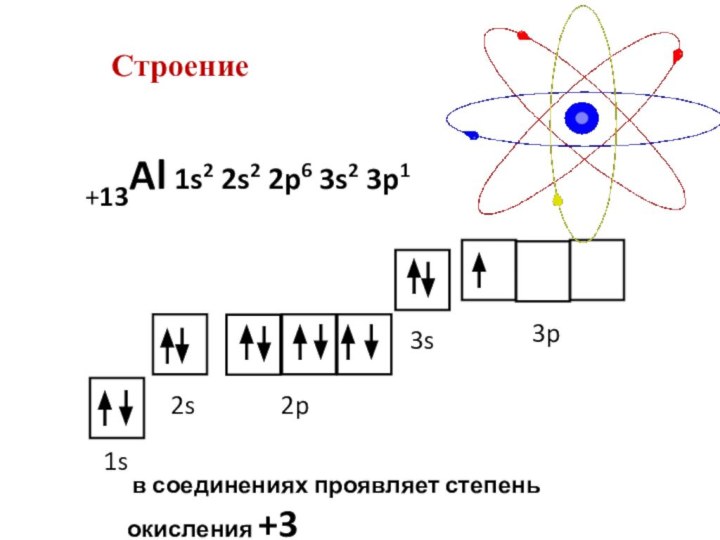
- 3. Строение+13Al 1s2 2s2 2p6 3s2 3p11s2s2p3s3p в соединениях проявляет степень окисления +3
- 4. История открытияВяжущие вещества, содержащие алюминий, известны с
- 5. История открытияПосле открытия с помощью гальванического электричества
- 6. Физические свойства простого вещества Al – серебристо-белый металл,
- 7. Химические свойства (с простыми веществами)При
- 8. Химические свойства (со сложными веществами):Алюминий растворяется в
- 9. Химические свойства (со сложными веществами):3. Алюминий при
- 10. Химические свойства (со сложными веществами):4.Так как алюминий
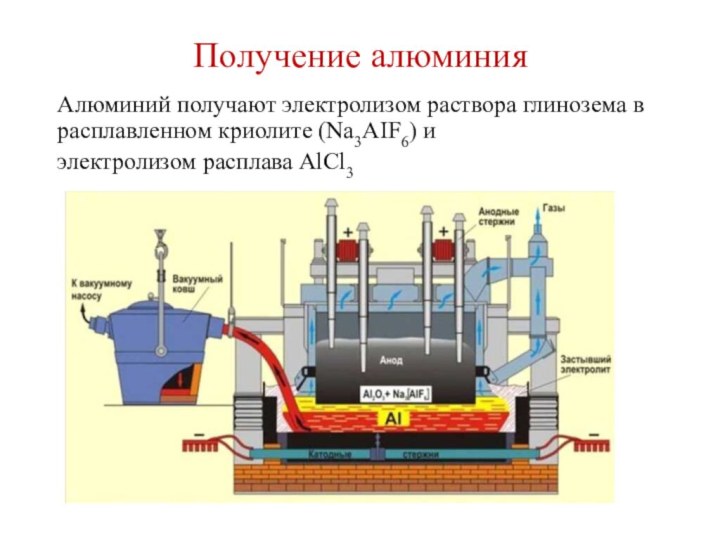
- 11. Получение алюминияАлюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) иэлектролизом расплава AlCl3
- 12. Процесс электролиза проводят в аппаратах, катодом в
- 13. Применение AlАлюминий – самый распространенный металл
- 14. Соединения алюминия В природе алюминий
- 15. Оксид алюминия Al2О3:Очень твердый (корунд, рубин)в кристаллическом
- 16. Гидроксид алюминия Al(ОН)3:Белый нерастворимый в воде порошок.Проявляет
- 17. Скачать презентацию
- 18. Похожие презентации
Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,9815Порядковый номер. Химический элемент III группы главной подгруппы 3-го периода.















Слайд 2
Al
13
Алюминий
(лат. (лат. Aluminium(лат. Aluminium)
3
8
2
26,9815
Порядковый номер. Химический
элемент III группы главной подгруппы 3-го периода.
Слайд 4
История открытия
Вяжущие вещества, содержащие алюминий, известны с глубокой
древности. Однако под квасцами (лат. Alumen или Alumin, нем.
Alaun), о которых говорится, в частности, у Плиния, в древности и в средние века понимали различные вещества. В "Алхимическом словаре" Руланда слово Alumen с добавлением различных определений приводится в 34 значениях.
Слайд 5
История открытия
После открытия с помощью гальванического электричества щелочных
металлов Дэви и Берцелиус безуспешно пытались выделить тем же
путем металлический алюминий из глинозема. Лишь в 1825 г. задача была решена датским физиком Эрстедом химическим способом. Он пропускал хлор через раскаленную смесь глинозема с углем, и полученный безводный хлористый алюминий нагревал с амальгамой калия. После испарения ртути, пишет Эрстед, получался металл, похожий по внешнему виду на олово. Наконец, в 1827 г. Велер выделил металлический алюминий более эффективным способом - нагреванием безводного хлористого алюминия с металлическим калием.Около 1807 г. Дэви, пытавшийся осуществить электролиз глинозема, дал название предполагаемому в нем металлу алюмиум (Alumium) или алюминум (Aluminum). Последнее название с тех пор ужилось в США, в то время как в Англии и других странах принято предложенное впоследствии тем же Дэви название алюминиум (Aluminium).
Эрстед
Велер
Слайд 6
Физические свойства простого вещества
Al – серебристо-белый металл, пластичный,
легкий, хорошо проводит тепло и электрический ток, обладает хорошей
ковкостью, легко поддаётся обработке, образует лёгкие и прочные сплавы. Легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм.ρ=2,7 г/см3
tпл.=6600С
Слайд 7
Химические свойства (с простыми веществами)
При обычной температуре
реагирует с Cl2, Br2, при нагревании – с F2,
I2, S, C, N2; с H2 непосредственно не реагирует.4Al+3O2 = 2Al2O3
Поверхность покрывается пленкой оксида, в мелкораздробленном виде горит с выделением большого количества теплоты.
2. 2Al + 3Cl2 = 2 AlCl3
2Al + 3I2 = 2 AlI3
3. 2Al + 3S = Al2S3 - при нагревании
4. 4Al + 3С = Al4С3 - при нагревании
Слайд 8
Химические свойства (со сложными веществами):
Алюминий растворяется в растворах
кислот
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4
= Al2(SO4)3 + 3H2Al + 4HNO3 = Al(NO3)3 + NO + 2H2O
Концентрированная серная и азотная
кислоты пассивируют алюминий.
2. Алюминий реагирует с растворами солей менее активных металлов
2Al + 3СuCl2 = 2AlCl3 + 3Cu
Слайд 9
Химические свойства (со сложными веществами):
3. Алюминий при высокой
температуре реагирует с оксидами менее активных металлов (Алюминотермия –
получение металлов: Fe, Cr, Mn, Ti, W и других, путем их восстановления алюминием)8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 10
Химические свойства (со сложными веществами):
4.Так как алюминий –
амфотерный металл, он реагирует с растворами щелочей.
При
этом образуется тетрагидроксоалюминат натрия и выделяется водород:2Al + 2NaOH + 6H2O = 2Na[Al(OH)4]+3H2
5. При удалении оксидной пленки с поверхности алюминия, он реагирует с водой с образованием гидроксида алюминия и водорода:
2Al + 6H2O = 2Al(OH)3 +3H2
Слайд 11
Получение алюминия
Алюминий получают электролизом раствора глинозема в расплавленном
криолите (Na3AIF6) и
электролизом расплава AlCl3
Слайд 12 Процесс электролиза проводят в аппаратах, катодом в которых
является подина ванны, а анодом – предварительно обожженные угольные
блоки или самообжигающиеся электроды, погруженные в расплавленный электролит.Электролиз Al2O3 можно представить следующей схемой:
в расплаве оксид алюминия диссоциирует:
Al2O3 = Al3+ + AlO33-,
на катоде восстанавливаются ионы Al3+:
Al3+ +3е = Al0,
на аноде окисляются ионы AlO33-:
4AlO33- - 12е = 2Al2O3 + 3O2,
Суммарное уравнение процесса:
2Al2O3 = 4Al + 3O2.
Жидкий алюминий собирается на дне электролизера.
Получение
Слайд 13
Применение Al
Алюминий – самый распространенный металл земной
коры. Его ресурсы практически неисчерпаемы.
Обладает высокой коррозионной стойкостью и
практически не нуждается в специальной защите.Высокая химическая активность алюминия используется в алюминотермии.
Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроении и способствует расширению его применения в наземном и водном транспорте, а также в строительстве.
Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.
Слайд 14 Соединения алюминия В природе алюминий встречается только в
виде соединений и по распространенности в земной коре занимает
первое место среди металлов и третье – среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет 8,8 % по массе.
Слайд 15
Оксид алюминия Al2О3:
Очень твердый (корунд, рубин)в кристаллическом состоянии,
порошок белого цвета, тугоплавкий - 20500С.
Не растворяется в
воде.Амфотерный оксид, взаимодействует:
а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O
Слайд 16
Гидроксид алюминия Al(ОН)3:
Белый нерастворимый в воде порошок.
Проявляет амфотерные
свойства, взаимодействует:
а) с кислотами Al (OH)3 + 3HCl =
AlCl3 + 3H2Oб) со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2O
Разлагается при нагревании
2Al (OH)3 = Al2O3 + 3H2O
Образуется:
а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка)
Al3+ + 3OH- = Al (OH)3
б) при взаимодействии алюминатов с кислотами (без избытка)
AlO-2 + H+ + H2O = Al (OH)3