Слайд 2
"Немає абстрактного учня. Мистецтво та майстерність
навчання й виховання полягає в тому, щоб
розкрити сили та можливості кожної дитини, дати їй радість успіху в розумовій праці."
(В. Сухомлинський.)
Слайд 3
Особистісно зорієнтовані технології сприяють збагаченню і розвитку творчого
потенціалу як вчителя так і учня, розкриттю здібностей дитини,
бажання і уміння вчитися, творити, відчувати радість пізнання. Саме при використанні особистісно зорієнтованої технології учні вчаться шукати інформацію, систематизувати її та узагальнювати.
Слайд 4
Особистісно зорієнтоване навчання –це органічне поєднання навчання та
індивідуально значимої діяльності людини, її життєвого досвіду.
Слайд 5
Мета особистісно зорієнтоване навчання
- це органічне
поєднання навчання та індивідуально значимої діяльності людини,її життєвого досвіду.
Слайд 6
Головним завданням вчителя є
створення на уроці
ситуації для роздумів, міркувань, досліджень, не заважати допитливості учнів,
не перетворювати процес навчання на завантаження пам’яті великою кількістю правил, формул, термінів.
Слайд 7
Технологія особистісно орієнтованого уроку, за С.І. Подмазіним, передбачає,
що учень, перетворюючись на суб’єкта навчальної діяльності, має оволодіти
основними етапами діяльності: орієнтація → визначення мети → проектування → організація → реалізація → контроль → корекція → оцінка .
Слайд 8
Без чого не можливий особистісно зорієнтований урок?
без
врахування індивідуальних особливостей учнів класа;
без використання суб'єктивного досвіду учнів;
без
самостійного цілепокладання;
без ситуації выбора, на всіх етапах, де це тільки можливо;
без чисельного дидактичного матеріалу;
без створення ситуації успіху;
без рефлексії;
Слайд 9
Створення ситуації успіху на уроці:
- Зняти страх («Це
просто», «Це легко», «Не вийшло – нічого страшного, попрацюєш
і обов’язково вийде»).
- Надавати приховану допомогу («Я вважаю, що краще почати з цього…», «Мені здається, що основне тут…»).
- Уміти авансувати особу («У тебе все вийде»).
- Використовувати прийом персональної винятковості («Саме ти…»).
- Зробити педагогічну оцінку результату («Ти це добре зробив», «Ось тепер вийшло чудово»).
Слайд 10
Девіз майстер - класа:
«Розкажи мені, і я забуду,
покажи мені, і я запам‘ятаю, дай спробувати, - і
я навчуся»
Китайська мудрість
Слайд 11
МОТИВАЦІЯ
МЕТОД.
"Знаємо – хочемо дізнатися - дізналися".
Наприклад тема уроку
в 7 класі:
Валентність хімічних елементі. Складання формул бінарних сполук
за валентністю елементів.
Слайд 12
Вправа “Мозковий штурм”
1. Умовний запис складу речовин за
допомогою хімічних символів та індексів.
2. Найменші хімічно неподільні
частинки речовини.
3.Цифра, яка показує число атомів у молекулі.
4.Число, що стоїть перед хімічною формулою в рівнянні.
5.Скільки атомів у молекулі речовини Н3Р04 ?
6.Атом якого елемента має відносну атомну масу, що дорівнює 14?
7.Назвіть елемент IІI періоду II групи.
8.Вид атомів з певним зарядом ядра.
Слайд 13
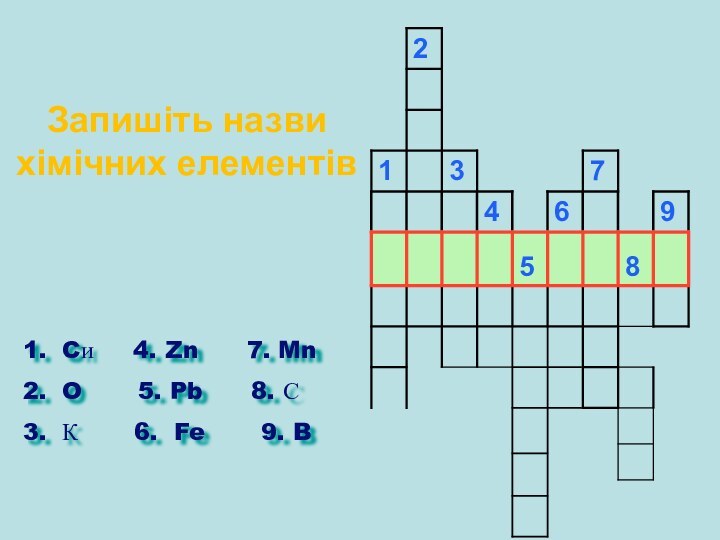
Запишіть назви хімічних елементів
Cи 4.
Zn 7. Mn
O 5.
Pb 8. С
К 6. Fe 9. B
Слайд 15
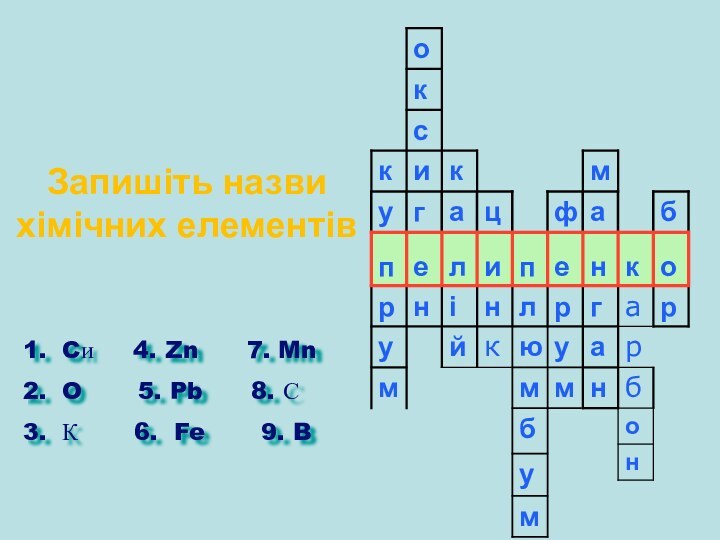
Запишіть назви хімічних елементів
Cи 4.
Zn 7. Mn
O 5.
Pb 8. С
К 6. Fe 9. B
Слайд 16
Встановити відповідність:
1.Са А.Силіций
2.Cl Б. Барій
3.Аl
В. Хлор
4.Si Г. Натрій
5.Ва Д.Кальцій
6.Na Е. Фосфор
7.Р Є.Алюміній
Слайд 17
Встановити відповідність:
1.Д
2.В
3.Є
4.А
5.Б
6.Г
7.Е
Слайд 18
Проаналізуйте хімічні формули:
О2, N2O, Cu2О, H2SO4, O3,
SO2, NO, SO3, H2SO3, CH4, C2H2, CuO
Згрупируйте речовини,
які мають однаковий якісний та різний кількісний склад.
Слайд 19
Проаналізуйте хімічні формули:
О2, O3,
N2O, NO,
Cu2O, CuO,
H2SO4, H2SO3,
SO2, SO3,
CH4,
C2H2.
Слайд 20
1. Прекрасні перлини, мармурові статуї, крейда, якою ми
пишемо, утворені цією речовиною, яка складається з 1 атома
Кальція, 1 атома Карбона, 3 атомів Оксигена.
Скласти формули речовин
Слайд 21
РІДИНА З РІЗКИМ СПЕЦИФІЧНИМ ЗАПАХОМ, ЗАСТОСОВУЄТЬСЯ ДЛЯ КОНСЕРВУВАННЯ
ОВОЧІВ, ЗАПРАВКИ САЛАТІВ. МОЛЕКУЛА ЇЇ СКЛАДАЄТЬСЯ З 2 АТОМІВ
КАРБОНА, 4 АТОМІВ ГІДРОГЕНА, 2 АТОМІВ ОКСИГЕНА. ЩО ЦЕ ЗА РЕЧОВИНА?
СКЛАСТИ ФОРМУЛУ.
Слайд 22
Як правильно прочитати формули:
CO2, CH4, H2SO4, 5NaCL, 3Al2O3,
2P2O5?
Слайд 23
Вивчення і закріплення теми уроку:
1. Знаючи валентність елементів,
написати формули їхніх сполук:
III І
I І ІІІ
РСІ, ZпO, СаСІ, МgВг, АgО, N Н, СО, КО,
III І II
СгСІ, Н S.
Слайд 24
Вивчення і закріплення теми уроку:
2. Написати формули сполук:
Nа, Сu(ІІ), Сu(І), Р(V), Са, Fе(ІІ), Fе(III), С(ІV):
а) із
Сульфуром; б) з Бромом (І).
Слайд 25
Підбиття підсумків уроку. Метод «Прес», формулюємо висновки
Актуалізаційні -Хто?
Що? Коли? Де ? Як?
Синтетичні - Який висновок ти
зробив? Які ти бачиш варіанти розв’язання проблеми?
Аналітичні - Які відмінності між…? Які складові цього явища?
Оцінювальні- Що є найголовнішим у …?
Яке розв’язання ти обрав би?
Прогностичні -Якою є твоя точка зору? Що може статися, якщо …?
Слайд 26
Рефлексія. Метод “Вільний мікрофон “
Я дізнався…
Я навчився…
Слайд 28
Зворотній зв’язок :
прийом " Все в
твоїх руках".
На аркуші паперу обведіть руку. Кожен палець -
якась позиція, з якої треба висловитися:
• "великий" - для мене було цікавим...
• "вказівний" - із цього питання я одержав конкретну допомогу...
• "середній" - мені не сподобалося...
• "безіменний" - моя оцінка ...
• "мізинець" - хотілося б...