Слайд 2
Загадка
Очень древний я металл,
Счёт столетьям потерял.
Был нескромным
я не в меру,
Тысячи лет до нашей эры.
А
за блеск, мерцавший холодом,
Люди там платили золотом!
Я давно в названии века,
В организме человека.
Называют мной характер,
Из меня почти весь трактор.
Очень в яблоке полезно,
И зовут меня …
Слайд 3
«Третий лишний».
Задание: Решите анаграммы и
исключите лишнее.
леруогд
иксолодр
ддрооов
золеже
углерод
кислород
водород
железо
Слайд 4
Охарактеризуйте Fe как химический элемент, составив предложения
со словами и словосочетаниями:
Порядковый номер, номер периода , группа,
подгруппа
Порядковый № 26, 4 период , VIII В группа
Заряд ядра, распределение электронов по уровням
Заряд ядра +26, распределение é 2, 8, 14, 2
Запомни!
Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
Слайд 5
Задание
Закончите электронно - буквенную формулу и нарисуйте графическую
формулу строения атома железа:
Железо(№ 131835)
Слайд 6
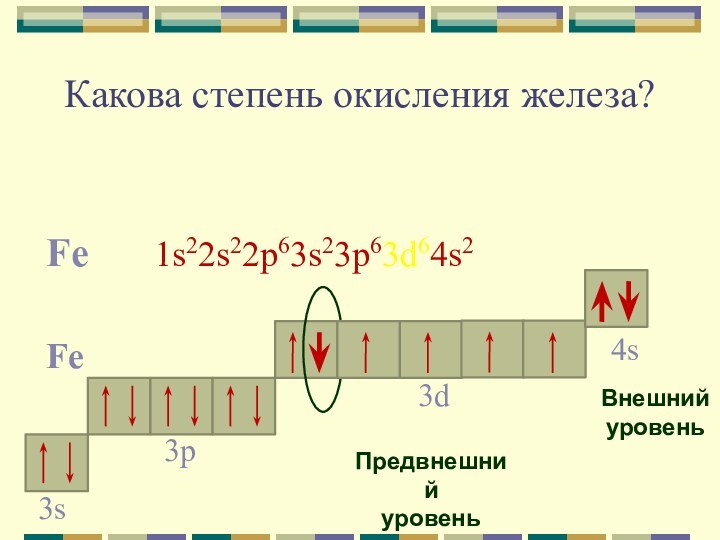
Какова степень окисления железа?
Fe 1s22s22p63s23p63d64s2
Fe
4s
Внешний
уровень
3d
Предвнешний
уровень
3p
3s
Слайд 7
Для железа характерны две основные степени окисления: +2,
+3.
Fe0 - 2e- = Fe+2
Fe0 - 3e- = Fe+3
Слайд 8
Задание: Рассмотрите образец металла (№ 131836). Опишите физические
свойства металла (№ 131797)..
Используя текст учебник, заполните таблицу:
металлический блеск
теплопроводность
электропроводность
пластичность и ковкость
магнетизм
Слайд 9
Выберите и запишите цифры только тех свойств, которые
не относятся к физическим свойствам железа:
Серебристо-белый металл
Металлический блеск
Самый твёрдый
металл
Tемпература плавления +1540 (№ 131769)
Пластичный
Легко режется ножом
Проводит электрический ток
Лёгкий
Проводит тепло
Легко намагничивается и размагничивается
Слайд 10
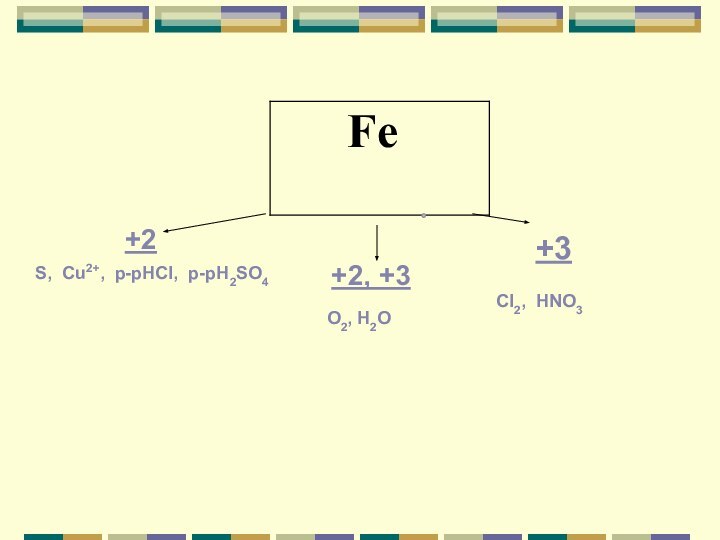
+2
+2, +3
+3
S, Cu2+, p-рHCI, p-рH2SO4
O2, H2O
CI2, HNO3
Слайд 11
Химические свойства железа
Взаимодействие железа с хлором Видеофрагмент (№
54490):
2Fe + 3Cl2 = 2FeCl3
Слайд 12
Химические свойства железа
Взаимодействие железа с кислородом:
Видеофрагмент (№
131824)
Fe + O2 =
Fe3O4
(FeO*Fe2O3)
3
2
Слайд 13
: Какие из реакций соответствуют схеме Fe+2
Fe+3
FeCI2 + CI2 = FeCI3
FeCI3 + NaOH =
Fe(OH)3 + 3NaCI
Fe(OH)2 + O2 + H2O = Fe(OH)3
Слайд 14
Задание: Расставить коэффициенты в уравнениях
1 и 3 методом электронного баланса, определить окислитель и
восстановитель в реакции.
Слайд 15
Нахождение в природе
В земной коре 5,1%
железа, 4 место после кислорода, кремния и алюминия.
По
запасам железных руд Россия занимает 1 место в мире.
Слайд 16
Нахождение в природе Метеоритное железо(№ 131727)
Запишите не
менее 4 -х формул соединений железа, встречающихся в природе
Слайд 17
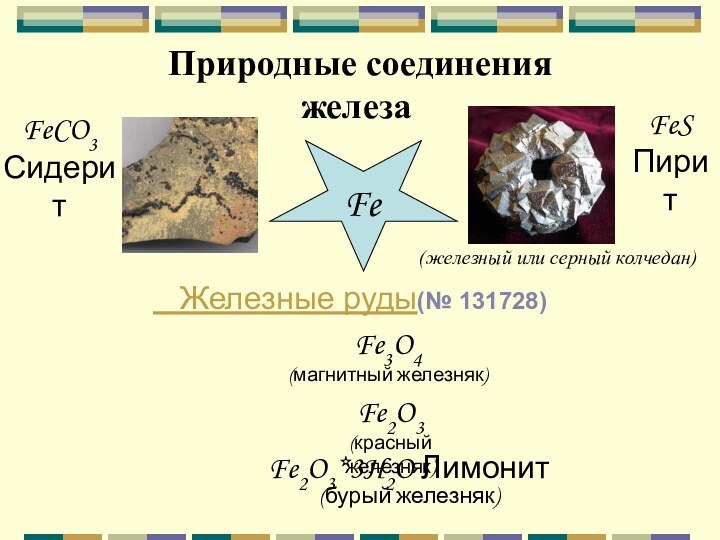
Природные соединения железа
Fe
FeS
Пирит
(железный или серный колчедан)
FeCO3
Сидерит
Fe2O3*3H2O Лимонит
(бурый
железняк)
Fe3O4
(магнитный железняк)
Fe2O3
(красный железняк)
Железные руды(№ 131728)
Слайд 18
Генетические связи Fe
- ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА
(II) (№ 131825)
- ОТ ЖЕЛЕЗА ДО ОКСИДА
ЖЕЛЕЗА (III) (№ 131874)
Пройдите, составив соответствующую схему реакций, от одного указанного в задании вещества к другому:
Слайд 19
ПРИМЕНЕНИЕ(№ 207382)
Чистое железо способно быстро намагничиваться и размагничиваться,
поэтому его применяют для изготовления трансформаторов, электромоторов и мембран
микрофонов. Основная масса железа на практике используется в виде сплавов – чугуна и стали.
Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов.
Слайд 20
Домашнее задание
§ 14, с. 76 -78 № 5
с. 82 - всем
№ 6 с. 83 (задача), по
желанию
Слайд 21
Используемая литература:
1. Горковенко М. Ю. Химия. 9 класс.
Поурочные разработки к учебнику О. С. Габриеляна (М.: Дрофа);
Интернет – ресурсы. www.catalogmineralov.ru – сайт содержит каталог минералов, большую коллекцию фотографий и описание минералов.
http://.elementy.ru – сайт « Элементы большой науки», содержит каталоги и статьи научно-популярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др.
http://www.ovitanah.com - сайт посвящен витаминам и микроэлементам, содержит интересную информацию.
http://alhimik.ru – сайт «Алхимик» содержит самую разнообразную информацию по химии.
«Химия, 9 класс». Электронная библиотека «Просвещение». ЗАО «Новый диск», 2005
Электронные учебные модули Открытых мультимедиасистем. http://www.mmlab.ru/omschemcat/10p0drazdel31.html
2.Единая коллекция цифровых образовательных ресурсов. Химия, 10 класс.
Flash-анимации:
Строение атома железа (№ 131835)
генетический ряд Fe+2(№ 131825)
генетический ряд Fe+3 (№ 131874)
Применение железа (№ 207382)