и пространственное распределение вероятности его нахождения в атоме системой
квантовых чисел.3. Электронные конфигурации атомов.
4. ПЗ Д.И. Менделеева.
5. Теории химической связи ( МВС и ММО).
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть































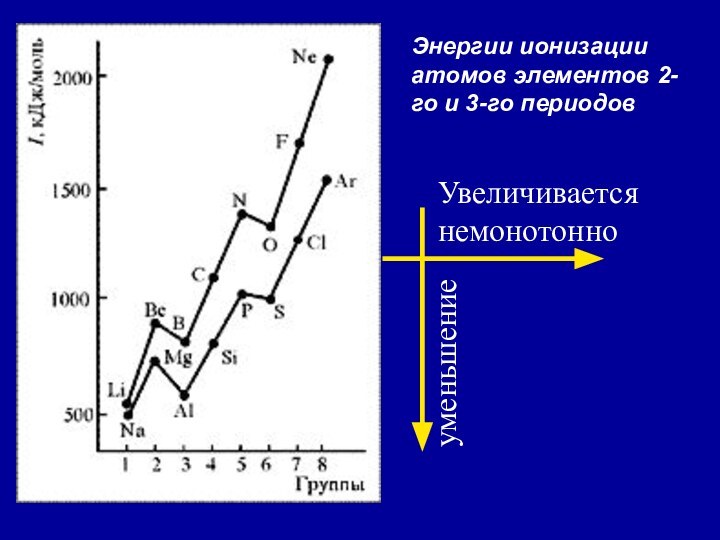
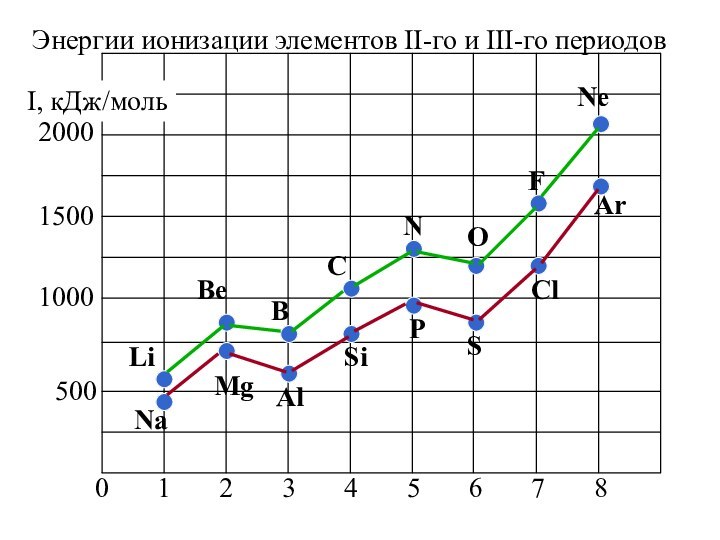
![Электрон 2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ) –](/img/tmb/14/1386670/74deede5f05012d97d298f2fa75725a0-720x.jpg)

![Электрон 2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это …Характер изменения в периодах одинаков:](/img/tmb/14/1386670/f473b35df209e5a4cc867445ab5b2853-720x.jpg)



![Электрон 3. Электроотрицательность () [кДж/моль] или [эВ/атом] – характеризует …χ](/img/tmb/14/1386670/da70a3cf7abd5bde3d46258abb211d2b-720x.jpg)
3. Электронные конфигурации атомов.
4. ПЗ Д.И. Менделеева.
5. Теории химической связи ( МВС и ММО).
- До каких пор можно делить порцию вещества?
~1900 г
Фотоэффект - испускание электронов металлами и полупроводниками при их освещении. (Столетов А.Г. 1889г.)
Радиоактивность – самопроизвольный распад атомов, сопровождающийся испусканием различных частиц. (А. Беккерель, 1896 г.)
В 1926 г Э. Шредингер
теорию движения микрочастиц –
квантовая (волновую) механику
создание современной квантово-механической модели строения атома.
Эта модель не наглядная !
( очень условное изображение)
λ=10-8 см
2. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в разных местах атомного пространства различна.
«Неужели действительно были такие идиоты, которые думали, что электрон вращается по орбите?»
Н. Бор
Решение этого уравнения, т.е. математическое описание орбитали (указание трех пространственных координат), возможно лишь при определенных значениях набора трех целых чисел n, l, ml, которые называют квантовыми.
Комбинация чисел n, l, и ml не одна, поэтому и решений уравнения Шредингера тоже несколько. Т.о, квантовые числа n, l, и ml (точнее их приемлемые комбинации) определяют геометрические особенности электронной плотности (АО).
Характеристика энергии электрона и пространственное распределение вероятности нахождения его в атоме системой квантовых чисел.
…можно говорить о существовании в атоме энергетических уровней (электронных слоев или оболочек), отвечающих определенным значениям главного квантового числа - n.
Характеризует..
Любому значению l соответствует (2l+1) возможных расположений электронного облака данного типа в пространстве.
Характеризует..
Все орбитали, принадлежащие одному подуровню данного энергетического уровня, имеют одинаковую энергию в отсутствии магнитного поля (вырожденные).
На самом деле …
На одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами. Максимальная емкость энергетического подуровня – 2(2+l ) электронов, а уровня – 2n2.
2. При одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением n
(3+0)
(3+1)
(3+2)
(4+0)
(4+1)
3
4
5
4
5
применяем второе правило К.
…3s 3p 4s 3d 4p…
Увеличение Е
1s22s22p63s23p64s23d104p65s24d105p66s2
4f145d106p67s25f146d107p6…
Сr : ….3d44s2 – неправильно
Сr : ….3d54s1 – правильно
Это определение немного ошибочно.
Современная формулировка ПЗ гласит: Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер в результате периодического повторения электронных конфигураций внешнего энергетического уровня.
2. Неравномерность в изменении ПИ …..
…ПИ (В 2s22p1) < ПИ (Ве 2s2) и
ПИ (О 2s22p4) < ПИ (N 2s22p3)
3. Атомы щелочных Ме (ns1) имеют самые низкие ПИ
4. Атомы благородных газов (ns2np6) имеют max ПИ
2. Незначительно СЭ у атомов с конфигурацией np3 (устойчивый наполовину заполненный подуровень)
3. Мах СЭ обладают атомы 7(А) группы – ns2np5
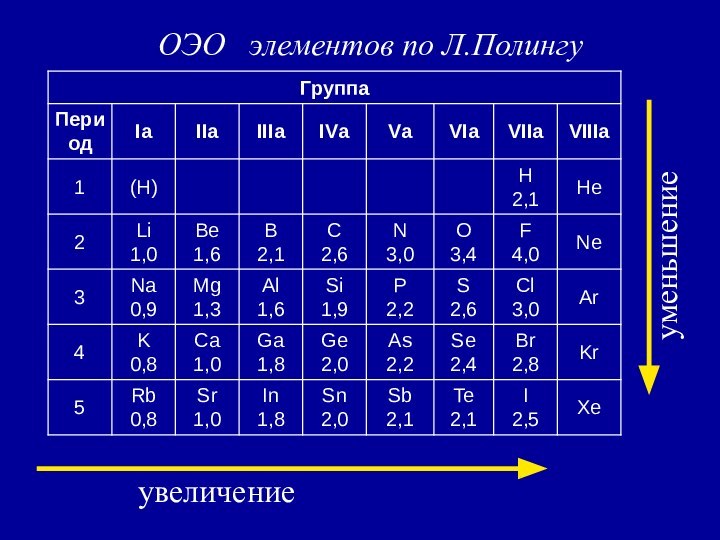
χ F = ½ (1700+310) = 1005 кДж/моль
По Полингу χ Li условно принята за 1,
тогда χ F = 1005 /280 = 3,6 . Т.о. получается безразмерная величина - относительная электроотрицательность (ОЭО).