Zn, Fe, Ag и др.):
- не зависит от аниона
соли,
окисление материала анода (его растворение),
перенос металла с анода на катод,
концентрация соли в растворе не меняется.
Пример: электролиз раствора (CuCl2, КCl, CuSO4) с медным анодом
на аноде, вместо разрядки ионов (Сl- и выделения хлора) протекает окисление анода (Cu0→ Cu2+ в раствор),
на катоде выделяется медь.
А (+) Cu0 - 2e = Cu2+
К (-) Cu2+ + 2e = Cu0 ↵
/активный, расходуемый/
Применение: при рафинировании (очистке) металлов от загрязнений, гальваностегии, гальванопластике.
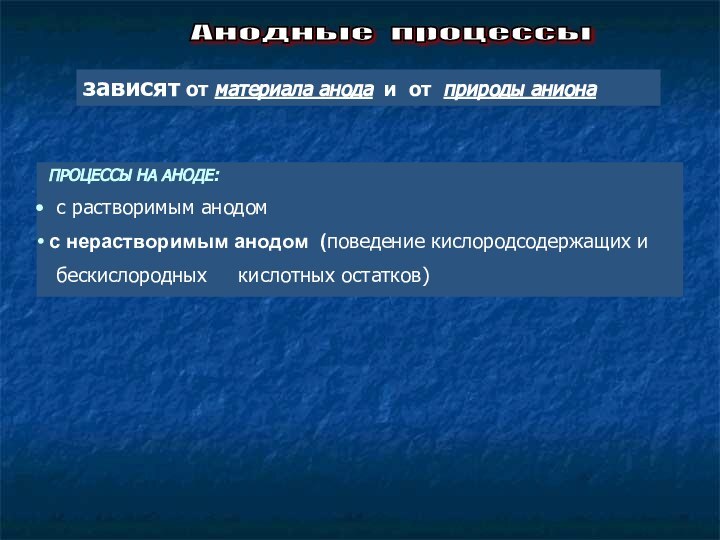
Конкурирующие реакции на электродах :
на аноде — окисление анионов и гидроксид-ионов,
анодное растворение металла (материала анода);
на катоде — восстановление катиона соли и Н+,
восстановление катионов Меn+, полученных при
растворении анода