- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Ковалентная химическая связь
Содержание
- 2. Ковалентная химическая связь.
- 5. Химическая связь – это силы взаимодействия, которые
- 8. Ковалентная связь – это химическая связь между атомами, осуществляемая с помощью общих электронных пар.
- 9. Джильбер Льюис1916 год Теория ковалентной связи
- 10. H· + ·Н = Н : Н
- 15. Схема образования
- 16. А как же образуются молекулы
- 17. Способность атомов химических элементов оттягивать к себе общие электронные пары, называется электроотрицательностью (ЭО)
- 18. Ряд электроотрицательности химических элементов H As I
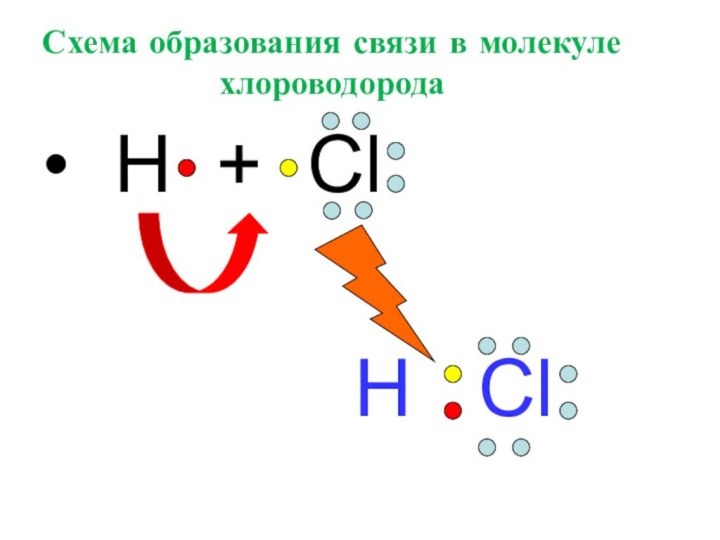
- 19. Схема образования связи в молекуле хлороводорода H
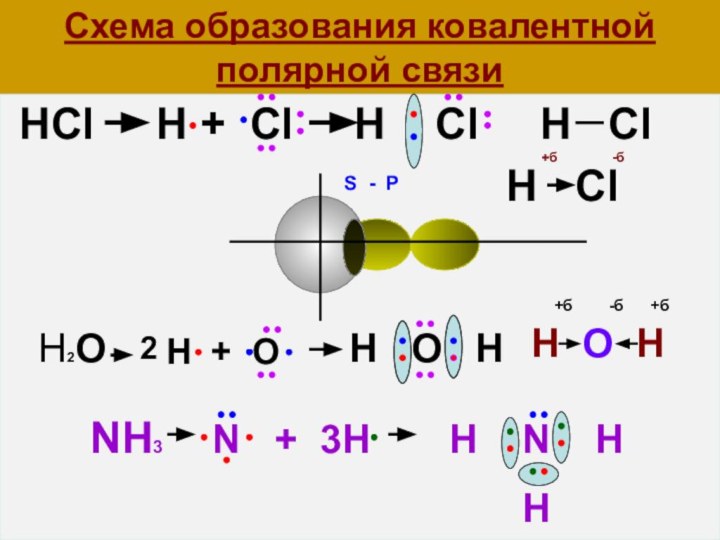
- 20. Схема образования ковалентной полярной связи HCl
- 21. Изобразить схему образования связи в
- 22. Разумеется, атомы менее ЭО будут иметь избыточный
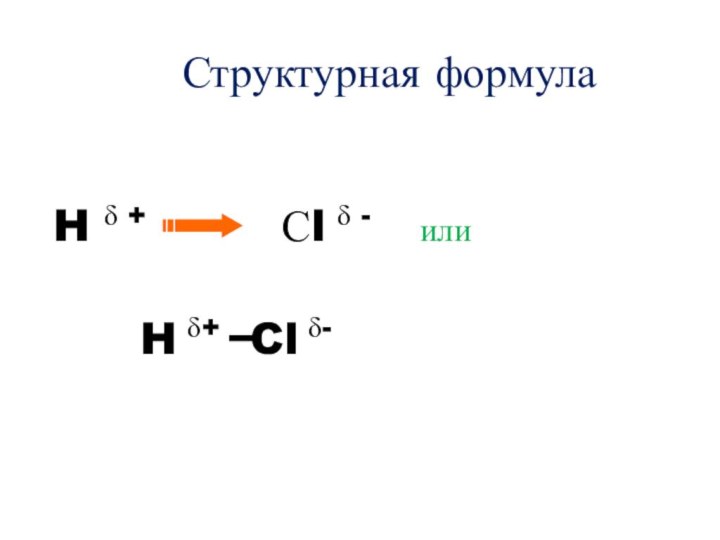
- 23. Структурная формула H δ +
- 24. - Возникновение общих электронных пар приводит к
- 25. Скачать презентацию
- 26. Похожие презентации
















Слайд 5 Химическая связь – это силы взаимодействия, которые соединяют
отдельные атомы в молекулы, ионы, кристаллы.
различное число химических связей с другими атомами называется валентностью.Слайд 8 Ковалентная связь – это химическая связь между атомами,
осуществляемая с помощью общих электронных пар.
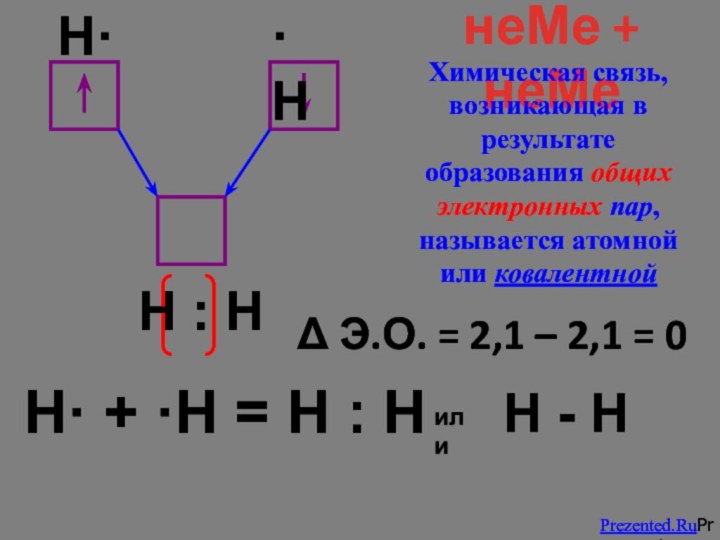
Слайд 10
H· + ·Н = Н : Н
Δ
Э.О. = 2,1 – 2,1 = 0
неМе + неМе
H·
·H
Н : Н
или
Н - Н
Химическая связь, возникающая в результате образования общих электронных пар, называется атомной или ковалентной
Prezented.RuPrezented.Ru
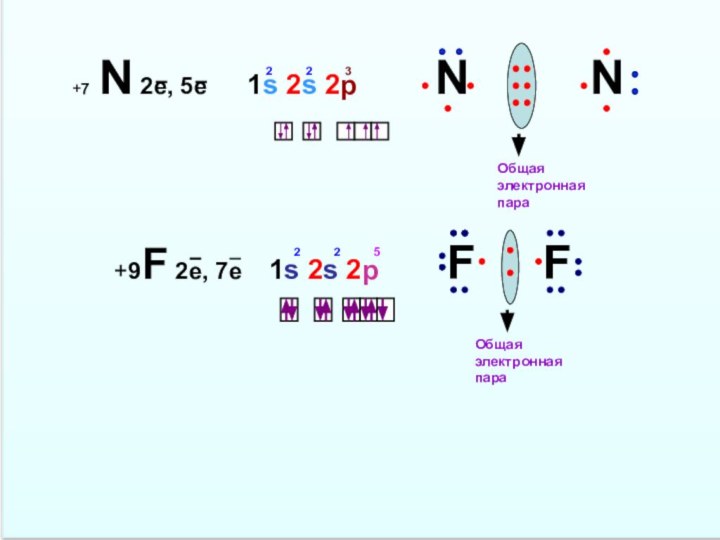
Слайд 14
+7 N 2е, 5е 1s 2s
2p N N +9F 2е, 7е 1s 2s 2p F F
2 2 3
2 2 5
Общая электронная пара
Общая электронная пара
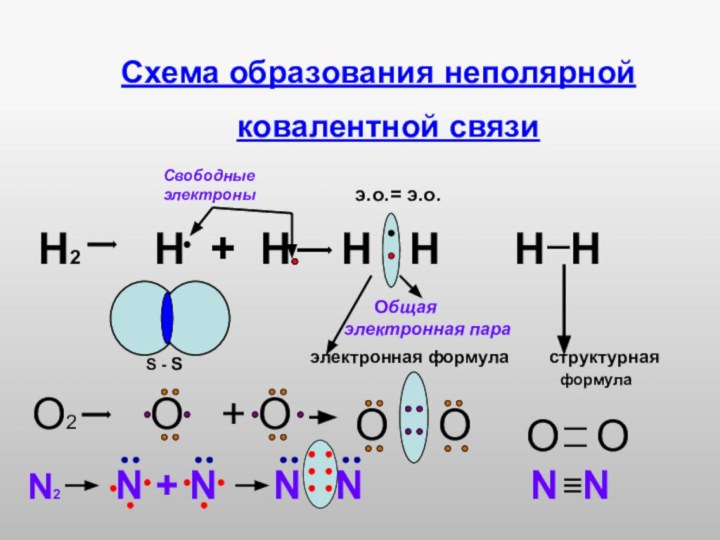
Слайд 15
Схема образования неполярной
Н2 Н + Н Н Н Н Н
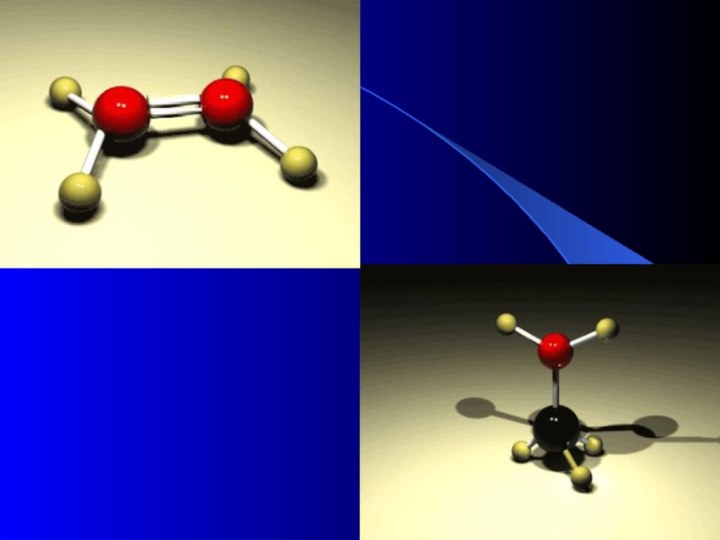
электронная формула структурная
О2 О + О
О О
О О
S - S
N2 N + N N N N N
э.о.= э.о.
Общая электронная пара
Свободные электроны
формула
Слайд 16 А как же образуются молекулы из
атомов разных неметаллов (сложных веществ):
HСl ,HF, Н₂О, Н₂S,
NН₃…?Слайд 17 Способность атомов химических элементов оттягивать к себе общие
электронные пары, называется электроотрицательностью (ЭО)
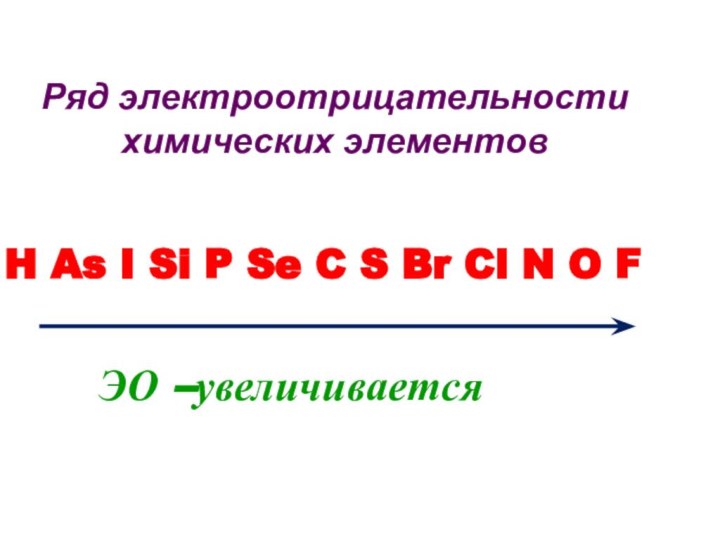
Слайд 18
Ряд электроотрицательности химических элементов
H As I Si
P Se C S Br Cl N O F
ЭО –увеличивается
Слайд 20
Схема образования ковалентной полярной связи
HCl
H + Cl H Cl
H ClH Cl
H + O
2
H2O
H O H
+б -б
Н О Н
+б -б +б
S - P
NH3 N + 3H H N H
H
Слайд 21 Изобразить схему образования связи в молекуле
хлороводорода HCl ;
•• •• H• + • Cl ׃ = H(׃) Cl ׃
•• ••
что произошло с электронными слоями у водорода и хлора в результате образования ковалентной связи?
Слайд 22 Разумеется, атомы менее ЭО будут иметь избыточный положительный
заряд, т.е. будут представлять собой как бы положительный полюс
молекулы с зарядом δ+, а более ЭО полюс с зарядом δ-.Вот вам и стало понятно название этой разновидности ковалентной связи – полярная .
Слайд 24 - Возникновение общих электронных пар приводит к образованию
ковалентной химической связи между атомами .
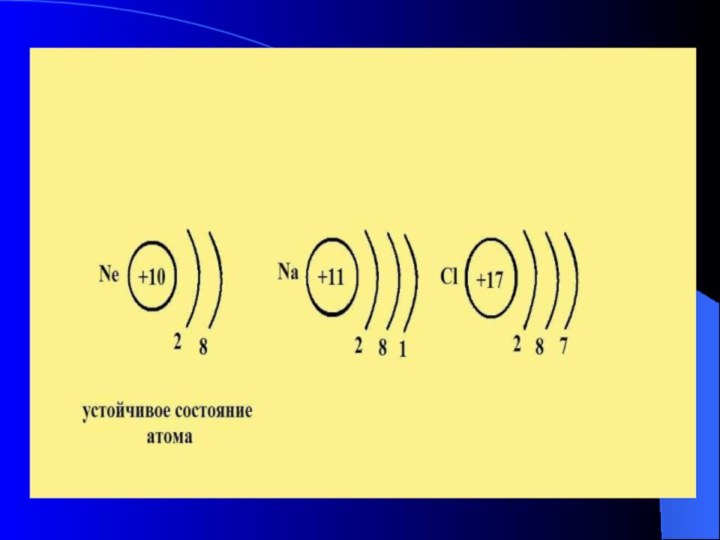
- Атомы образуют химические
связи, чтобы приобрести устойчивую 8-электронную конфигурацию внешнего энергетического уровня. - Состав вещества можно выражать в виде:
Молекулярной формулы HCl
Электронной формулы
Структурной формулы H–Cl
Выводы: