Слайд 2
Презентация методической разработки раздела учебной программы
Тема: «Растворение. Растворы.
Свойства растворов электролитов»
Программа курса химии для 8 – 11
классов общеобразовательных учреждений, автор О.С. Габриелян – М.: «Дрофа» 2007г.
Предмет: Химия. 8 класс. О.С. Габриелян- М.: «Дрофа» 2007г.
Слайд 3
Особенности образовательной программы и учебника
О.С. Габриеляна:
сохранение целостности и системности
учебного
предмета за небольшое,
жестко лимитированное учебное время.
Слайд 4
Методологическая основа построения учебного содержания курса химии базового
уровня для основной школы –
идея концентрического подхода.
Слайд 5
Раздел «Растворение. Растворы. Свойства растворов электролитов»
Задачи:
Изучить основные
положение теории электролитической диссоциации (С. Аррениуса) и гидратную теорию
растворов (Д. И. Менделеева).
Развить у учащихся логическое мышление, умение анализировать и сравнивать, работать с дополнительной информацией.
Cформировать коммуникативные качества, культуру общения, чувства ответственности.
Цель: изучение свойств основных классов неорганических соединений в свете теории электролитической диссоциации.
Слайд 6
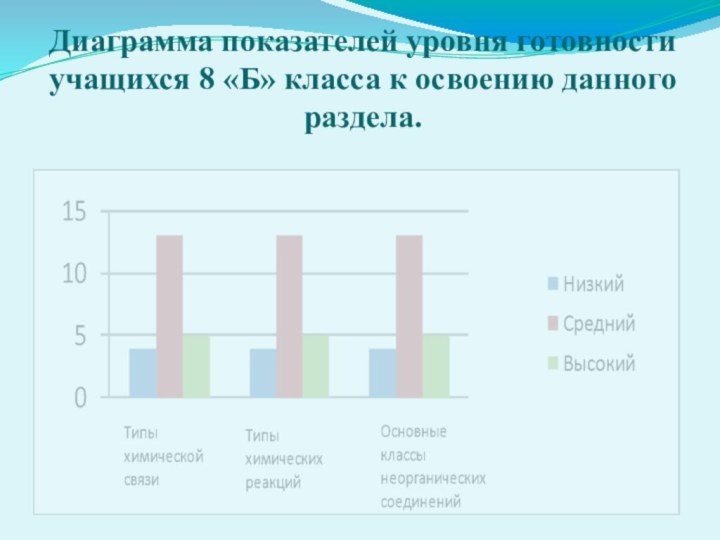
Диаграмма показателей уровня готовности учащихся 8 «Б» класса
к освоению данного раздела.
Слайд 7
Результаты освоения раздела программы
Знание химической символики, важнейших
химических понятий, основных законов и теорий.
Умение объяснить сущность
химической реакции, написать уравнение в полном и сокращенном ионном виде, определить принадлежность вещества к классу соединений, составить ОВР.
Развитие навыков безопасного общения с
веществами, экологически грамотного поведения в окружающей среде, оценки информации о веществах, используемых в быту
Слайд 8
Методы, используемые при изучении данного раздела:
1.
Словесно- наглядный (беседа, рассказ, химический эксперимент, использование схем,
рисунков, таблиц).
2. Практический (самостоятельные и практические работы).
3. Игровой метод .
4.Исследовательский метод (метод проектов).
5.Наблюдение.
Слайд 9
Химический эксперимент
Демонстрационный
Ученический
Испытание веществ и их растворов на электропроводность.
Зависимость
электропроводности уксусной кислоты от концентрации.
Взаимодействие цинка с серой, соляной
кислотой, хлоридом меди (II).
Горение магния.
Реакции, характерные для растворов кислот.
Реакции, характерные для растворов щелочей.
Получение и свойства нерастворимого основания.
Реакции, характерные для растворов солей.
Реакции, характерные для основных оксидов.
Реакции, характерные для кислотных оксидов.
Слайд 10
Требования к химическому эксперименту
Демонстрационный
Безопасность
Наглядность
Простота
Надежность
Ученический
Соблюдение правил по т/б
Понимание
Правильное оформление отчета
Слайд 11
Виды демонстрационного эксперимента
Пассивный
Активный
Слайд 12
Виды ученического эксперимента
Практический
Лабораторный
Слайд 13
Цели использования самостоятельных работ
Слайд 14
Самостоятельная работа школьников.
Формы:
коллективная, групповая,
индивидуальная.
Виды самостоятельной работы:
ученический эксперимент,
решение химических
задач и упражнений,
работа с литературой;
выполнение творческих заданий;
письменные работы контрольного характера .
Слайд 15
«Один опыт я ставлю выше чем тысячу мнений,
рожденных только воображением»
М . В. Ломоносов
Тема урока: «Кислоты в
свете теории электролитической диссоциации»
Цель урока: Рассмотреть свойства кислот в свете теории электролитической диссоциации. Развивать умение групповой и индивидуальной работы
Оборудование:
Реактивы (10%-ный раствор соляной кислоты, гидроксида натрия, раствор карбоната натрия, нитрата серебра, хлорида цинка, лакмус,фенолфталеин); лабораторное оборудование (штатив с пробирками, пипетки); дидактический материал (таблица растворимости, карты-исследований, карточки-инструктажи, карточки с домашним заданием);
Тип урока: урок повторения и обобщения с элементами исследования.
Слайд 16
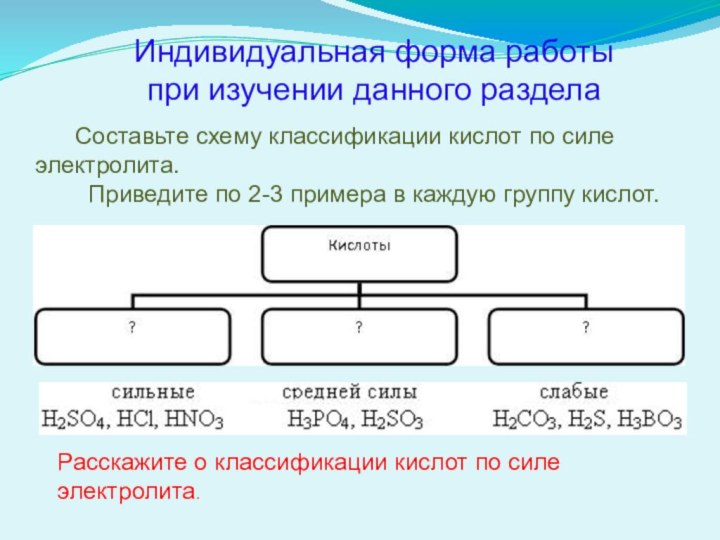
Индивидуальная форма работы при изучении данного раздела
Составьте схему классификации кислот по силе электролита.
Приведите по 2-3 примера в каждую группу кислот.
Расскажите о классификации кислот по силе электролита.
Слайд 17
Групповая форма работы при изучении данного раздела
Цель исследования:
Выполнение
лабораторного опыта по группам.
Соблюдение правил по Т/Б при выполнении
данных опытов.
Оформление результатов в карте исследований.
Предоставление результатов исследования другим лабораториям.
Слайд 18
Выполнение лабораторного опыта в группах по лабораториям
1-я лаборатория
– взаимодействие кислоты с металлами.
2-я лаборатория – взаимодействие кислоты
с основаниями.
3-я лаборатория – взаимодействие кислоты с солями.
4-я лаборатория – индивидуальные свойства кислот.
Слайд 19
Карточка – инструкция №1
Изучите химическое свойство кислот -
взаимодействие с активными металлами по следующему плану:
Налейте в пробирку
1 мл соляной кислоты (!!!Соблюдайте осторожность).
Добавьте одну гранулу цинка.
Наблюдайте за происходящем в пробирке.
Запишите в своей карте исследований под соответствующим пунктом молекулярное, полное ионное и сокращённое ионное уравнение химической реакции взаимодействия цинка с соляной кислотой.
Отметьте результаты опыта в молекулярном уравнении реакции.
Подчеркните в ионных уравнениях химической реакции ион водорода.
Сделайте вывод о взаимодействии металлов с кислотами и укажите тип химической реакции.
Слайд 20
Оформление отчета (карточка №1)
1-я лаборатория:
Взаимодействие с активными металлами.
Вывод:
металлы взаимодействуют с кислотами. Тип реакции – реакция замещения.
Слайд 21
Карточка – инструкция №2
Изучите химическое свойство кислот –

взаимодействие с основаниями по следующему плану:
Налейте в пробирку 1
мл гидроксида натрия (!!!Соблюдайте осторожность).
Добавьте с помощью пипетки 1-2 капли фенолфталеина.
Отметьте какую окраску приобрёл раствор гидроксида натрия.
Добавляйте к раствору гидроксида натрия понемногу соляной кислоты(!!!Соблюдайте осторожность). После введения каждой порции кислоты пробирку встряхивайте. Кислоту добавляйте до тех пор, пока не исчезнет окраска индикатора.
Запишите в своей карте-исследований под соответствующим пунктом молекулярное, полное ионное и сокращённое ионное уравнение химической реакции взаимодействия гидроксида натрия с соляной кислотой.
Отметьте результаты опыта в молекулярном уравнении реакции.
Подчеркните в ионных уравнениях химической реакции ион водорода.
Как называется реакция между основанием и кислотой, в результате которой образуется соль и вода? Укажите название реакции в карте - исследований в скобках рядом с названием данного химического свойства. Сделайте вывод о взаимодействии кислот с основаниями и укажите тип химической реакции.
Слайд 22
Оформление отчета (карточка №2)
2-я лаборатория:
Взаимодействие с основаниями:
Вывод: кислоты
взаимодействуют с основаниями. Тип реакции – реакция обмена.
Слайд 23
Карточка – инструкция №3
Изучите химическое свойство кислот -
взаимодействие с солями по следующему плану:
Налейте в пробирку 1
мл соляной кислоты ( !!!Соблюдайте осторожность).
Добавьте 1 мл карбоната натрия.
Наблюдайте за происходящем в пробирке.
Запишите в своей карте-исследований под соответствующим пунктом молекулярное, полное ионное и сокращённое ионное уравнение химической реакции взаимодействия карбоната натрия с соляной кислотой. Вспомните правило, которому подчиняется взаимодействие кислот с солями.
Отметьте результаты опыта в молекулярном уравнении реакции.
Подчеркните в ионных уравнениях химической реакции ион водорода.
Сделайте вывод о взаимодействии кислот с солями и укажите тип
химической реакции.
Слайд 24
Вывод: кислоты взаимодействуют с солями. Тип реакции –
реакция обмена.
Оформление отчета (карточка №3)
3-я лаборатория:
Взаимодействие с солями:
Слайд 25
Карточка – инструкция №4
Изучите индивидуальное свойство кислот (
качественную реакцию) по следующему плану:
Используя, имеющиеся в наличии химические
реактивы осуществите 2 химические реакции, которые выражены следующим сокращённым уравнением реакции:
Ag+ + Cl- = AgCl ↓
Оформите данный опыт на ватмане, записав сокращённое ионное, полные ионные и молекулярные уравнения химических реакций (!крупно). Подчеркните кислотный остаток в ионных уравнениях реакций.
Отметьте цвет осадка в сокращённом ионном уравнении реакции.
Дайте названия продуктам реакции.
Качественную реакцию на какую кислоту и соль вы проводили? Наличием какого иона в растворе объясняются индивидуальные свойства всех кислот?
Сделайте вывод.
Слайд 26
4-я лаборатория получила отдельное задание – провести 2
химические реакции, которые выражены сокращёнными ионными уравнениями и составить
на основе сокращённого ионного уравнения реакции полное ионное и молекулярное уравнение реакции, характеризующее индивидуальное свойство кислоты.
Вывод: индивидуальные свойства кислот объясняются присутствием в растворе ионов кислотного остатка.
Оформление отчета (карточка №4)
Слайд 27
Функции игр на уроках
Обучающая.
Развивающая.
Воспитательная.
Релаксационная.
Развлекательная.
Слайд 29
Игра «Химическая эстафета»
Углерод
Кислотный оксид
Кислота
Соль
Основание
Основный оксид
Кальций
1
2
3
4
5
7
8
6
Слайд 30
Ролевая игра при изучении
данного раздела
Слайд 31
ПРОЕКТ
УЧЕНИК РАЗВИВАЕТ:
теоретическое мышление
УЧЕНИК ПРОЯВЛЯТ:
рефлексию, произвольность, способность
к саморегуляции
УЧЕНИК ОВЛАДЕВАЕТ
самостоятельными формами работы
Цели проекта
Слайд 32
ПЛАН ПРОЕКТА
Формулирование темы проекта, его целей, задач.
Составление
учителем методических и дидактических материалов к проекту.
Этапы реализации проекта.
Презентация
результатов проекта на уроке-конференции.
Оценивание работы по проекту участниками, учителем.
Подведение итогов.
Слайд 33
Темы проектов
Влияние кислотных дождей на состояние водоема
Влияние химических
веществ на прорастание, рост и развитие растений
Влияние химических веществ
на жизнь животных водоёма
Слайд 34
Деятельность учащихся при выполнении проекта
Т В О Р
Ч Е С Т В О
Организационно-
подготовительный
этап:
Поиск проблемы.
Выбор и обоснование проекта. Анализ предстоящей деятельности.
Подбор материалов.
Планирование технологического
процесса.
Технологический этап:
Выполнение технологических
операций, предусмотренных
технологическим процессом.
Самоконтроль своей
Деятельности.
Заключительный этап:
Контроль и испытание изделия.
Корректировка конструкторско-
технологической документации.
Подведение итогов.
Защита проекта.
Слайд 35
Функции учителя при работы над проектам
Помогает ученикам в
поиске информации.
Сам является источником информации.
Координирует весь процесс.
Поддерживает обратную связь.
Поощряет
учеников.
Слайд 36
Отражение законов философии при изучении данного раздела
Закон единства
и борьбы противоположностей
Закон перехода количества в качество
Закон отрицания отрицания
Слайд 37
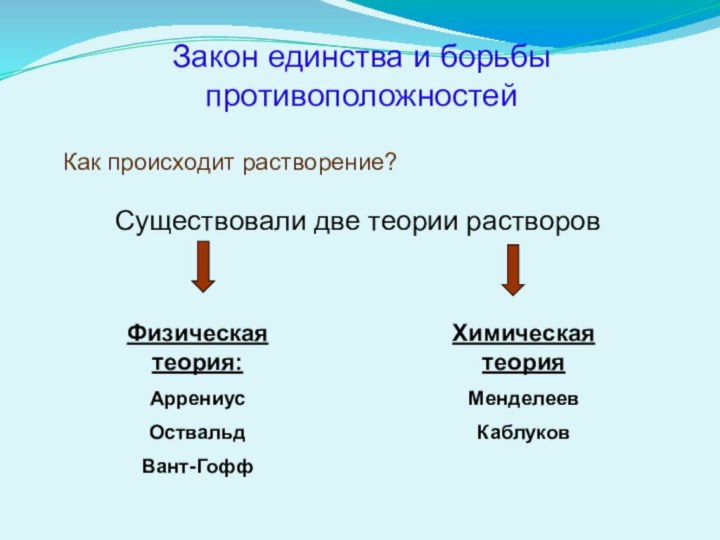
Закон единства и борьбы противоположностей
Как происходит растворение?
Существовали две
теории растворов
Физическая теория:
Аррениус
Оствальд
Вант-Гофф
Химическая теория
Менделеев
Каблуков
Слайд 38
1889 г, Лейпциг
Иван Алексеевич Каблуков
Сванте Аррениус
Слайд 39
Проанализируем теории
Правы ли сторонники физической теории? (правы,
диффузия идет);
Правы ли сторонники химической теории? (правы, хим. реакция
идет, тепло выделяется);
Какая их теорий глубже рассматривает процесс растворения? (химическая)
Обе теории верны, значит их нужно объединить (физико-химическая теория);
Вывод: растворение – это физико-химический процесс
Слайд 40
Связь раздела с другими науками
Математика
Физика
Биология
География
Геология
Медицина
экология
Литература
Слайд 41
Диаграмма показателей уровня готовности учащихся 8 «Б» класса
к освоению данного раздела.