Слайд 2
Химия занимает важное место в системе школьного образования.
При изучении химии преимущественно используется описательная часть курса. Количественные
закономерности рассматриваются не систематически. Умение решать расчетные задачи является одним из показателей уровня развития химического мышления школьников.
Если недостаточно внимания уделять этому важному вопросу, то, как показывают проверочные контрольные работы, олимпиады, вступительные экзамены, учащиеся слабо решают расчетные задачи по химии.
Выход из положения - правильное использование задач в учебном процессе. Недопустим эпизодический характер обучения решению расчетных задач.
Слайд 3
Порядок решения задач
1. Краткая запись условия задачи
2. Запись
уравнения химической реакции
3. Запись известных и неизвестных величин над
формулами веществ
4. Запись под формулами веществ:
Молярной массы
Объема
Количества веществ
5. Решение задачи
(2 части: I) химическая и II) математическая)
Слайд 4
Химическая часть задачи:
1. Чтение текста
2. Запись условия задачи
3.
Определение типа задачи
4. Анализ задачи – составление плана решения
1.
Выбор способа решения
2. Решение
3. Запись ответа
4. Анализ решения
Математическая часть задачи:
Слайд 5
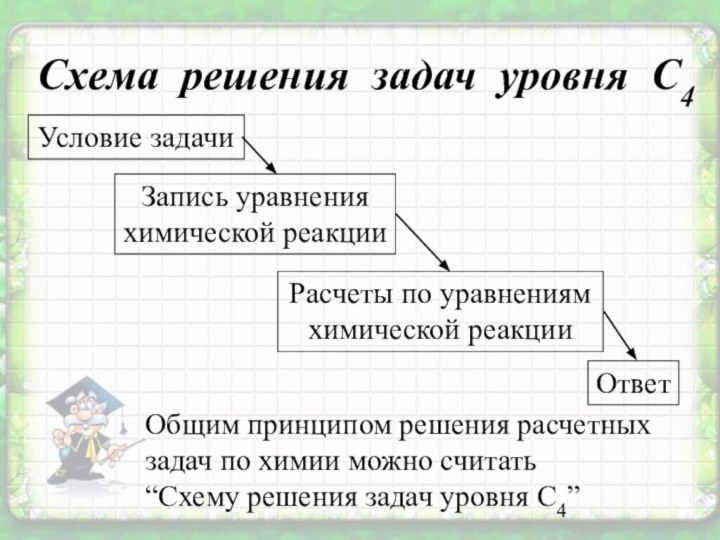
Схема решения задач уровня С4
Общим принципом решения расчетных
задач по химии можно считать
“Схему решения задач уровня С4”
Условие
задачи
Запись уравнения
химической реакции
Расчеты по уравнениям
химической реакции
Ответ
Слайд 6
С4
1. Расчеты по уравнению реакций
5. Нахождение массы одного
из исходных веществ по уравнению материального баланса
2. Задачи на
смеси веществ
3. Задачи на “тип соли” (определение состава продукта реакции)
4. Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса
Слайд 7
Задача С4 (2008 года)
Сероводород объемом 5,6л (н.у.) прореагировал
без остатка с 59,02мл раствора гидроксида калия с массовой
долей 20% (ρ=1,186г/мл). Определите массу соли, полученной в результате этой химической реакции.
1. Тип 3 «Тип соли».
2. Избыток и недостаток.
3. Определение состава соли.
4. Определение массы продуктов реакции – соли.
Слайд 8
Задача С4 (2009 года)
Магний массой 4,8г растворили в
200мл 12%-ного раствора серной кислоты (ρ=1,5г/мл). Вычислите массовую долю
сульфата магния в конечном растворе.
1. Тип 4 «Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса».
2. Избыток и недостаток.
3. Вычисление массовой доли вещества в растворе.
4. Определение массы растворенного вещества.
Слайд 9
Задача С4 (2010 года)
Карбид алюминия растворили в 380г
раствора хлороводородной кислоты с массовой долей 15%. Выделившийся при
этом газ занял объем 6.72л (н.у.). Рассчитайте массовую долю хлороводорода в полученном растворе.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Составление уравнения для расчета массовой доли исходного вещества
Слайд 10
Задача С4 (2011 года)
Нитрит калия массой 8,5г внесли
при нагревании в 270 г раствора бромида аммония с
массовой долей 12%. Какой объем (н.у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе?
1.Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнения реакции.
3. Нахождение количества вещества, их массы, объема.
4. Составление уравнения для расчета массовой доли исходного вещества.
Слайд 11
Задача С4 (2012 года)
К раствору гидроксида натрия массой
1200 г прибавили 490г 40%-ного раствора серной кислоты. Для
нейтрализации получившегося раствора потребовалось 143г кристаллической соды Na2CO3*10H2O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Составление уравнения для расчета массовой доли исходного вещества.
Слайд 12
Задача С4 (2013 года)
Определите массовые доли (в %)
сульфата железа и сульфида алюминия в смеси, если при
обработке 25г этой смеси водой выделился газ, который полностью прореагировал с 960г 5%-ного раствора сульфата меди.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Нахождение количества вещества, их массы.
4. Определение массовой доли исходных веществ смеси.
Слайд 13
Задания С4 (2002 года)
1. Объясните, почему при нитровании
толуола происходит замещение атомов водорода только у 2-го, 4-го
и 6-го атомов углерода, но никогда не замещаются атомы водорода у 3-го и 5-го атомов углерода.
2. Составьте схема получения бензола из целлюлозы. Запишите уравнения реакций с указанием условий их протекания.
3. Какое из оснований сильнее – аммиак или диметиламин? Объясните почему. Приведите уравнения реакций, подтверждающих их основные свойства.
Слайд 14
Примеры задач уровня С4
Тип 1. Расчеты по уравнению
реакций.doc
Тип 2. Задачи на смеси веществ.doc
Тип 3. Тип соли.doc
Тип
4. Материального баланса.doc
Тип 5. Материального баланса.doc
Слайд 15
Список литературы
Несомненно большую помощь Вам окажут книги:
Доронькин,
В.Н. Химия. 9 класс. Тематические тесты по подготовке к
ГИА-9 / В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. - Ростов на/Д.: Легион, 2011. - 368 с.
Корощенко, А.С. ГИА. Химия. Типовые тестовые задания / А.С. Корощенко, Ю.Н. Медведев - М.: Экзамен, 2014. - 96 с.
Медведев, Ю.Н. ЕГЭ. Химия. Практикум / Ю.Н. Медведев. – М.: Экзамен, 2010. - 125 с.
Медведев, Ю.Н. ЕГЭ. Типовые тестовые задания / Ю.Н. Медведев. - М.: Экзамен, 2011. - 160 с.
Задания ГИА-9 (книга)